
- •Лекция 7 ароматические соединения
- •1. Ароматичность.
- •2. Изомерия и номенклатура
- •3. Способы получения.
- •3.1. Промышленные способы получения
- •3.2. Лабораторные способы получения
- •4. Физические свойства
- •5. Химические свойства
- •5.1. Реакции присоединения
- •5.2 Окисление бензола
- •5.3 Реакции электрофильного замещения
- •5.4 Механизм реакции электрофильного замещения
- •5.5. Реакции электрофильного замещения катализируемые кислотами Бренстеда и σ-кислотами.
- •1. Сульфирование
- •3. Алкилирование в присутствии минеральных кислот.
- •5.6. Реакции электрофильного замещения катализируемые кислотами Льюиса.
- •5.7. Правила ориентации в электрофильном ароматическом замещении.
- •5.8. Химические свойства боковых цепей.
5. Химические свойства
Химические свойства ароматических соединений делятся на две большие группы.
1. Химические свойства ароматического кольца.
2. Химические свойства заместителей.
Ароматическое кольцо и заместители оказывают друг на друга определенное влияние. Поэтому свойства кольца рассматриваются обязательно при учете влияния заместителей, а свойства функциональных групп, выступающих в роли заместителей, обязательно рассматриваются отдельно от свойств ациклических и неароматических соединений.
Химические свойства ароматического кольца рассматриваются на примере химических свойств бензола.
Наиболее характерны для бензола реакции электрофильного замещения (SEAr), однако бензол способен вступать в некоторые реакции присоединения и как каждое органическое соединение способен вступать в реакции окисления (в том числе и горит с выделением большого количества копоти).
Поскольку реакций присоединения меньше то и следует начать с них.
5.1. Реакции присоединения
1. Присоединение водорода с образованием циклогексана в присутствии платинового или палладиевого катализатора при температуре 3000С.
2. В жестких условиях под влиянием ультрафиолетового излучения или яркого солнечного света бензол способен присоединить три молекулы хлора:

Однако со временем или при нагревании гексахлорциклогексан отщепляет три молекулы хлористого водорода с образованием 1,3,5-трихлорбензола:

3. Бензол подвергается озонолизу:

При присоединении озона образуется триозонид (сильно взрывчатое вещество). Под действием воды озонид распадается с образованием трех молекул глиоксаля.
5.2 Окисление бензола
Бензольное кольцо в условиях, в которых окисляются алкены и алкины - не окисляется. Бензол окисляют кислородом воздуха на катализаторе пентаоксиде ванадия:
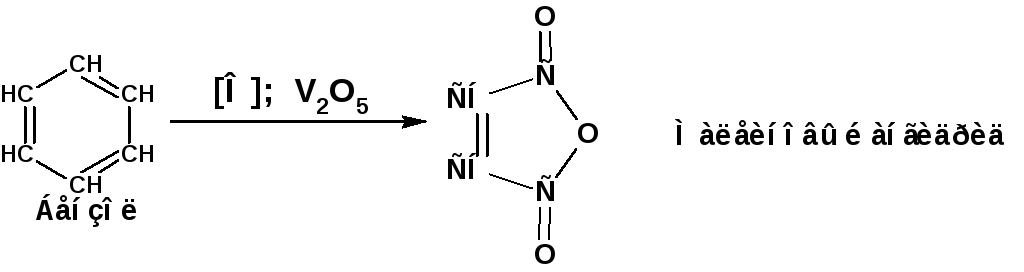
Продуктом реакции является малеиновый ангидрид. Реакция заложена в основу промышленного способа производства малеинового ангидрида.
5.3 Реакции электрофильного замещения
Бензол нитруется, сульфируется, галогенируется, алкилируется, ацилируется по механизму электрофильного замещения.
5.4 Механизм реакции электрофильного замещения
Наиболее типичной реакцией электрофильного замещения является реакция нитрования бензола, приводящая к образованию нитробензола:
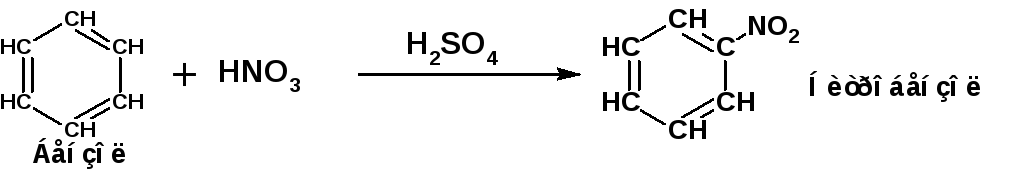
Механизм реакции электрофильного замещения включает пять стадий.
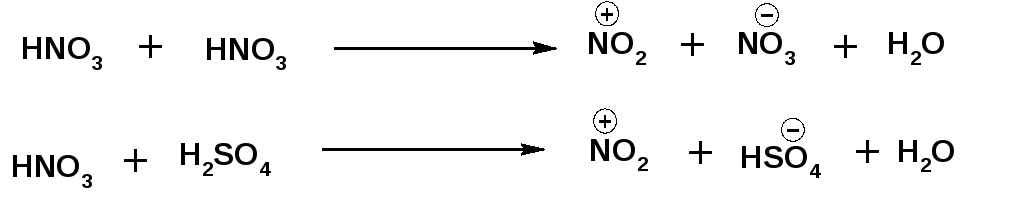
1. На первой стадии образуется электрофильный реагент. В условиях реакции нитрования электрофильным реагентом является нитроний–катион. Образуется нитроний–катион в результате взаимодействия двух молекул азотной кислоты или взаимодействия молекулы азотной кислоты и молекулы серной кислоты:
2. На второй стадии образуется π-комплекс между молекулой бензола и электрофильным реагентом. Особенность π-комплекс в том, что все атомы углерода в молекуле субстрата находятся в состоянии sp2-гибридизации:
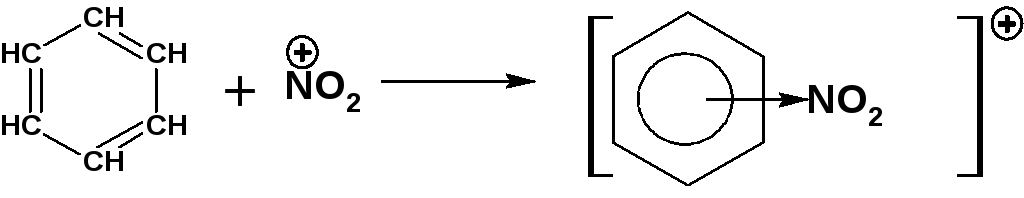
3. На третье стадии один атом углерода бензольного кольца переходит в состояние sp3-гибридизации. При этом образуется σ-комплекс или бензенониевый (аренониевый) ион:
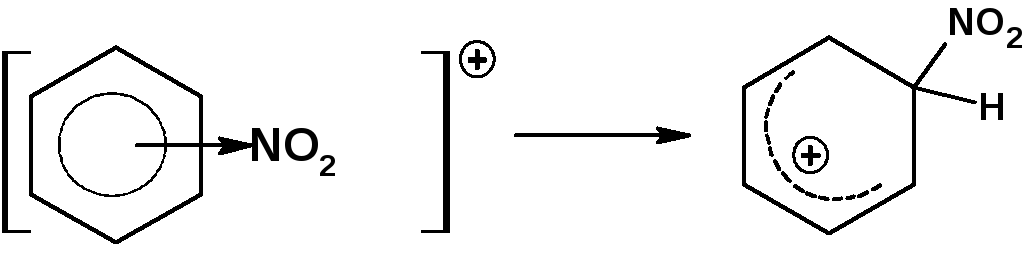
4. На четвертой стадии σ-комплекс перегруппировывается во второй π-комплекс с замещенным атомом углерода:
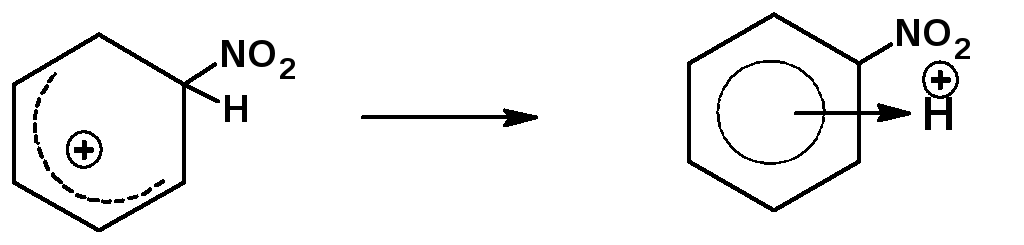
5. На пятой стадии π-комплекс диссоциирует с образованием конечного продукта замещения:
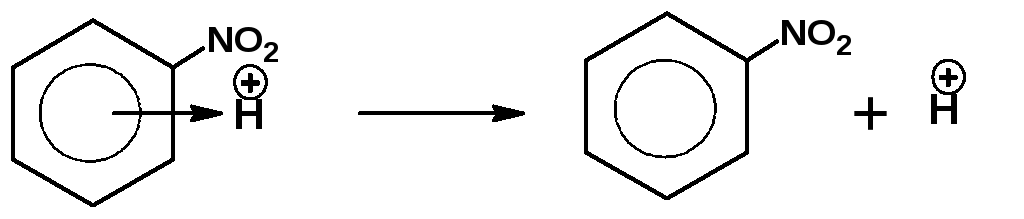
На четвертой стадии механизма σ-комплекс мог бы присоединить нуклеофильный реагент, что привело бы к образованию продукта присоединения и разрушению ароматической системы. Система предпочитает сохранить ароматическую систему, и сама делает выбор в пользу замещения.
