
Вариант №2.
1.Какие термодинамические характеристики из перечисленных ниже являются функциями состояния:
а) работа;
б) внутренняя энергия;
в) теплота;
г) энтальпия;
д) энтропия.
2.Синтез белка в организме человека является эндэргоническим процессом. Знак ΔGº для неё
а) положителен
б) отрицателен
в) положителен или отрицателен в зависимости от внешних факторов
3.Возрастание вероятности самопроизвольного протекания реакции при увеличении температуры выполняется для
а) 2Н2S(г) +SO2(г) → 3S(т) + 2H2O(г); ΔНº > 0, ΔSº > 0
б) FeO(т) +CO(г) →Fe(т) +CO2(г); ΔНº < 0, ΔSº < 0
в) обеих реакций
4.Термохимическое уравнение реакции
С (к) + О2(г) → СО2(г) – 412 кДж
Масса сожжённого угля, необходимая для выделения 206 кДж, равна
а) 12 г
б) 6г
в) 12 кг
5. Данная диаграмма есть диаграмма
а) Системы с неограниченной растворимостью компонентов в жидком состоянии. В твердом состоянии компоненты образуют химические соединения, которые плавятся конгурэнтно;
б) Системы с неограниченной растворимостью в жидком и твердом состояниях;
в) Системы с неограниченной растворимостью компонентов в жидком и взаимной нерастворимостью в твердом состоянии.
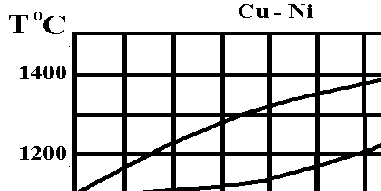
6. В фигуративной точке "а" система обладает числом степеней свободы, равным:
а) 2 б) 1 в) 0
7.Весовое количество фаз в т.А (масса расплава 1000 кг) равно:
а) 3,0
б) 1,5
в) 2,0
8.Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с растворителем пропорционально:
молярности растворенного вещества;
моляльности растворенного вещества;
молярной доле растворенного вещества;
9.Величина адсорбции фенола из водного раствора концентрация при С = 0,0156 кмоль/м3, фенола= 58,2 • 10-3Дж/м2,воды= 72,75 мДж/м2равна
а) 2,9410-6
б) 29,410-6
в) 0,29410-6
10.ПИАВ по отношению к воде является вещество
а) С7 Н15–ОН
б) NH2С Н2COОН
в) HNO3
11.В качестве противоядия при отравлениях метанолом применяют этанол. Обоснованием такому применению этанола является
а) более высокая поверхностная активность этанола по сравнению с метанолом;
б) равенство
![]() gметанола
иgэтанола
gметанола
иgэтанола
в) более высокая поверхностная активность метанола по сравнению с этанолом
12.Для очистки водного раствора лекарственного препарата, содержащего примеси органических веществ, лучше всего использовать адсорбент
а) любой
б) полярный микропористый;
в) неполярный микропористый
13. Схема процесса, протекающего при пропускании водного раствораNaOHчерез катионит в Н+- форме
а) R-Br + NaOH ↔ R-OH + NaBr
б) R-H + NaOH ↔ R- Na++ H2O
в) R-SO2H + NaOH ↔ R-SO2Na + H2O
14.Частицы золяCdS, полученного смешением равных объёмовNa2SиCd(NO3)2, перемещаются в электрическом поле к катоду. Строение мицеллы золя
а)
![]()
б)
![]()
в)
![]()
15. При взаимодействии избытка сульфата меди (II) с гексацианоферратом (II) калия образовался золь, в диффузном слое которого находятся ионы
а) К+
б) SO42-
в)Cu2+
16.Через бумажный фильтр проходят коллоидные частицы с размером
а) эмульсии (d= 107104)
б) органеллы (d= 103м)
в) спиртовой раствор канифоля (d= 109 107м)
17.Действие электролитов-коагулянтов вызывает
а) сжатие диффузного слоя частиц
б) увеличение электростатического заряда частиц
в) упрочнение адсорбционно-сольватных оболочек
18.ИоныAl3+являются эффективным коагулянтом для золя
а) {[mAs2S3]·nS2-(2n-x)H+}x-·xH+
б) {[mFe(OH)3]·nFe3+3(n-x)Cl-}3x+·3xCl
в) {[mBaSO4]·nBa2+2(n-x)SO42-}2x+·2xSO42
19. Объем раствора Al2(SO4)3с С(Al2(SO4)3) = 0,6 моль/дм3, который требуется для коагуляции 1 дм3золя (Сп(Al2(SO4)3= 9610-3моль/дм3) равен:
а) 0,190
б) 0, 290
в) 0,320
20. При коагуляция золя железа (v=11 мл) раствором сульфата калия (С=0,01 моль/л) наступает при добавлении 0,4 мл раствора казеината натрия, а при 0,3 мл ее еще нет. Железное число гидрозоля железа, защищенного раствором казеината натрия (=0,5%) равно:
а) 0,18
б) 0,16
в) 0,14
ИТОГОВЫЙ ТЕСТ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
