
- •Комплексные соединения. Комплексообразующая способность s, p, d элементов.
- •Соединения первого порядка (валентно-ненасыщенные)
- •Комплексные соединения – …
- •Теория А. Вернера (1893г.)
- •Теория А. Вернера (1893г.)
- •Строение комплексных
- •Номенклатура комплексных соединений
- •Номенклатура комплексных соединений
- •Классификация комплексных соединений по разным признакам
- •Классификация комплексных соединений по разным признакам
- •Классификация комплексных соединений по разным признакам
- •Классификация комплексных соединений по разным признакам
- •Классификация лигандов
- •Гибридизация – …
- •Типы гибридизации орбиталей центрального иона
- •Спектрохимический ряд
- •Влияние поля лигандов на окраску комплексов
- •Диссоциация КС по внешней сфере
- •Диссоциация КС по внутренней сфере (вторичная диссоциация)
- •Реакции комплексных соединений по внешней сфере
- •Реакции комплексных соединений с разрушением комплекса
- •2. Образование малорастворимого соединения
- •Комплексообразующая способность s, p, d элементов
- •Комплексообразующая способность s,p,d элементов
- •Комплексообразующая способность s,p,d элементов
- •Металлолигандный гомеостаз – …
- •Причины нарушения
- •Причины нарушения
- •Причины нарушения
- •Термодинамические принципы хелатотерапии
- •Детоксиканты хелатотерапии
- •Детоксиканты хелатотерапии

Комплексные соединения. Комплексообразующая способность s, p, d элементов.
Соединения первого порядка (валентно-ненасыщенные)
Fe (CN)3
+
3KCN CoCl+ 6
3NH3
BF+ 3
HF
Ni
+
4CO
Соединения высшего порядка (валентно-насыщенные)
K3[Fe(CN)6]
[Co(NH3)6]Cl3
H[BF4]
[Ni(CO)4]

Комплексные соединения – …
… молекулярные соединения, не показывающие в растворе всех свойств исходных для них, соединений первого порядка, т.е. соединения определённого состава, образованные в результате координации ионов или нейтральных молекул вокруг центрального атома или иона.
[MLn]Xm
M – центральный атом L – лиганд
X – внешняя сферическая частица MLn – комплексный ион

Теория А. Вернера (1893г.)
Основные положения:
•Катионы могут проявлять не только основную валентность, но и дополнительную. Основные валентности насыщаются только анионами, дополнительные – и анионами, и нейтральными молекулами.
•Каждый комплекс имеет центральный ион (комплексообразователь).
•Каждый комплекс характеризуется координационным числом, которое показывает количество ионов или молекул, находящихся вокруг центрального атома.

Теория А. Вернера (1893г.)
•Координированные ионы и молекулы называются лигандами, они образуют внутреннюю сферу координационного соединения.
•Ядро комплекса составляет центральный ион и внутренняя сфера. Ядро может быть заряженным и нейтральным.
•Если ядро заряжено, то комплекс имеет внешнюю сферу, т.к. ядро способно притягивать противоположно заряженный ион.
K3[Fe(CN)6] ↔ 3K+ + [Fe(CN)6]3–
ионная связь
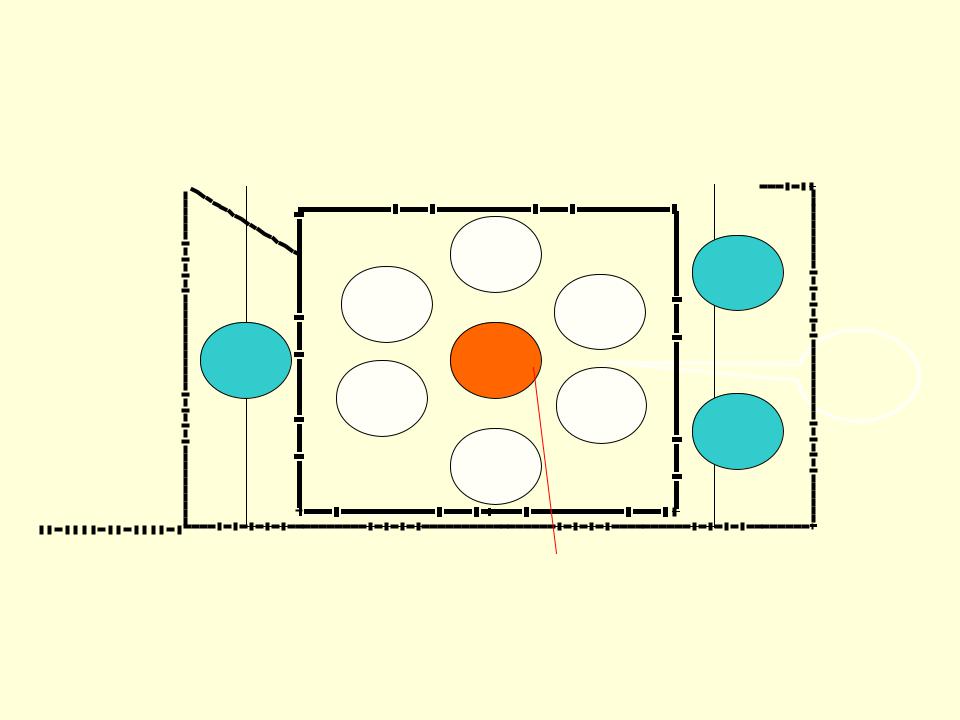
Строение комплексных
Внутренняя соединений
сфера 
















|
CN- |
K+ |
CN- |
|
|
|
CN- |
|
K+ |
Fe3+ |
лиганды |
CN- |
|
|
|
CN- |
|
|
CN- |
K+ |
|
|
|
Внешняя сфера |
|
|
К |
|
[[Fe (CN) ] |
→3 K+ |
|
|
Ион |
|
|
|||||
|
3 |
6 |
→ [Fe (CN)6]3- |
комплексообразователя |
||
|
|
|||||
Калий гексацианоферрат (III)

Номенклатура комплексных соединений
1.Первым называют анион, вторым – катион.
2.В комплексном ионе или молекуле первым указывают лиганды (сначала анион, затем – нейтральные, в алфавитном порядке).
3.Комплексным катионам пристраивается окончание «о»; нейтральные лиганды называются, как соответствующие молекулы. Например, Н2О – аква, NH3 – амин.

Номенклатура комплексных соединений
4.Комплексообразователь (указывается его степень окисления римскими цифрами). В комплексном катионе названия русские, в анионе – латинские с суффиксами «ат».
5.Число лигандов каждого вида указывают приставками (ди-, три-, тетра- и т.д.).
[Cr(NH3)6]3+Cl3 – гексаамминхрома (III) [CoF6]3–Na3 – гексафторокобальтат (III) натрия

Классификация комплексных соединений по разным признакам
1.По знаку электрического заряда комплекса
2.Принадлежности к определённому классу соединений
3. Природе лигандов |
Нейтральные |
||
Катионные |
|
||
|
Анионные |
|
|
4. Внутренней структуре комплексного соединения |
|||
[Co(CN)2(NH3)4]Cl |
|
[Ni(CO)4] |
|
(число ядер; наличие циклов). |
|
||
|
K4[Fe(CN)6] |
|
|
хлорид |
гексацианоферрат |
Тетракарбонил |
|
|
никель (II) |
||
тетраамминдициано |
(II) калий |
||
|
|||
-кобальт (III)

Классификация комплексных соединений по разным признакам
2. По принадлежности к определённому классу соединений
комплексные
кислоты |
основания |
соли |
H[AuCl4] |
[Ag(NH3)2]OH |
K2[HgI4] |
водород |
гидрооксид |
тетраиодомеркурат (II) |
тетрахлороаурат (III) |
диамминсеребра (I) |
калия |
