
- •ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ.
- •Теория электролитической диссоциации Аррениуса – 1880 г.
- •1. Кислота – вещество, дающее в растворе ионы водорода.
- •Недостатки теории Аррениуса:
- •Электронная теория Льюиса
- •Протолитическая теория Бренстеда и Лоури
- •Типы протолитических реакций
- •2. Автопротолиз воды.
- •Водородный показатель
- •Виды кислотности (щелочности)

ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ.
Лектор: Задорожная А.Н.

Теория электролитической диссоциации Аррениуса – 1880 г.
Основные положения теории Аррениуса
1.Электролиты при растворении в воде распадаются на ионы.
2.Электролиты при растворении диссоциируют на ионы не полностью.
3.Диссоциация обратимый процесс

1. Кислота – вещество, дающее в растворе ионы водорода.
HCl H+ + Cl-
H+ + Cl-
Основание – вещество, дающее в растворе ион ОН-
|
|
KOH |
|
K+ + OH- |
|
|
|
||
2.Степень электролитической диссоциации – |
||||
|
n |
где n – число молекул, распавшихся на ионы |
||
|
|
|
|
|
N |
N – общее число, растворенных молекул |
|||
|
|
|||
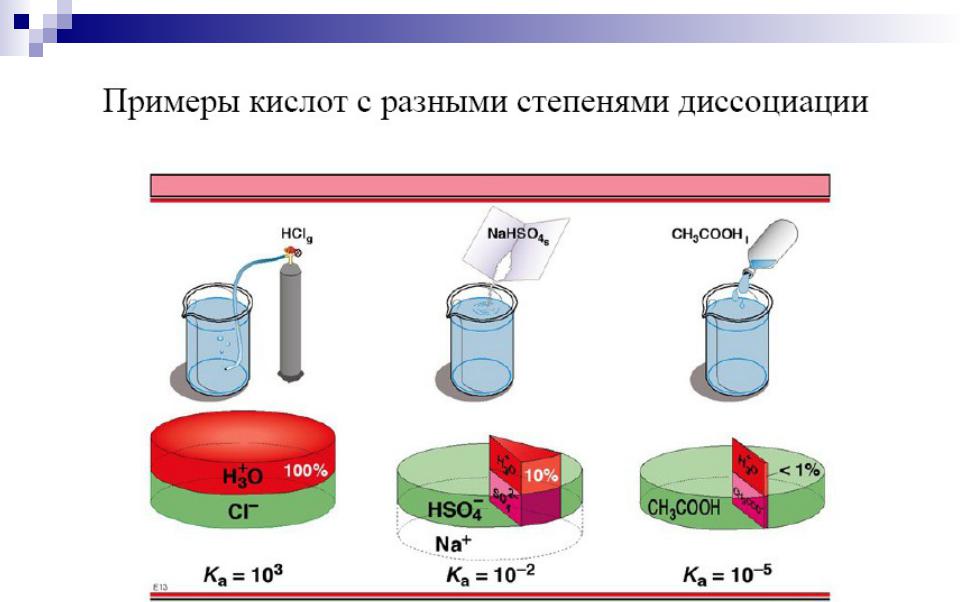
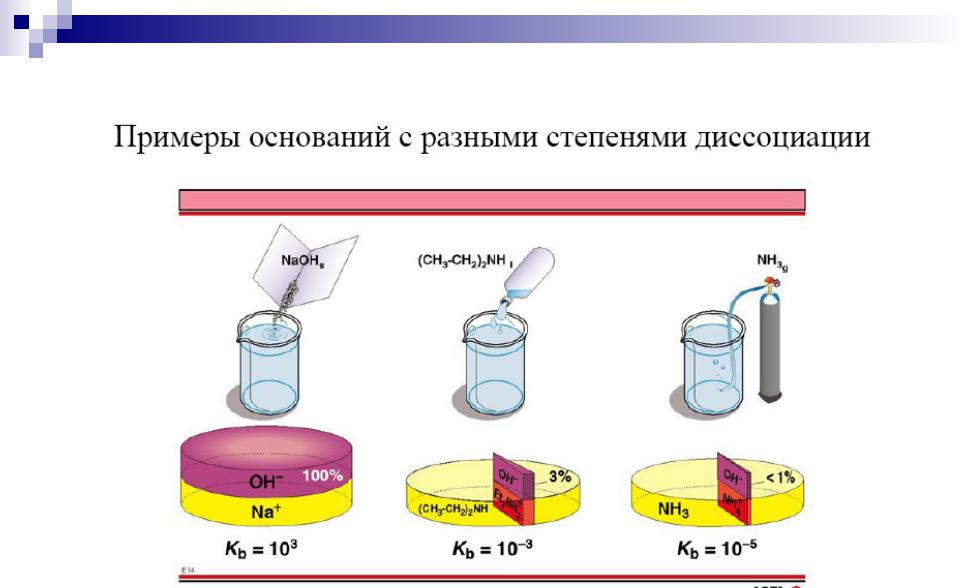
Сильные электролиты - |
α > 30 % |
|||
Слабые электролиты - |
α < 3 % |
|||
Электролиты средней силы - 3% < α < 30 %

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH COO |
H |
|
||
|
|
|
|
|
|
|
3 |
|
|
|
3. СН3СООН |
|
|
СН3СОО- + Н+ |
K ÄÈÑ |
|
|||||
|
|
CH3COOH |
|
|
||||||
|
|
|
|
|
|
|
|
|
||
В общем виде для кислоты НА: |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
K ÄÈ Ñ |
H |
A |
|
|
НА |
|
Н+ + А- |
|
HA |
|
|
||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
OH |
|
|
Для основания ВОН: |
K ÄÈÑ |
|
|
|
|
||||
|
BOH |
|
|||||||
|
|
|
|
|
|
|
|
|
|
ВОН В+ + ОН- |
|
|
|
|
|||||
|
|
|
|
|
|||||

Недостатки теории Аррениуса:
а) не объясняла причину диссоциации электролитов на ионы; б) роль растворителя при диссоциации не рассматривалась; в) неверные оказались определения понятий кислоты и
основания; г) не работает для неводных сред;
д) применима только к растворам слабых электролитов.

Электронная теория Льюиса
Кислота акцептор электронной пары.
Основание донор электронной пары.
В + А В А
Гилберт Ньютон Льюис (1875-1946)

Протолитическая теория Бренстеда и Лоури
Кислота – молекула или ион, способные отдавать протон (кислота – донор протона).
HCl H+ +Cl- |
NH+4 H+ +NH3 |
||||
кислота |
сопряженное |
кислота |
сопряженное |
||
|
основание |
|
|
основание |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Сопряженная кислотно-основная пара
Основание–молекула или ион, способные присоединять протон (основание – акцептор протона).
NH3 +H+ NH4+
основание |
сопряженная |
|
кислота |
||
|
Сопряженная кислотно-основная пара

Типы протолитических реакций
Н+
1.Реакции ионизации |
Н2CО3 |
+ H2O ↔ НCО3- + |
H3O+ |
|
кислота |
основание сопряженное |
сопряженная |
|
|
основание |
кислота |
Константа кислотности (Ка) и константа основности (Кb) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H O |
A |
|
|||
HA H O |
|
|
H O A |
K |
|
3 |
|
|
|
|
|
|
|
||||||||
|
HA |
|
||||||||
2 |
|
3 |
a |
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HB |
OH |
|
|
B H2O |
|
|
HB OH |
Kb |
|
|
|
|
|
|
|
||||||
|
|
|
||||||
|
|
|
B |
|
||||
|
|
|
|
|
|
|
|
Ka Kb |
Kw êî í ñò àí ò à àâò î ï ðî ò î ëèçà âî äû |
