
- •Термодинамика окислительно- восстановительных процессов
- •Окислительно-восстановительные реакции
- •Определение степеней окисления атомов химических элементов
- •4. СО иона при образовании его из отдельного атомаравна
- •Распространенные окислители и восстановители
- •Окислительно-восстановительные реакции
- •Правила составления уравнений окислительно-восстановительных реакций
- •3.Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых
- •Правила составления уравнений окислительно-восстановительных реакций
- •2. Составляют схему каждой полуреакции
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Направление окислительно- восстановительных реакций
- •Направление окислительно- восстановительных реакций
Термодинамика окислительно- восстановительных процессов
Лекция №4 Лектор Задорожная А.Н.

Окислительно-восстановительные реакции
….химические процессы, сопровождающиеся переносом электронов от одних молекул или ионов к другим
e 0 |
+ |
|
2+ |
|
Mg + H SO = MgSO + H 0 |
||||
|
2 |
4 |
4 |
2 |
Окисление – процесс отдачи электронов атомом, молекулой или ионом. Mg0 - 2e Mg2+
Восстановление – процесс присоединения электронов атомом, молекулой или ионом. 2Н+ + 2e Н2

Определение степеней окисления атомов химических элементов
CO – это заряд атома, определяющийся из допущения, что молекула состоит из ионов
1. |
СО простых веществ равна 0 |
Zn0, O20, Ag0 |
|
2. |
СО водорода в водородсодержащих соединениях равна +1 |
||
|
(исключение – гидриды металлов) |
1 |
1 |
|
H2O, |
HCl |
|
|
|
1 |
1 |
|
|
Al H2 ,Ca H2 |
|
3. |
СО кислорода в кислородсодержащих соединениях равна -2 |
||
|
(исключение – пероксиды и соединения с фтором)2 2 |
||
|
|
C O2 , |
H2 O |
|
|
1 |
2 |
|
|
H2 O2 , |
OF2 |

4. СО иона при образовании его из отдельного атомаравна
величине заряда иона |
Na 1, |
Mg 2 , |
Br 1 |
|
5. Алгебраическая сумма СО всех элементов в составе иона
равна заряду иона |
SO2 |
PO3 |
|
||
|
4 |
4 |
|
6 4( 2) 2 |
5 4( 2) 3 |
6. Алгебраическая сумма СО всех элементов в составе сложного вещества равна 0
CH4 H2SO4
4 4( 1) 0 2( 1) 6 4( 2) 0
Распространенные окислители и восстановители
Окислители |
Восстановители |
1. Свободные неметаллы (в элементарном состоянии), пере- ходящие в отрицательные ионы
фтор |
F2 + 2e 2F - |
кислород |
O2 + 4e 2O 2- |
хлор |
Cl2 + 2e 2Cl – |
2.Положительные ионы, переходящие
внейтральное состояние
Ag+ + 1e Ag0
2Н+ + 2e Н2
3. Атомы, имеющие высшие положи- тельные степени окисления (СО), переходящие в ионы с более низкой СО
Cu+2 + 1e Cu+
ClO3- +6e + 6 Н+ Cl- + 3 H2O
1.Металлы, образующие катионы
цинк |
Zn0 – 2e → Zn2+ |
натрий |
Na0 –e → Na+ |
2. Неметаллы, соединяющиеся с другими неметаллами
3C + Fe2O3 3CO + 2Fe0
3. Атомы, имеющие низшие СО, переходящие в состояние с более высокой СО
Fe+2 - 1e Fe+3
NO - 3e + 2 H2O NO3- + 4 Н+
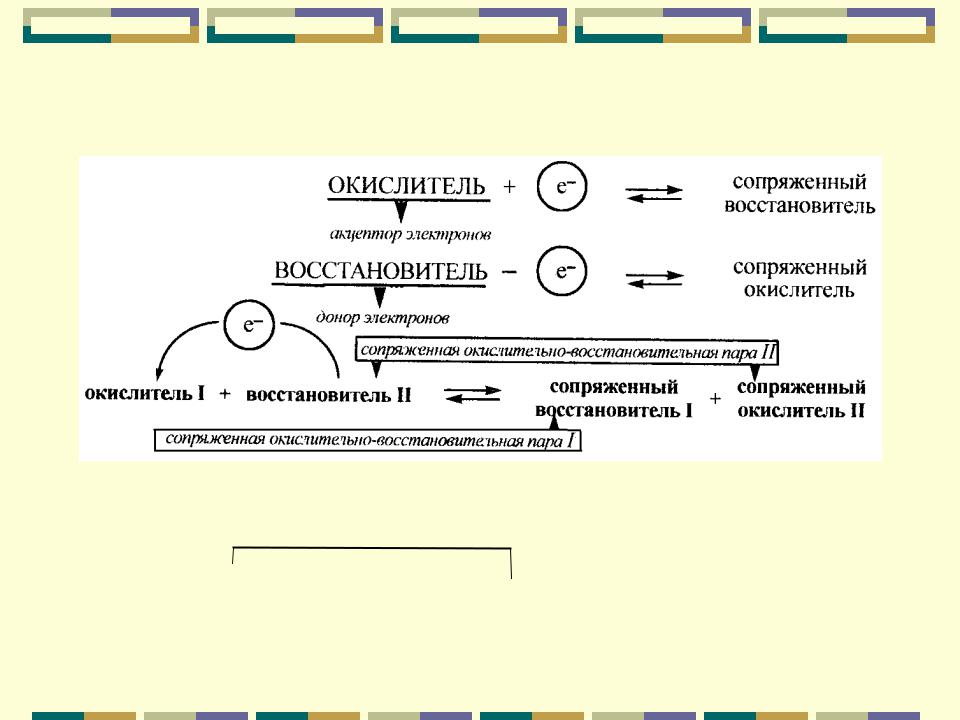
Окислительно-восстановительные реакции
|
|
|
|
Сопряженная Ox-Red пара I |
|
0 |
|
2 |
1 |
0 |
|
I 2 |
H2 S |
2 H I |
S |
||
|
|
|
|
|
Сопряженная Ox-Red пара II |
Ox I |
Red II |
Red I |
|
||
Ox II |
|||||

Правила составления уравнений окислительно-восстановительных реакций
Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления.
Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1.Записывают схему реакции.
KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
2.Проставляют степени окисления над знаками элементов, которые меняются.
7 |
1 |
2 |
0 |
|
K MnO4 |
H Cl MnCl2 |
Cl2 |
KCl H2O |
|

3.Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē Mn+2
2Cl-1 - 2ē Cl20
4.Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
Mn+7 + 5ē Mn+2 |
|
2 |
|
2Cl-1 - 2ē Cl20 |
|
|
5 |
|
|||
2Mn+7 + 10Cl-1 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
7 |
1 |
2 |
0 |
|
2K MnO4 |
16H Cl 2 MnCl2 |
5Cl2 |
2KCl 8H2O |
|
Правила составления уравнений окислительно-восстановительных реакций
Ионно-электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между ионами (молекулами), содержащих элемент, изменяющий свою степень окисления.
Уравнение составляется в несколько стадий:
1.Записывают ионную схему реакции.
KMnO4 + HCl |
|
MnO Cl |
|
|
4 |
|
Среда |
Продукт |
MnO - |
кислая |
Mn2+ |
4 |
|
(соль) |
|
щелочная |
MnO42- |
|
|
(манганат-ион) |
|
нейтральная |
MnO2 |
Mn2 Cl2
Признак реакции
 бесцветный раствор
бесцветный раствор 
фиолетовый
раствор
бурый осадок

2. Составляют схему каждой полуреакции
MnO4 Mn2
Число атомов кислорода в левой и правой частях схем уравнивают с помощью молекул воды, взятых в количестве, соответствующем разности между числом атомов кислорода в исходном веществе и продукте реакции.
рН < 7
Молекулы воды записываются в той части уравнения, где наблюдается недостаток кислорода. В другую часть полуреакции записывают необходимое для равенства число ионов водорода.
рН > 7
Молекулы воды в количестве, соответствующем разности между числом атомов кислорода в левой и правой частях схемы, записывают в той части уравнения, где имеется избыток кислорода. Гидроксид-ионы в количестве, превышающем в 2 раза число молекул воды, записывают в другую часть уравнения полуреакции.
рН = 7
Молекулы воды записывают всегда в левую часть полуреакции. В правую часть полуреакции записывают либо протоны, либо гидроксид-ионы, необходимые для выравнивания кислорода и водорода в обеих частях полуреакции.

MnO |
8H Mn2 4H |
O |
MnO4 |
8H 5e Mn2 4H2O |
4 |
2 |
|
|
|
2Cl Cl2 |
2Cl 2e Cl2 |
3. Записываем общее уравнение реакции
MnO4 |
8H 5e Mn2 4H2O |
2 |
|
|
||
2Cl 2e Cl2 |
|
5 |
|
|
||
|
|
|
|
|
|
|
2 MnO 16H |
10Cl 2Mn2 8H |
O 5Cl |
2 |
|||
|
4 |
|
2 |
|
|
|
2K MnO4 16H Cl 2 MnCl2 5Cl2 2KCl 8H2O
