
- •ХИМИЧЕСКОЕ
- •Химические
- •Признаками необратимости реакции могут быть следующие факторы:
- •ХИМИЧЕСКОЕ РАВНОВЕСИЕ …
- •Особенности состояния химического равновесия
- •ЗАКОН ДЕЙСТВУЮЩИХ МАСС
- •ЗАКОН ДЕЙСТВУЮЩИХ МАСС
- •ВЗАИМОСВЯЗЬ МЕЖДУ КС И КР
- •Задача
- •Взаимосвязь КС с энергией Гиббса
- •Влияние концентрации реагентов
- •Соотношение Пс и Кр
- •Влияние температуры
- •Влияние давления
- •Смещение химического равновесия
- •Принцип адаптивных перестроек

ХИМИЧЕСКОЕ
РАВНОВЕСИЕ
Лекция №3 Лектор Задорожная А.Н.

Химические
реакции
Обратимые
реакции в которых одновременно протекают 2 взаимно противоположные реакции
H2 + I2 2HI
Необратимые
реакции которые протекают в одном направлении 2Са + О2 2СаО

Признаками необратимости реакции могут быть следующие факторы:
1) образование труднорастворимого осадка:
BaCl2 + Na2SO4 BaSO4↓ + 2NaCl
2) образование малодиссоциирующих веществ (H2O):
NaOH + HCl NaCl + H2O
3) Большой экзотермический эффект:
C2H6(г) + 7/2O2(г) 2CO2(г) + 3H2O + 372,8 ккал/моль
4) удаление продуктов из реакционной среды, например, в виде газов (H2S, CO, CO2, H2, Cl2,…):
CaCO3 + 2HCl CaCl2 + H2O + CO2↑
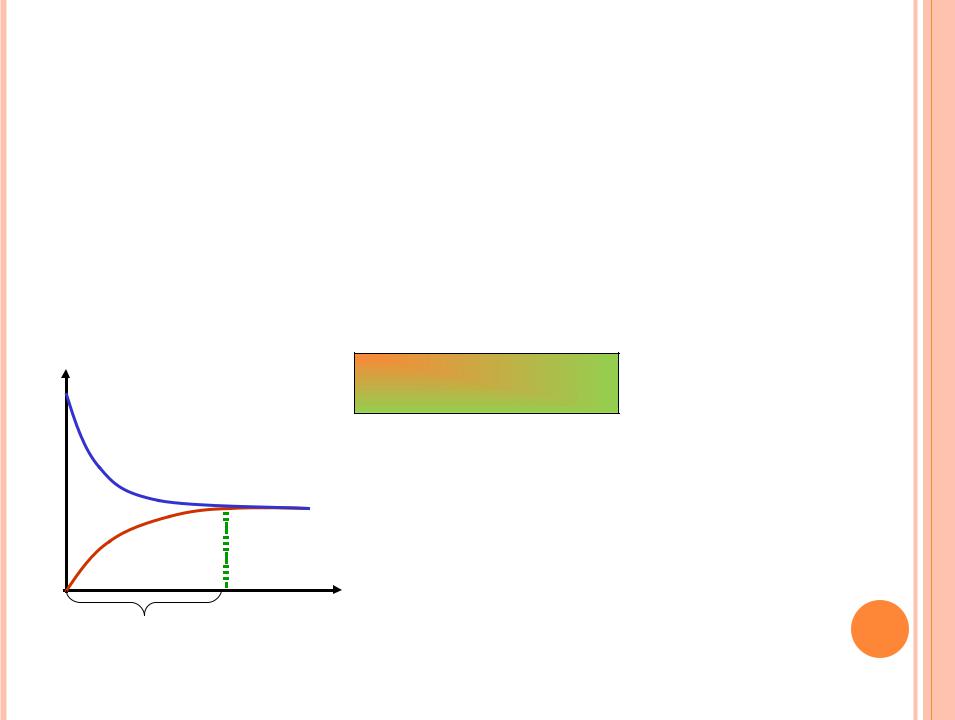
ХИМИЧЕСКОЕ РАВНОВЕСИЕ …
… состояние обратимого процесса при котором
скорость прямой и обратной реакции равны.
aA + bB cC + dD
|
прямой = обратной |
|
Химическое
равновесие
tравн. t
Концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия называются
равновесными концентрациями

Особенности состояния химического равновесия
Динамический характер прямая и обратная реакции не прекращаются, а протекают с равными скоростями.
Постоянство во времени – при неизменных внешних условиях состав равновесной системы не меняется (равновесные концентрации постоянны).
Подвижность равновесия – при изменении внешних условий происходит смещение химического равновесия, т.е. установление новых равновесных концентраций всех реагирующих веществ.
Возможность подхода к состоянию равновесия с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.

ЗАКОН ДЕЙСТВУЮЩИХ МАСС
В состоянии химического равновесия отношение произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ в степенях, равных их стехиометрическим коэффициентам при Т=const называется константой равновесия.
aA + bB сС + Dd
a |
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
k1 [A] |
[B] |
K k1 |
|
|
|
c |
|
|
d |
K |
|
||||
|
|
|
|
|
|
|
|
C |
|
|
D |
|
|
|
|
k2 [C]c |
[D]d |
|
eq |
k2 |
|
|
|
|
|
|
|
b |
|
c |
|
|
|
|
A |
a B |
|
|
|||||||||
k [A]a [B]b k |
2 |
[C]c |
[D]d |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ЗАКОН ДЕЙСТВУЮЩИХ МАСС
|
K |
|
|
|
c |
d |
Газовые реакций |
|
PC |
PD |
|||
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
P a P b |
||
|
|
|
|
|
A |
B |
Гетерогенные реакции |
|
Kc |
CO2 |
|||
С(тв) + О2(газ) СО2(газ) |
|
O2 |
||||
Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия
Концентрация Н2О в выражении константы химического
равновесия величина постоянная

ВЗАИМОСВЯЗЬ МЕЖДУ КС И КР
|
|
|
|
|
|
|
ac |
ad |
|
|
|
Ka |
|
а = |
|
||
C |
D |
|
|
|
|
aAa aBb |
|
C |
|
||
|
|
|
|||
Кс=Кр(RT) n
n=(c+d)(a+b) – изменение числа моль в реакции.
Кс >1 – прямая реакция Кс <1 – обратная реакция Кс < 103 Кс = 0 – равновесие

Задача
При нагревании смеси газообразных водорода и йода до 420ºС установились следующие равновесные концентрации реагентов:
[H2]=2 103 моль/л, [I2]=2,5 104 моль/л, [HI]= 5 103 моль/л.
Каково значение констант равновесия Кс и Кр при этих условиях?
Решение
H2 + I2 2HI
|
|
C |
|
|
c |
D |
|
d |
|
|
HI |
|
2 |
|
|
5 10 |
3 |
|
||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Kc |
|
|
|
|
|
|
|
Kc |
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
H2 |
I2 |
|
|
|
|
||||||||||||
|
|
|
|
a |
|
|
b |
2 10 |
3 |
|
4 |
|||||||||
|
|
A |
|
|
B |
|
|
|
|
|
2,5 10 |
|
||||||||
n = (c + d) - (a + b) = 2 – (1+1)=0 Кс = Кр

Взаимосвязь КС с энергией Гиббса
aA + bB сС + dD
Gp Gp0 RT ln |
CCc CDd |
Gp0 RT ln Kc |
|
CAa CBb |
|
Gp RT ln Kc RT ln |
Cc |
Cd |
C |
D |
|
|
CAa CBb |
|
Пс
Уравнение изотермы
