
Дополнительно / Teplovue effektu i napravlenie himicheskih processov
.pdf31
39. Расположить перечисленные вещества в порядке увеличения их термической устойчивости, с учетом приведенных значений:
Gо298 ккал/моль |
СаF2 (к) |
СаС2 (к) |
СаО (к) |
СаN2 (к) |
–278 |
–16 |
–144 |
–88 |
|
Как это объяснить? |
|
|
|
|
40. Чем объяснить, что из двух реакций, термодинамически не |
||||
возможных в стандартных условиях: |
Но1 = 19,5 ккал/моль |
|||
N2 (г) + 1/2О2 (г) → N2O(г); |
||||
1/2N2 (г) + 1/2О2 (г) → NO(г); |
Но2 = 21,6 ккал/моль |
|
||
только одна из них становится возможной при высокой температуре?
41.Почему при температурах, мало отличающихся от 0 К, стремление к минимуму энергии может рассматриваться как единственный принцип, определяющий направление химического процесса?
42.В каких термодинамических условиях термодинамически возможны экзотермические реакции; эндотермические реакции?
43.Почему даже наиболее термодинамически стабильные вещества при достаточно высокой температуре разлагаются?
44.Можно ли, изменяя температуру, изменить направление следующих
реакций:
44.1.2NО(г) + О2 (г) → NO2 (г);
44.2.N2О4 (г) → 2NO2 (г);
44.3.2SО2 (г) + О2 (г) → 2SO3 (г);
44.4.PCI5 (г) → PCI3(г) + СI2 (г);
44.5.СО2 (г) + С(графит) → 2СО(г);
Но = –27,02 ккал Но = –13,88 ккал Но = –46,95 ккал
Но = 44 ккал Но = 38,3 ккал?
45. Исходя из знака Gо298 следующих реакций
PbO2 |
(к) + Pb (к) = 2PbO (к), |
Gо298 < 0; |
SnO2 |
(к) + Sn (к) = 2SnO (к), |
Gо298 > 0, |
сделать вывод о том, какие степени окисления более характерны для свинца и олова.
32
46 Учитывая, что NO2 (г) окрашен, N2O4 (г) бесцветен, и исходя из знака изменения энтропии в реакции 2NO2 (г) = N2O4 (г), предсказать, как изменится окраска в системе NO2 (г) – N2O4 (г) с ростом температуры: усилится или ослабнет.
11.ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОПРОВЕРКИ ПО ТЕМЕ:
ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
1. Энергией называется:
а) физическая величина, характеризующая направление теплообмена между системами;
б) экзотермический химический процесс;
в) физическая величина, являющаяся мерой взаимодействия и движения материальных систем;
г) термодинамическое состояние системы.
2. При рассмотрении химической реакции понятие система означает:
а) исходные реагенты;
б) продукты химической реакции;
в) реакционный сосуд;
г) исходные реагенты и продукты реакции.
3.В зависимости от способности химической системы к обмену энергией
ивеществом с окружающей средой различают три типа систем: изолированные, закрытые и открытые. Окружающей средой называют:
а) выделенную (реально или условно) часть материального мира, которая является предметом наблюдения или исследования;
б) атмосферу Земли;
в) всю остальную часть материального мира вне пределов выделенной из него системы;
г) стенки реакционного сосуда.
33
4. Изолированная система с окружающей ее средой:
а) обменивается энергией, но не обменивается веществом;
б) не обменивается ни веществом, ни энергией;
в) обменивается веществом, но не обменивается энергией;
г) обменивается и энергией, и веществом.
5. Химическая реакция обязательно сопровождается выделением или поглощением энергии, поскольку:
а) ее протекание заключается в разрыве одних и образовании других химических связей;
б) ее протекание требует столкновения реагирующих частиц;
в) для ее протекания необходима энергия, равная энергии активации;
г) при ее протекании не затрагиваются ядра атомов;
6. Первый закон (первое начало) термодинамики математически записывается так:
а) pV=vRT;
б) k=R/NA;
в) k = Aexp( –Ea/RT);
г) ΔU=Q–А.
7. Сформулируйте первый закон термодинамики:
а) скорость химической реакции определяется энергией активации данной реакции;
б) физические величины, однозначно определяющие состояние системы, являются функциями состояния системы;
в) сумма изменения внутренней энергии и совершенной системой (или над системой) работы равна сообщенной (или выделенной ею) теплоте;
г) при одинаковых условиях в равных объемах различных газов содержится одинаковое число молекул.
8. В каких единицах выражаются величины, входящие в математическое соотношение первого начала термодинамики?
34
а) в единицах заряда, например в кулонах б) в единицах давления, например в паскалях в) в единицах энергии, например в джоулях г) в единицах времени, например в секундах
9. Тепловой эффект химической реакции при постоянном давлении —
это...
а) количество выделившейся или поглощенной теплоты в результате взаимодействия между собой строго определенных количеств веществ;
б) изменение внутренней энергии в результате химической реакции;
в) изменение энтальпии в результате химической реакции;
г) работа, выполненная в ходе химической реакции.
10. В экзотермической реакции...
а) энтальпия реакционной системы повышается (ΔH > 0);
б) тепловой эффект реакции отрицательный (Qр < 0);
в) энтальпия реакционной системы уменьшается (ΔH < 0);
г) давление реакционной системы повышается.
11. В эндотермической реакции...
а) энтальпия реакционной системы увеличивается (ΔH > 0);
б) тепловой эффект реакции положителен (Qр > 0);
в) энтальпия реакционной системы уменьшается (ΔH < 0);
г) резко замедляется скорость химической реакции.
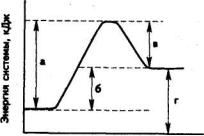
12. Какой из отрезков на диаграмме соответствует тепловому эффекту реакции?
Ход реакции
35
а) а;
б) б;
в) в;
г) г.
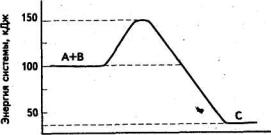
13. Используя для ответа энергетическую диаграмму, находим, что изменение энтальпии реакции А+В→С равно:
а) ΔH = –150 кДж (теплота выделилась)
б) ΔH = 100 кДж (теплота поглотилась)
в) ΔH = –75 кДж (теплота выделилась)
г) ΔH = – 25 кДж (теплота поглотилась)
Ход реакции
14. Тепловой эффект, а также изменение энтальпии химической реакции зависят от температуры, давления и агрегатного состояния вещества. Поэтому при сопоставлении величин Qр и ΔH приняты определенные стандартные условия. За стандартные принимают значения:
а) давления 1 атм и температуры 0°С;
б) давления 101325 Па и температуры 273К;
в) давления 100 Па и температуры 100К;
г) давления 101325 Па и температуры 298К.
15. Стандартные тепловые эффекты принято обозначать
а) ΔUст; б) ΔH◦298;
в) Q273101,3;
г) ΔHст.
36
16. Чему равны стандартные энтальпии образования простых веществ, находящихся в стандартных состояниях?
а) 1 кДж;
б) 298 Дж;
в) нулю;
г) 273 кДж.
17. Стехиометрические коэффициенты в термохимических уравнениях указывают на:
а) соотношение между количествами веществ;
б) реальные количества реагирующих и образующихся веществ;
в) массы веществ;
г) скорость расходования и образования веществ.
18. Единицей измерения энергии в системе СИ является джоуль. Однако до сих пор так же широко используется внесистемная единица — калория (килокалория) люди, далекие от химии, хорошо знакомы, например, с термином «калорийность» продуктов). Как связаны между собой джоуль и калория?
а) 1 кал = hcν Дж;
б) 1 Дж = 6,02 1023 кал;
в) 1 Дж = 22,4 кал;
г) 1 кал = 4,184 Дж.
19.Каждый человек поглощает энергию в виде пищи и напитков. Рассчитайте, какое количество энергий поглощает человек, съедая 100 г белого хлеба (в нем содержится 50 г углеводов, 8 г белков, 2 г жиров и около 40 г воды). Калорийность углеводов, белков и жиров составляет соответственно 3,8; 4,1 и 9,1 ккал/г.
а) 241ккал;
б) 100 кДж;
в) 1008,3 кДж;
г) –13 кал.
37
20. Девушка, строго следящая за фигуру, не удержалась от соблазна сладостей и съела шоколада в два раза больше ее обычной ежедневной нормы (9200 кДж). Чтобы ликвидировать энергетические излишества, в течение ближайших двух часов ей пришлось:
а) стирать белье (540);
б)ездить на велосипеде (920);
в) бегать трусцой по парку (2300);
г) плавать в бассейне (1200).
Вскобках указаны энергетические затраты организма ΔHсгорания в кДж/ч.
21.Важнейшим следствием термохимического закона Гесса является утверждение, что тепловой эффект химической реакции равен:
а) сумме теплот образования исходных веществ;
б) сумме теплот образования продуктов реакции;
в) сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов термохимического уравнения реакции;
г) сумме теплот образования исходных веществ за вычетом суммы теплот образования продуктов реакции.
22. Какая из написанных ниже реакций отвечает теплоте образования оксида азота (II) в стандартных условиях (ΔH◦298)?
а) 1/2N2 + О = NO;
б) N+ 1/2O2 = NO;
в) 1/2N2 + l/2O2 = NO;
г) 2NH3 + 5/2O2 = 2NO + 3H2O.
23. Какие из нижеприведенных реакций являются эндотермическими?
а) 1/2N2 + 3/2H2 = NH3 |
ΔH◦298 = –46 кДж/моль; |
б) H2 + 1/2O2 = H2О, |
ΔH◦298 = –242 кДж/моль; |
в) 1/2N2 + l/2O2 = O2, |
ΔH◦298 = 90 кДж/моль; |
г) 1/2H2 + 1/2I2 = HI, |
ΔH◦298 = 26 кДж/моль; |
38
24. Сколько энергии надо затратить для разложения 9 г жидкой воды на водород и кислород в стандартных условиях?
а) 1 ккал;
б) 286 кДж;
в) Разложение воды происходит без видимых затрат энергии;
г) 143 кДж.
25 Теплоты сгорания графита и алмаза при стандартные условиях составляют 393,5 кДж/моль и 395,4 кДж/моль соответственно. Чему равна энтальпия перехода графита в алмаз?
а) ΔH◦298 = –1,9 кДж/моль; б) ΔH◦298 = 1,9 кДж/моль;
в) Графит невозможно превратить в алмаз;
г) ΔH◦298 = 0.
26. Экспериментально теплоты сгорания (а также энтальпии образования) определяют в специальном приборе, называемом:
а) спектрофотометром;
б) калориметром;
в) аппаратом Кипа;
г) колориметром.
27. При стандартных условиях теплота сгорания водорода в кислороде равна 286,2 кДж/моль, а теплота сгорания водорода в озоне равна
333,9 кДж/моль. Чему равна теплота образования озона из кислорода при стандартных условиях?
а) – 143,1 кДж/моль;
б) + 47,7 кДж/моль;
в) – 47,7 кДж/моль;
г) нулю.
39
28. Энергии диссоциации Н2, С12 и энтальпия образования НС1 составляют соответственно 436, 243 и –92 кДж/моль. Чему равна энергия связи Н–С1?
а) –46 кДж/моль;
б) –486 кДж/моль;
в) +431,5 кДж/моль;
г) +218 кДж/моль.
29. Для полного разложения некоторого количества карбоната магния потребовалось 5,1 кДж теплоты. Полученный оксид углерода (IV) был поглощен 5,7%-ным раствором гидроксида бария массой 75 г. Рассчитайте массовую долю образовавшейся при этом соли. Тепловой эффект реакции разложения карбоната магния составляет 102 кДж/моль.
а) 8,4% Ва(НСО3)2;
б) образовался осадок ВаСО3;
в) 10% (Ва(ОН))2СО3;
г) 10% Ва(НСО3)2.
30. Все вопросы данной главы иллюстрируют утверждение, что любая химическая реакция обязательно сопровождается выделением или поглощением энергии (см. задание 5). Однако изменения энергии могут происходить не только в результате химических, но и в ряде физических превращений. Назовите физическое превращение, в результате которого не происходит изменение энтальпии.
а) растворение соли в воде;
б) плавление льда;
в) сублимация иода;
г) интерференция света.
31. Стандартная молярная энтальпия плавления ΔH◦пл. т — это:
а) изменение энтальпии, которым сопровождается испарение одного моля вещества;
40
б) изменение энтальпии, которым сопровождается плавление одного моля данного вещества при его температуре плавления и давлении одна атмосфера;
в) изменение энтальпии, которым сопровождается плавление одного моля данного вещества при нормальных условиях;
г) теплота, которую необходимо затратить для преодоления сил притяжения, существующих между частицами жидкости.
32. Эмпирическое правило Трутона формулируется так: отношение стандартной молярной энтальпии испарения жидкости (ΔH◦исп. m) при ее температуре кипения к значению этой температуры в шкале Кельвина равно приблизительно 88 Дж/(К-моль). Используя это правило, определите значение ΔH◦исп. m бензола (tкип. = 80,1◦С).
а) 31,1 Дж/моль;
б) 62,2 кДж/моль;
в) 31,1 кДж/моль;
г) 93,3 Дж/моль.
33. Наибольший вклад в развитие термодинамических и термохимических представлений внесли работы следующих ученых:
а) Гесса и Авогадро;
б) Моцарта и Бетховена;
в) Гессе и Гейне;
г) Майера и Гесса.
