
1 модуль / Lekcija_3_4_Ruseckaja_Slozhnie_Belki
.pdf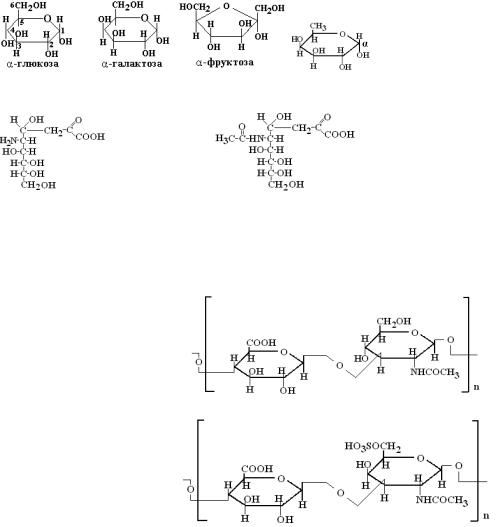
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Лекции № 3, 4 Тема: «Сложные белки»
План.
1.Классификация сложных белков
2.Углеводсодержащие белки (гликопротеины и протеогликаны)
3.Липопротеины
4.Фосфопротеины
5.Металлопротеины
6.Хромопротеины
7.Нуклеопротеины
1. Классификация сложных белков Основывается на химической природе небелкового компонента (простетической группы):
1.Углеводсодержащие белки (гликопротеины и протеогликаны),
2.липопротеины,
3.фосфопротеины,
4.нуклеопротеины,
5.хромопротеины (гемопротеины и флавопротеины),
6.металлопротеины,
2. Углеводсодержащие белки (гликопротеины и протеогликаны)
Простетическая группа гликопротеинов может быть представлена моносахаридами (глюкозой, галактозой, маннозой, фруктозой, 6-дезоксигалактозой), их аминами и ацетилированными производными аминосахаров (ацетилглюкоза, ацетилгалактоза), а также уроновыми, нейраминовыми и сиаловыми кислотами и короткими олигосахаридами.
6-дезоксигалактоза
нейраминовая кислота сиаловая кислота На долю углеводов в молекулах гликопротеинов приходится 1-35%. Исключение составляют муцины, в
молекуле которых на долю углеводов приходится до 70%. Гликопротеины - глобулярные белки. Углеводный компонент протеогликанов может быть представлен несколькими цепями гетерополисахаридов, которые называются глюкозаминогликанами. Примерами являются гиалуроновая, хондроитинсерная кислоты и гепарин.
Гиалуроновая кислота

СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Хондроитинсерная кислота
Гепарин На долю углеводов в молекулах протеогликанов приходится до 95%. Белковый и небелковый компоненты в
углеводсодержащих белках связаны прочными ковалентными О-гликозидными и N-гликозидными связями. О-гликозидная связь образуется за счет полуацетального гидроксила моносахарида и гидроксильной группы аминокислот серина и треонина в белках. N-гликозидная связь образуется за счет полуацетального гидроксила и амидной (-NH2) группы аспарагина, реже глютамина в белке.
Биологические функции гликопротеинов:
Гликопротеины содержат олигосахаридные цепи различной длины, ковалентно присоединенные к полипептидной основе. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков – ферментах, гормонах, транспортных, структурных белках. Они являются компонентами клеточных мембран, располагаясь на их внешней стороне. В молекулах индивидуальных белков углеводная часть молекул занимает также поверхностное положение. Поэтому именно гликопротеины обеспечивают антигенную специфичность групповых веществ крови, рецепторную специфичность мембран, участвуют в межклеточных взаимодействиях, в передаче гормональных сигналов
вклетки тканей, являются защитными антивирусными белками клеток, объединяют коллагеновые волокна
вфибриллы.
Представители гликопротеинов – коллаген и эластин, иммуноглобулины, трансферин плазмы крови, клеточные белки интерфероны, лизосомальные ферменты, белки слюны, фибринонектин соединительной ткани, гормоны тиротропин и др.
Биологические функции протеогликанов:
Протеогликаны содержат до 95-99% гетерополисахаридов и только 2-5% специфических белков. Гетерополисахариды названы гликозаминогликанами (ГАГ). Это высокомолекулярные линейные полимеры, построенные из повторяющихся 100-25000-кратно мономеров. Каждый содержит гексуроновую кислоту (глюкуроновую или идуроновую) и ацетиламиноглюкозу или ацетиламиногалактозу. Компоненты связаны между собой β-гликозидными связями. Белковая и углеводная части также стабилизированы гликозидными связями. В тканях человека присутствуют 6 классов ГАГ. Важнейшие представители – гиалуроновая и хондроитинсерная кислоты и гепарин. Гиалуроновая и хондроитинсерная кислоты являются основой межклеточного вещества соединительной ткани. Это высокогидратированные, эластичные, анионные молекулы, занимающие большой обмен в межклеточном пространстве, обеспечивающие тургор и барьерные свойства ткани.
Гепарин, в отличие от них - естественный антикоагулянт.
3. Липопротеины Липопротеины - сложные белки, состоящие из белковой части и простетической группы, представленной
каким-либо липидом. Липиды – неполярные (гидрофобные) вещества, которые нерастворимы в воде. В организме человека присутствуют 2 группы липопротеиновых комплексов:
1.Структурные липопротеины мембран.
2.Липопротеины плазмы крови, выполняющие транспортную функцию.
Характеристика липидов мембран.
Основой биомембран является двойной слой фосфолипидов со встроенными в него молекулами белков и холестерина. Главными компонентами фосфолипидов служат разнообразные жирные кислоты (заменимые и незаменимые).
|
Жирные кислоты, которые встречаются в природных липидах |
||
|
Насыщенные жирные кислоты: |
мононенасыщенные жирные кислоты с 1 двойной связью: |
|
1. |
лауриновая (С12), |
|
1. Пальмитолеиновая (С16) (9-10) |
2. |
миристиновая (С14), |
2. Олеиновая (С18) (9-10) |
|
3. |
пальмитиновая (С16), |
|
|
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
4.стеариновая (С18),
5.лигноцериновая (С24). Полиненасыщенные жирные кислоты:
1.С18:2 – линолевая (9-10,12-13),
2.С18:3 - линоленовая (9-10, 12-13, 15-16),
3.С20:4 - арахидоновая (5-6, 8-9, 12-13, 15-16).
Полиненасыщенные жирные кислоты являются незаменимыми, т.к. не синтезируются в организме человека и поэтому должны поступать с пищей. Помимо этого арахидоновая кислота может освобождаться в тканях при гидролизе мембранных фосфолипидов. Из нее у человека синтезируются тканевые гормоны – эйкозаноиды – простагландины, тромбоксаны и лейкотриены).
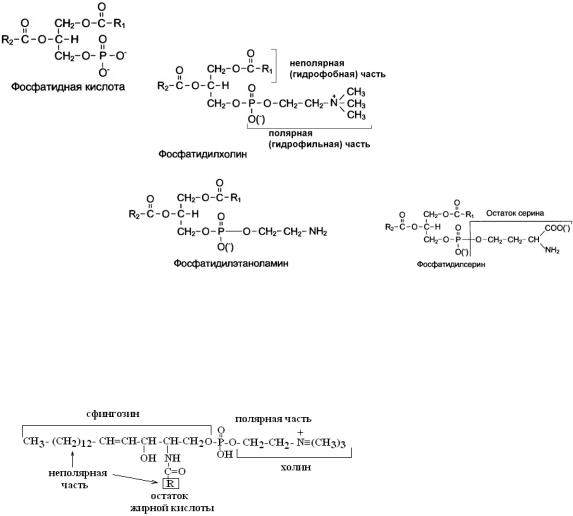
Фосфолипиды, содержащие спирт глицерин, называются глицерофосфолипиды. Фосфолипиды, содержащие сфингозин, называются сфинголипиды.
Глицерофосфолипиды являются производными фосфатидной кислоты. Она лежит в основе фосфатидилсерина, фосфатидилэтаноламина, фосфатидилхолина:
Глицерофосфолипиды – амфифильные молекулы, содержащие неполярные алифатические «хвосты» жирных кислот и полярную заряженную часть. Остатки жирных кислот формируют неполярныю (гидрофобную) часть молекулы, а остаток фосфорной кислоты и аминоспирт – полярную (гидрофильную) часть. Глицерофосфолипиды являются преобладающим компонентом большинства биологических мембран.
Сфинголипиды содержат церамид (продукт взаимодействия сфингозина с жирной кислотой). Молекулы сфинголипидов тоже являются амфифильными:
Сфингомиелин Сфинголипиды – основные компоненты миелиновых оболочек и клеточных мембран мозга и нервной ткани.
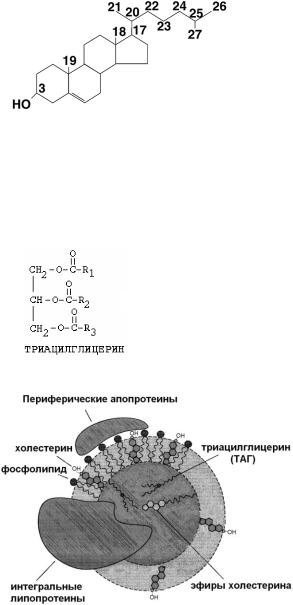
Холестерин является высокогидрофобным липидом (однако, гидроксильная группа является полярной частью молекулы). Источником холестерина является пища, а также постоянное обновление клеточных мембран. Холестерин входит в состав биомембран, а также является предшественником стероидных гормонов (коры надпочечников и половых), желчных кислот, провитамина Д3.
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Мембранные белки удерживаются в двойном слое фосфолипидов с помощью гидрофобных и ионных связей. Некоторые белки располагаются в поверхностных слоях мембраны.
Характеристика липопротеинов плазмы.
Важнейшие комплексы белков и липидов, стабилизированных нековалентными взаимодействиями, представляют собой липопротеины плазмы. Их основная функция – транспорт различных липидов (жиров, фосфолипидов, холестерина и его эфиров, жирорасторимых витаминов).
Источниками этих липидов для человека является пища, а также процесс синтеза всех групп липидов в печени.
Все липиды нерастворимы в плазме. Поэтому они могут переносится от кишечника к печени и от печени только в составе липопротеиновых комплексов.
Эти глобулярные, сфероидные частички содержат неполярное ядро гидрофобных триацилглицеринов (ТАГ) (или жиров) и эфиров холестерина, окруженное амфифильной оболочкой фосфолипидов, свободного холестерина и специфических
белков (см. рисунок).
Различают 4 класса липопротеинов (ЛП) на основе их функциональных и физических свойств, таких как плотность частиц и их электрофоретическая подвижность.
1.Плотность липопротеиновых частиц зависит от соотношения липидов и белков. Ее определяют методом ультрацентрифугирования в растворе NaCl.
2.Во время электрофореза ЛП плазмы мигрируют вместе с α- и β-глобулинами плазмы. Таким образом, плотность частиц соответствует их электрофоретическому поведению. Скорость движения частиц зависит от их заряда и размера, а заряд – от количества белков на поверхности частиц.
Белковую часть липопротеиновых частиц называют апопротеинами. Они играют важную роль в
функционировании липопротеинов. Апопротеины взаимодействуют с клеточными рецепторами и регулируют активность некоторых клеточных и плазменных ферментов. Часть апопротеинов является интегральными, структурными белками липопротеиновых частиц и прочно связаны с ними. Другие располагаются на поверхности и могут обмениваться этими белками во время своего функционирования. Апопротеины отличаются совей первичной структурой друг от друга и обозначаются A, B, C, D, E.
Функции липопротеинов плазмы
1.Хиломикроны (ХМ) транспортируют экзогенные пищевые ТАГ и ХЛ от кишечника к тканям.
2.Липопротеины очень низкой плотности (ЛПОНП) переносят эндогенные, синтезированные в печени ТАГ, от печени к тканям, выносят ХЛ в кровоток.
3.Липопротеины низкой плотности (ЛПНП) образуются в плазме из ЛПОНП, являются транспортной формой экзогенного ХЛ от печени к тканям.
4.Липопротеины высокой плотности (ЛПВП) обеспечивают обратный транспорт ХЛ от тканей к печени.
4. Фосфопротеины Фосфопротеины в качестве простетической группы содержат остаток фосфорной кислоты. Примеры:
казеин и казеиноген молока, творога, молочных продуктов, вителлин яичного желтка, овальбумин яичного белка, ихтуллин икры рыб. Фосфопротеинами богаты клетки ЦНС. Фосфопротеины обладают многообразными функциями:

СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
1.Питательная функция. Фосфопротеины молочных продуктов легко перевариваются, усваиваются и являются источником незаменимых аминокислот и фосфорной кислоты для синтеза белков тканей
ребенка.
2.Фосфорная кислота участвует в регуляцию активности ферментов путем фосфорилирования при участии ферментов протеинкиназ. Фосфат присоединяется к – ОН группе серина, треонина сложноэфирными связями (или к –NH2 группе лизина фосфоамидными связями):
5. Металлопротеины Металлопротеины - белки, содержащие в качестве небелкового компонента ион металла. Например:
1.белки крови, содержащие железо: ферритин и трансферрин (транспорт железа) и содержащие медь: церулоплазмин.
2.ферменты: а) алкогольдегидрогеназа содержит цинк, б) карбоангидраза, карбоксипептидаза, цитохромоксидаза, церулоплазмин содержат ионы меди, в) аргиназа содержит ионы марганца, супероксиддисмутаза содержит ионы молибдена, меди, гексокиназа содержит ионы железа.
6. Хромопротеины Хромопротеины - сложные белки с окрашенной небелковой частью. К ним относятся флавопротеины (желтые) и гемопротеины (красные).
Флавопротеины в качестве простетической группы содержат производные витамина В2 – флавины: Флавинадениндинуклеотид (ФАД) или Флавинмононуклеотид (ФМН). Они являются небелковой частью ферментов дегидрогеназ и оксидаз, катализирующих окислительно-восстановительные реакции. Гемопротеины в качестве небелковой группы содержат гем – железопорфириновый комплекс.
Гемопротеины подразделяют на два класса:
1.ферменты: каталаза, пероксидаза, цитохромы.
2.неферменты: гемоглобин и миоглобин.
1. Ферменты каталаза и пероксидаза разрушают токсичную перекись водорода, цитохромы являются переносчиками электронов в цепи переноса электронов.
2. Неферменты. Гемоглобин транспортирует кислород (от легким к тканям) и углекислый газ (от тканей к легким); миоглобин – депо кислорода в работающей мышце.
Строение гемоглобина. Гемоглобин – тетрамер, т.к. состоит из 4-х
субъединиц: глобин в этом тетрамере представлен 4-мя полипептидными цепями 2-х разновидностей: 2 α и 2 β цепи. Каждая субъединица связана с гемом.
Внутри каждой субъединицы есть гидрофобный карман, в котором расположен гем. Гем удерживается в нем гидрофобными, координационными, ионным связями, а также силами Ван дар Ваальса.
Производные гемоглобина образуются при его взаимодействии с лигандами (О2, СО2, 2,3- дифосфоглицерат, СО и др.). Гемоглобин, связанный с кислородом, называется оксигемоглобином. Карбгемоглобин – гемоглобин, связанный с углекислым газом СО2. Очень велико сродство гемоглобина к угарному газу СО (в 300 раз выше, чем к кислороду). При связывании с СО гемоглобин превращается в карбоксигемоглобин, который не способен связывать кислород. При действии окислителей, например, нитрита натрия образуется метгемоглобин, в нем железо становится 3-х-валентно. В связи с этим гемоглобин теряет возможность присоединять кислород и может присоединять циано-группу, с образованием циано-мет-гемоглобина. Поэтому при отравлении цианидами назначают в качестве лечения метгемоглобин-образователи. 2,3-дифосфоглицерат – метаболит гликолиза – способствует отдаче гемоглобином кислорода в ткани. Особенно высока концентрация этого лиганда в эритроцитах.
Типы гемоглобина Различают физиологические и аномальные типы гемоглобина.
Физиологические типы гемоглобина оразуются в разные периоды онтогенеза:

СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
1.HbP – примитивный гемоглобин формируется у эмбриона.
2.HbF – фетальный гемоглобин – гемоглобин плода. Замена HbP на HbF происходит к третьему месяцу эбрионального развития. В крови новорожденного содержится около 70% HbF.
3.К 4-х месяцам жизни ребенка HbF заменяется на 95% HbА – гемоглобин взрослого человека.
Физиологические типы гемоглобина различаются характером полипептидных цепей и сродством к кислороду. Самое большое сродство к кислороду у HbF, среди взрослых гемоглобинов – у HbА2. Аномальные (мутантные) типы гемоглобина отличаются друг от друга аминокислотным составом полипептидных цепей, а, следовательно, и первичной структурой ППЦ. Например, при серповидноклеточной анемии в крови появляется аномальный НbS. В β- цепи глобина в 6-ом положении полярная АК глу заменяется на гидрофобную АК вал, как следствие образуется гидрофобный участок, что приводит к деформации эритроцита (он приобретает форму серпа) и снижению сродства к кислороду. В результате развивается анемия, гипоксия.
7. Нуклеопротеины Нуклеопротеины - сложные белки, в состав которых входят белки (гистоны), небелковая часть представлена нуклеиновыми кислотами: ДНК и РНК.
Гистоны – белки с резко выраженными основными свойствами, т.к. они содержат более 30% арг и лиз. Эти АК сообщают белку положительный заряд, а нуклеиновая кислота всегда за счет свободных фосфатных остатков в каждом нуклеотиде имеет отрицательный заряд. Поэтому при формировании нуклеопротеинов участвуют силы электростатического притяжения.
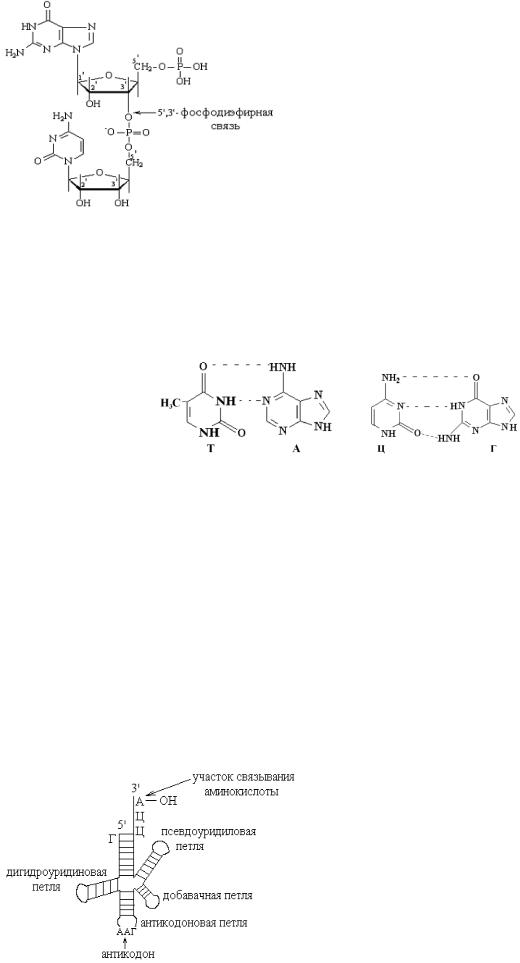
Строение нуклеиновых кислот Нуклеиновые кислоты - это длинные полимерные цепи, состоящие из многих тысяч мономерных единиц,
которые соединяются между собой 3`,5`- фосфодиэфирными связями. Мономером НК является мононуклеотид, который состоит из азотистого основания, пентозы и остатка фосфорной кислоты. Азотистые основания бывают пуриновые (А и Г) и пиримидиновые (Ц, У, Т).
В качестве пентозы выступает β– Д- рибоза или β –Д- дезоксирибоза:
Азотистое основание соединено с пентозой N-гликозидной связью. Пентоза и фосфат связаны друг с другом сложноэфирной связью между –ОН группой, расположенной у С5’-атома пентозы, и фосфатом.
Виды нуклеиновых кислот ДНК и РНК отличаются по структуре и функциям:
1.Нуклеотиды ДНК содержат А, Г, Т и Ц, дезоксирибозу и фосфорную кислоту. ДНК находится в ядре клетки и составляет основу сложного белка хроматина.
2.Нуклеотиды РНК содержат А, Г, У и Ц, рибозу и фосфорную кислоту. Различают 3 вида РНК: а) м- РНК (информационная или матричная) – копия гена ДНК, содержит информацию о первичной структуре белка; б) р-РНК образует скелет рибосомы в цитоплазме. Рибосома – рибонуклеопротеидный комплекс, состоящий из двух субъединиц (большой и малой) и участвующий в синтезе белка на рибосоме в процессе трансляции; в) т-РНК участвует в активации и транспорте АК к рибосоме, локализована в цитоплазме.
Строение и уровни организации НК НК имеют первичную, вторичную и третичную структуры.
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
|
Первичная структура НК одинакова для всех видов – |
|
последовательность нуклеотидов в полинуклеотидной цепи, в |
|
которой мононуклеотиды связаны 3’, 5’-фосфодиэфирными |
|
связями. Каждая полинуклеотидная цепь имеет 3’ и 5’-концы. |
Вторичная структура ДНК представляет собой двойную спираль. В 1949 году англ. биохимик Чаргафф выяснил, что сумма пуриновых нуклеотидов = сумме пиримидиновых нуклеотидов, содержание А = содержанию Т, содержание Г =
содержанию Ц. Это открытие лежало в основе работы Уотсона и Крика. ДНК состоит из 2-х цепей, закрученных в спираль вправо вокруг оси. Виток спирали = 10 нуклеотидов, что составляет в длину 3,4 нм. Обе цепи в спирали антипараллельны. Одна цепь имеет направление 3’ к 5’, а другая - 5’ к 3’. Гидрофильные участки ДНК состоят из дезоксирибоз и остатков фосфата и находятся на внешней поверхности двойной спирали. Гидрофобные участки (азотистые основания обеих цепей) находятся внутри спирали, перпендикулярны ее оси и уложены стопкой, которую стабилизируют гидрофобные силы. Спираль поддерживают водородные связи между комплементарными парами азотистых оснований: А=Т; Г≡Ц.
Гидрофобные силы и водородные связи стабилизируют вторичную структуру ДНК.
Третичная структура ДНК. Это результат дополнительного скручивания в пространстве молекулы ДНК. Это происходит при взаимодействии ДНК с белком. При взаимодействии с октамером гистонов (щелочные белки с высоким содержанием аминокислот арг и лиз) двойная спираль (около 140 пар оснований) накручивается на октамер, укорачивается и превращается в нуклеосому. Эти нуклеосомы связаны между собой короткими участками линкерной ДНК, что способствует образованию компактной структуры. Далее нуклеосомные нити формируют суперспирали и петлеобразные структуры. В результате образуется сильно конденсированный хроматин клеточного ядра. Таким образом, функция гистонов состоит в упаковке ДНК в структурные единицы – нуклеосомы. При подготовке клетки к делению хроматин собирается в хромосомы. В хроматине содержится ряд негистоновых белков. Одни участвуют в образовании длинных петель ДНК, другие являются регуляторными ДНК-связывающими белками, третьи – ферменты репликации, транскрипции и репарации.
Функция ДНК – хранение и передача наследственной информации. Эта информация хранится в форме последовательности ее нуклеотидов, соответствующую последовательности аминокислот в ппц.
Вторичная структура РНК – полинуклеотидная нить, изогнутая в пространстве. Эта изогнутость обусловлена образованием водородных связей между сближенными комплементарными азотистыми основаниями. У т-РНК вторичная структура представлена «клеверным листом», в котором различаю комплементарные и некомплементарные участки. К ним в частности относятся антикодоновая петля и акцепторный стебель. Антикодоновая петля имеет триплет нуклеотидов, которые спариваются водородными связями по принципу комплементарности с кодоном м-РНК.
Другие петли взаимодействуют с рибосомой и с ферментами. К акцепторному стеблю присоединяется АК. Антикодон – комплементарен кодону м-РНК, в нем закодирована аминокислота, соответствующая данной т- РНК. Каждой из 20 аминокислот соответствует 1 (или несколько) т-РНК, которая связывает аминокислоту, переносит на рибосомы и служит адаптором при переводе
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
закодированного в м-РНК генетического текста в аминокислотную последовательность белка.
м-РНК является копией гена ДНК, в котором закодирована первичная тсруктура полипептида в форме последовательности нуклеотидов. Каждая из 20 аминокислот зашифрована в млекуле м-РНК в форме триплете (кодона) – последовательности из трех нуклеотидов.
р-РНК – основной компонент рибосом. Первичная структура р-РНК – последовательность рибонуклеотидов. Вторичная структура р-РНК –имеет спирализованные участки одиночной изогнутой РНК, а третичная – комплекс с белками рибосомы, котторые резко положительно заряжены, а РНК - отрицательно. м-РНК синтезируется в ядре на матрице ДНК, поступает в рибосому, где служит матрицей для синтеза белка. Поступая из ядра в ЦЗ, м-РНК образует со специфическими белками – информоферами комплексы (третичная структура м-РНК), которые называются информосомами.
У человка существует 4 типа р-РНК, отличающихся размером и формой молекул: 5S, 5,8S, 28S и 18S (S – коэффициент седиментации). В малой субчастице рибосомы находятся 18S р-РНК и 33 белка, а в большой - 5S, 5,8S, 28S р-РНК и 50 белков.
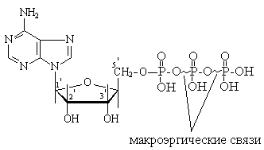
Свободные нуклеотиды.
Свободные нуклеотиды присутствуют в клетке в свободном виде и выполняют самостоятельные функции. Например, Аденозинтрифосфат (АТФ) – универсальный источник энергии в клетке. Нуклеозидтрифосфаты служат источниками нуклеотидов в процессе репликации ДНК и при синтезе РНК.
