
1 модуль / Matrix_biosynthesis
.pdfСГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
Лекция №2.
Тема: «Матричные биосинтезы: репликация, транскрипция, трансляция»
План.
1.Характеристика матричных синтезов.
2.Репликация – самоудвоение ДНК. Репарация ДНК.
3.Транскрипция. Посттранскрипционный процессинг.
4.Трансляция. Посттрансляционные модификации полипептидной цепи.
5.Регуляция экспрессии генов у эукариот
1. Характеристика матричных синтезов. Делению клетки предшествует процесс самоудвоения ДНК (репликация), необходимый для передачи генетической информации в дочерние клетки. Генетическая информация, закодированная в последовательности дезоксинуклеотидов ДНК, реализуется через «считывание», или транскрипцию генов, в форме полинуклеотидных последовательностей мРНК и «перевод» (трансляцию) информации, заключенной в мРНК, на «язык» аминокислот. Таким образом происходит передача информации от ДНК через РНК на белок, характерная для подавляющего большинства живых организмов (за исключением некоторых РНК-вирусов).
Все матричные синтезы проходят в три основных стадии: инициацию (начало), элонгацию (удлинение) и терминацию (окончание).
2. Репликация – самоудвоение ДНК. Репарация ДНК. Репликация – процесс самоудвоения ДНК в составе хромосом в процессе S-фазы клеточного цикла. Репликация – это полуконсервативный процесс, т.к. вновь образованная двойная спираль ДНК содержит одну материнскую и одну дочернюю цепи, которые связаны друг с другом водородными связями между комплементарными азотистыми основаниями. Репликация проходит в 3 стадии: инициацию, элонгацию и терминацию.
1. Инициация репликации – образование репликативной вилки. В определенном участке (сайте) ДНК цепи ДНК расходятся и образуются 2 репликативные вилки, движущиеся в противоположных направлениях. У эукариот в хромосомах репликацию осуществляют несколько репликативных вилок. В инициации репликации участвуют различные белки и ферменты:
1.Топоизомераза – препятствует суперспирализации двойной спирали ДНК впереди репликативной вилки;
2.ДНК-хеликаза (helix - спираль) – расплетает двойную спираль ДНК с использованием энергии АТФ (разрывает водородные связи между комплементарными азотистыми основаниями);
3.ДНК-связывающие белки – взаимодействуют с каждой расплетенной цепью ДНК, препятствуя образованию двойной спирали.
2.Элонгация репликации – синтез полидезоксирибонуклеотидной цепи на матрице ДНК. Субстратами для синтеза являются дезоксирибонуклеотиды: дАТФ, дГТФ, дЦТФ и дТТФ. Синтез новой (дочерней) цепи ДНК возможен только в направлении 5` → 3`, т.е. очередной нуклеотид присоединяется к 3`-ОН группе предыдущего нуклеотида.
Цепи ДНК антипараллельны и поэтому синтезируемые цепи всегда антипараллельны материнским (матричным) цепям (схема 1).
В синтезе ДНК эукариот принимают участие 5 ДНК-полимераз (α, β, γ, δ и ε).
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
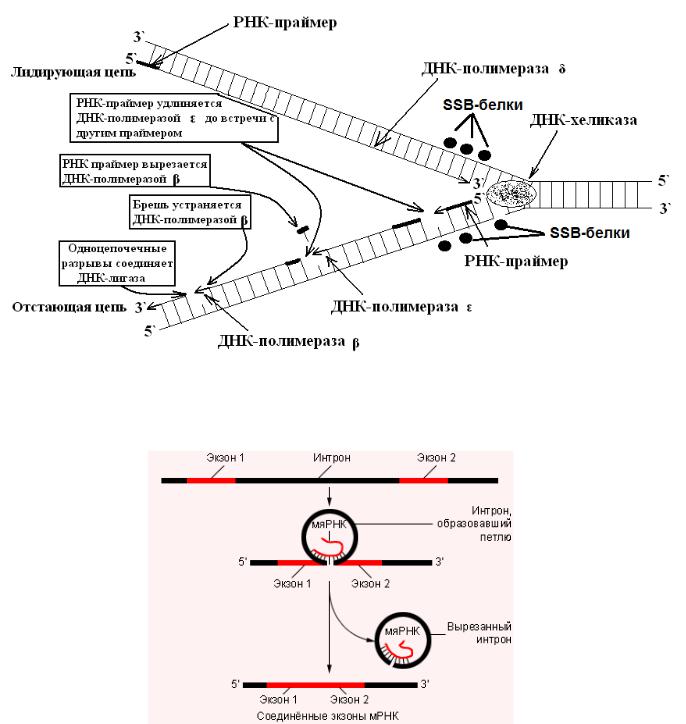
ДНК-полимераза α, которая начинает репликацию, синтезирует небольшой РНКнуклеотид (праймер длиной 8-10 нуклеотидов). На основе этого праймера эта ДНК-полимераза α синтезирует фрагмент цепи ДНК, состоящий примерной из 60 нуклеотидов. Дальнейший синтез доцерней цепи ДНК осуществляет ДНК-полимераза δ. Дезоксирибонуклеотиды всегда присоединяются к 3`-ОН группе предыдущего нуклеотида с образованием 3`-5`- фосфодиэфирной связи. Для образования связи требуется энергия гидролиза макроэргической связи (дАТФ →дАМФ+Н4Р2О7).
Однако только одна дочерняя цепь синтезируется непрерывно в направлении движения репликативной вилки – лидирующая цепь.
Синтез другой цепи всегда идет в направлении от репликативной вилки (отстающая цепь). Синтез отстающей цепи начинается у репликативной вилки. ДНК-полимераза α синтезирует РНК-праймер и ДНК-нуклеотид. Затем ДНК-полимераза ε удиняет дочернюю цепь ДНК до встречи с предыдущим праймером. ДНК-полимераза β постепенно вырезает нуклеотиды праймера, а на их место присоединяет соответствующие дезоксирибонуклеотиды по принципу комплементарности. Два фрагмента Оказаки сшиваются ферментом ДНК-лигазой (с затратой энергии АТФ). В 1969 г. Оказаки доказал, что синтез ДНК на одной из нитей происходит не непрерывно, а в виде фрагментов ДНК (фрагменты Оказаки). Они начинают синтезироваться от репликативной вилки (т.е. в обратном направлении).
3. Терминация репликации. Репликация продолжается до встречи со следующей репликативной вилкой. Расстояние между первой репликативной вилки до следующей называется репликоном.
По окончании репликации небольшая часть (1-8%) нуклеотидных остатков в составе ДНК подвергаются метилированию (с участием S-аденозин-метионина) как правило по N7 аденина или гуанина. Метилирование необходимо для формирования структуры хромосомы, а также для регуляции транскрипции.
Вероятность ошибок при репликации 10-9-10-10 . Однако, если происходят такие ошибки, то синтезируемая ДНК подвергается репарации. Репарация ДНК – процесс восстановления повреждений, возникших в ДНК. В ходе репарации выявляется некомплементарный нуклеотид, вырезается, а на его место присоединяется соответствующий комплементарный нуклеотид.
При нарушении репарации развиваются мутации ДНК, приводящие к развитию патологий (например, пигментная ксеродерма, трихотиодистрофия).
3. Транскрипция. Посттранскрипционный процессинг. Транскрипция – первая стадия реализации генетической информации в клетке. Транскрипция – это синтез РНК на матрице ДНК. Синтез РНК начинается в определенных участках (сайтах) – промоторах, а заканчивается в сайтах терминации. Участок ДНК от промотора до сайта терминации называется транскриптон. У эукариот 1 транскриптон = 1 ген.
Цепь ДНК, которая транскрибируется называется матричной, а вторая, комплементарная ей цепь – кодирующей.
В транскрипции участвуют белки - транскрипционные факторы и ферменты РНК-полимеразы I, II, III. РНК-полимераза I синтезирует рРНК; РНК-полимераза II – мРНК; РНК-полимераза III – тРНК.
1.Инициация транскрипции. Промотор содержит большую последовательность ТАТА (ТАТА-бокс), к которой присоединяется специальный белок ТАТА-фактор. Этот фактор
облегчает связывание РНК-полимеразы с промотором. Факторы инициации
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
транскрипции и РНК-полимераза раскручивают 1 виток спирали ДНК с образованием транскрипционной вилки. РНК-полимераза считывает только одну цепь ДНК и только в направлении 5` → 3`.
2.Элонгация транскрипции. Факторы элонгации увеличивают активность РНКполимеразы и облегчают расхождение цепей ДНК (примерно 18 пар нуклеотидов). Считывание продолжается в направлении 5` → 3`.
3.Терминация транскрипции. Факторы терминации связываются с расплетенным сайтом терминации и способствуют отщеплению РНК-полимеразы и первичного транскрипта от матрицы ДНК.
Посттранскрипционных процессинг. Модификация м-РНК начинается еще на стадии элонгации.
1.Образование кэпа. Сначала к 5`-концу мРНК с помощью 5`-5`-фосфодиэфирной связи присоединяется ГТФ и затем происходит метилирование по N7 гуанина. Эта структура называется кэп (“cap”). Функции кэпа: а) участвует в инициации трансляции; б) защищает мРНК от разрушения нуклеазами; в) активирует сплайсосому.
2.Присоединение полиА-хвоста (около 100-200 АМФ) к 3`-концу мРНК.
3.Сплайсинг (у эукариот) – удаление бессмысленных последовательностей (интронов) и сшивание смысловых последовательностей (экзонов) (схема 2). Альтернативный сплайсинг – образование различных мРНК в разных тканях на основе одного первичного транскрипта.
Процессинг т-РНК заключается в отщеплении нуклеотидов от 3`-конца до тех пор пока РНК-аза не достигнет последовательности ЦЦА – одинаковая последовательность на 3`-конц всех тРНК. Затем происходит сплайсинг и формируется антикодон (связывается по принципу комплементарности с кодоном на мРНК).
Процессинг рРНК. В результате транскрипции образуется нуклеотид длиной примерно 13000 нуклеотидов (45S). После процессинга образуются рРНК 28S, 18S, 4,8S, которые участвуют в построении рибосомы.
4. Трансляция. Посттрансляционные модификации полипептидной цепи.
Трансляция – перевод последовательности рибонуклеотидов РНК в последовательность аминокислот белка - или синтез белка. Местом синтеза белка являются рибосомы. Кодирующими элементами РНК являются кодоны или трплеты (64), из которых 61 кодируют АК, и 3 кодона являются – стоп-кодона трансляции. У человека только 2 АК кодируются одним окдоном – мет и три, тогда как лей, сер и арг – 6-ю кодонами, ала, вал, про, тре – 4-мя кодонами. Избыточность кодонов – ценнейшее свойство генетического кода, т.к. она снижает вероятность развития патологии при ошибке «считывания» в процессе транскрипции. Кодоны «читаются» в одном направлении и не перекрываются. Трансляция начинается с Кодонаинициатора - АУГ и заканчивается кодоном-терминатором (УАА, УАГ или УГА).
Особенности генетического кода.
1.генетический код состоит из 3-х последовательных нуклеотидов.
2.генетический код не перекрывается.
3.генетический код универсален для всех живых организмов.
4.генетический код является «вырожденным», т.к. ряд АК шифруются не одним кодом, а несколькими. Три и мет – имеют по 1-му коду (УГГ и АУГ соответственно). Поэтому АК
– 20, а кодонов – 61.
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
Трансляция происходит в 5 этапов: активация АК (происходит в цитозоле), инициация, элонгация, терминация (происходят на рибосоме) и процессинг (происходит в цитозоле).
1. Активация АК - образование аминоацил-тРНК. Каждая из 20-ти АК ковалентно присоединяется к определенной тРНК. Каждой АК соответствует хотя бы одна т-РНК.
Для активации АК необходимо: набор АК, тРНК, аминоацил-тРНК-синтазы для каждой АК, АТФ, Mg2+.
2. Инициация тансляции. Для инициации трансляции необходимо: метионил-тРНК (формилметионил-тРНК для прокариот), мРНК, рибосома, ГТФ, ионы Mg2+, K+, белковые факторы инициации (IF). Эукариотические рибосомы имеют константу седиментации 80S и состоят из 40S (малой) и 60S (большой) субъединиц. Каждая субъединица включает рРНК и белки. В рибосоме есть 2 центра для присоединения молекул т-РНК: аминоацильный (А) и пептидильный (П) центры, в образовании которых принимают участие обе субъединицы. Вместе А и П центры включают участок м-РНК, равный двум кодонам. В ходе трансляции А- центр связывает аминоацил-т-РНК, строение которой определяет кодон, находящийся в области этого центра. В структуре этого кодона зашифрована природа аминокислоты, которая будет включена в растущую полипептидную цепь. Центр П занимает пептидил-т-РНК, т.е. РНК, связанная с пептидной цепочкой, которая уже синтезирована.
Образование инициирующего комплекса: Малая субъединица рибосомы связывается с IF3, который препятствует объединению большой и малой субъединиц рибосомы. Мет-т-РНК связывается с малой субъединицей. 5`-cap (кэп) м-РНК также связывается с малой субчастицей и первый кодон АУГ спаривается с антикодоном мет-т-РНК. Метионин (мет) инициирует синтез белков у человека. Мет-т-РНК загружается в П-центр малой субъединицы. А-центр пока пустой (схема 4.1). Далее загруженная малая субчастица закрывается большой субъединицей с образованием инициирующего комплекса. Для образования инициирующего комплекса требуются затраты энергии. Источником энергии в ходе инициации трансляции служат: а) гидролиз АТФ, необходимый для соединения П-участка малой субъединицы с АУГ и б) комплекс ГТФ с IF2, необходимый для загрузки П-центра мет-т-РНК. ГТФ гидролизуется до ГДФ и Фн с выделением энергии. В результате белковые факторы инициации освобождаются из инициирующего комплекса.
3. В элонгации трансляции участвуют: инициирующий комплекс, аминоацил-тРНК, соответствующая следующему кодону мРНК, факторы элонгации (EF-1,2,3), ГТФ и ферменты пептидилтранфераза и пептидилтранслоказа.
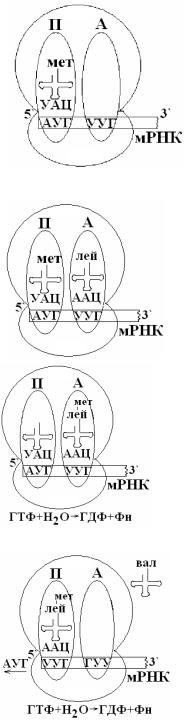
Включение каждой аминокислоты в белок происходит в три этапа.
1.Сначала аминоацил-тРНК (лей-тРНК) связывается с EF-1 и ГТФ. Этот комплекс поступает в А-участок рибосомы. ГТФ гидролизуется с выделением энергии и затем ГДФ, Фн и EF-1 покидают рибосому. Аминоацил-т-РНК связывается с А-участком рибосомы (схема 4.2).
2.Под действием пептидилтрансферазы мет переносится из П-участка в А-участок, где образуется пептидная связь между мет и лей-тРНК за счет использования энергии гидролиза ГТФ. Пептидилтрансфераза – это р-РНК большой субъединицы рибосомы (схема 4.3).
3.3-й этап элонгации - транслокация (перемещение рибосомы в направлении 5`→3`) происходит под действием пептидилтранслоказы и EF-2 (схема 4.4). Для этого процесса необходима энергия гидролиза ГТФ. Свободная тРНК отделяется от П-участка и покидает рибосому. Теперь в П-участке рибосомы находится дипептидил-тРНК (мет-лей-тРНК), а в А- участке находится следующий кодон. Рибосома готова к новому циклу трансляции.
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
4. Терминация трансляции происходит, когда в А-участок рибосомы попадает один из кодонов-терминаторов мРНК. Кодоны-терминаторы – УАА, УГА, УАГ.
Кодоны-терминаторы не кодируют аминокислоты. При попадании кодона-терминатора в А-участок рибосомы начинают действовать факторы терминации (RF). Они вызывают: 1) гидролитическое отщепление полипептида от конечной т-РНК и его освобождение, 2) отделение от П-участка свободной т-РНК, 3) диссоциацию субъединиц рибосомы, которые готовы к синтезу новой полипептидной цепи.
Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК в рибосому строго детерминирована мРНК, т.е. порядок расположения кодонов мРНК задает структуру синтезируемого белка.
Процесс трансляции очень энергозатратный. Для активации присоединения одной аминокислоты к синтезируемой полипептидной цепи требуется энергия гидролиза 4-х молекул макроэргов: 1 АТФ и 3 ГТФ.
Если из тканей, активно синтезирующих белок, например, из ткани поджелудочной железы, выделить рибосомы, то будет видно, что они собраны в группы, состоящие из множества рибосом (до 80). Такие образования называют полисомы. На одной м-РНК сразу несколько рибосом синтезируют несколько ППЦ.
5. Процессинг (посттрансляционные модификации ППЦ) включает себя:
1.формирование уникальной третичной и четвертичной структур белка.
2.частичный протеолиз – активации белка после удаления пептида-ингибитора под действием специфических эндо- и/или экзопротеаз (например, активация протеолитических ферментов пепсина, трипсина, формирование активных гормонов инсулина и глюкагона).
3.ковалентные модификации:
a.фосфорилирование белков по гидроксильным группам серина и треонина (характерно для ферментов),
b.гликозилирование - присоединение углеводных цепей по гидроксильным группам серина и треонина (О-гликозидная связь) или амидной группе аспарагина (N-гликозидная связь) при синтезе гликопротеинов,
c.добавление простетических групп (гем, флавины, активные формы витаминов - коферменты и др.).
5. Регуляция экспрессии генов у эукариот может быть результатом изменений в генах или действия механизмов, влияющих на скорость транскрипции, процессинга и транспорта м- РНК, скорость трансляции м-РНК или ее стабильность.
-Гены могут быть утрачены, амплифицированы и рекомбинированы.
-Модификации N-оснований ДНК влияют на транскрипционную активность генов, например, метилирование цитозина снижает скорость транскрипции гена глобина в неэритроидных тканях.
Регуляция на уровне транскрипции:
1.гистоны являются неспецифическими репрессорами транскрипции генов. На разных этапах клеточного цикла происходит изменение степени конденсации хроматина.
2.активация специфических генов индукторами, например, стероидными гормонами либо регуляторными белками, которые связываются с особыми регуляторными последовательностями ДНК.
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
3.Некоторые гены имеют несколько промоторов, которые разные типы клеток могут использовать в разных физиологических условиях.
Регуляция во время процессинга транскрипта м-РНК
1.Альтернативные кэпирование, полиаденилирование и сплайсинг могут изменить последовательность аминокислот или количество белков, синтезированных на матрице м-РНК. Иногда замена азотистых оснований либо удаление/добавление нуклеотидов может происходить по завершении синтеза транскрипта м-РНК. В результате в разных тканях образуются разные белки.
2.м-РНК могут разрушаться клеточными нуклеазами до начала их трансляции в ЦЗ. Белки, которые транспортируют м-РНК из ядра препятствуют их быстрой деградации. Стабильность м-РНК (т.е. время их полужизни) регулируют также поли-А-хвосты на 5`-конце молекул и шпилечные структуры на 3`-конце м-РНК.
Регуляция на уровне трансляции
Синтез белков регулируется на уровне трансляции, во время инициации и элонгации. Например, IF2 является объектом такой регуляции. Он ингибируется путем фосфорилирования. Гем препятствует фосфорилированию IF2, следовательно, гем активирует инициацию синтеза глобина. Напротив, интерферон стимулирует фосфорилирование IF2 и подавляет инициацию трансляции вирусные белков в клетках хозяина.
Ингибиторы трансляции:
Тетрациклины, левомицетин, эритромицин ингибируют элонгацию трансляции, стрептомицин – инициацию. Яд бледой поганки (аманитин) ингибируют РНК-полимеразы. Дифтерийный токсин ингибирует элонгацию трансляции.
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
Наглядный материал к теме «Матричные синтезы».
Схема 1. Репликация. Синтез лидирующей и отстающей цепей ДНК.
Схема 2. Транскрипция. Сплайсинг мРНК.
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
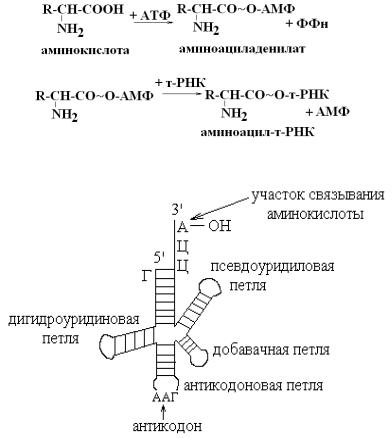
Схема 3. Трансляция. Активация аминокислот (образование аминоацил-тРНК)
Акцепторный стебель -к 3`-ОН АМФ присоединяется АК. Псевдоуридиновая и дополнительная петля – взаимодействует с рибосомой.
Дигидроуридиновая – предполагают, что она взаимодействует с ферментом аминоацил- тРНК-синтазой.
Антикодоновая петля – содержит антикодон.
СГМУ им. В.И. Разумовского |
лектор: |
Кафедра биохимии |
Русецкая Н.Ю. |
Схема 4. Элонгация трансляции
1.
2.
3.
4.
