
1 модуль / Lekcija_2_Ruseckaja_Fiziko-Himicheskie_Svojstva_Belkov
.pdf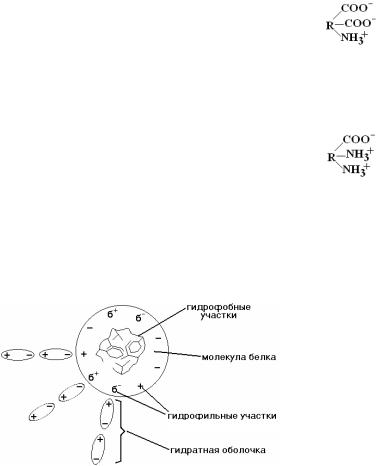
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
Лекция № 2.
Тема: «Физико-химические свойства белков. Методы выделения и очистки. изменение белков в онтогенезе»
План.
1.Молекулярная масса
2.Амфотерность и заряд
3.Факторы устойчивости белка в растворе
4.Изоэлектрическая точка белка
5.Денатурация белка
6.Методы выделения белков
7.Изменение белков в онтогенезе
1. Молекулярная масса Белки – высокомолекулярные органические азотсодержащие полимеры, построенные из аминокислот.
Молекулярная масса белков зависит от количества полипептидных цепей (субъединиц) в молекуле белка и от количества АК в каждой субъединице. Молекулярная масса белков может колебаться от 6000 до нескольких млн Да (1 Да = 1,66·10-24 г). Например, М инсулина = 5733 Да, М HbA= 64500 Да, фермента глутаматдегидрогеназы = 1 млн Да.
Растворы белков обладают свойствами коллоидных растворов благодаря своей полидисперсности.
2. Амфотерность и заряд Белки – амфотерные полиэлектролиты, т.е. они сочетают в себе кислые и основные свойства. В
зависимости от этого белки могут быть кислыми и основными. Свойства зависят от аминокислотного состава белков. В составе кислых белков преобладают глютаминовая и аспарагиновая кислоты. Основные белки содержат преимущественно лизин, аргинин и гистидин.
Заряд белка обусловлен соотношением ионогенных группировок в белках, таких как –СОО- и NH3+. Если в белке преобладают дикарбоновые аминокислоты, то при диссоциации карбоксильных групп в нейтральной среде белок будет заряжен отрицательно.
рН = 7
Кислые белки: все белки плазмы крови.
Если белок основной (преобладают лизин, аргинин и гистидин), то в нейтральной среде белки будут заряжены положительно за счет протонирования аминогрупп.
рН = 7
Основные белки: гистоновые.
Заряд белка – важное свойство белков, которое является фактором устойчивости белков в растворе, усиливает их гидрофильность, обеспечивает формирование ионных связей между белками и их лигандами.
3. Факторы устойчивости белка в растворе
1)ГИДРАТНАЯ ОБОЛОЧКА - это слой молекул воды, связанных с полярными радикалами аминокислотных
остатков в белке. Чем больше в составе белковой молекулы и на ее поверхности аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее удерживается гидратная оболочка.
2) ЗАРЯД БЕЛКОВОЙ МОЛЕКУЛЫ. Благодаря наличию полярных заряженных боковых радикалов аминокислот (-СОО- и -NH3+) белковые молекулы имеют заряд.
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
4. Изоэлектрическая точка белка Значение рН, при котором белок становится электронейтральным, называется изоэлектрической точкой
(ИЭТ) белка. Для основных белков ИЭТ находится в щелочной среде, для кислых – в кислой среде. В ИЭТ степень диссоциации амино- и карбоксильных групп боковых радикалов аминокислот может стать равной и белок утратит заряд и станет электронейтральным. Следовательно, в ИЭТ белок утрачивает заряд, становится неустойчив в растворе и выпадает в осадок.
5. Денатурация белка Денатурация – это последовательное нарушение четвертичной, третичной, вторичной структур белка,
сопровождающееся потерей биологических свойств. Денатурированный белок может выпадать в осадок. Лучшими условиями для осаждения являются те, при которых снимаются оба фактора устойчивости в растворе (заряд и гидратная оболочка). Осадить белок можно, изменяя рН среды (ИЭТ), либо действуя каким-либо фактором денатурации.
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
Физические факторы
1.Высокие температуры. Часть белков подвергается денатурации уже при 40-50°С.
2.Ультрафиолетовое облучение
3.Рентгеновское и радиоактивное облучение
4.Ультразвук
5.Механическое воздействие (например, вибрация).
Химические факторы
1.Колебания рН.
2.Концентрированные кислоты и щелочи.
3.Соли тяжелых металлов (например, CuSO4).
4.Органические растворители (этиловый спирт, ацетон)
Факторы денатурации могут вызвать обратимую или необратимую денатурацию.
Обратимое осаждение Высаливание
Процесс осаждения разными концентрациями растворов нейтральных солей (NaCl, (NH4)2SO4) называется высаливанием. Под действием факторов высаливания снижается устойчивость раствора белка и белок может выпасть в осадок. При этом не меняются и не утрачиваются биологические свойства белка, т.е. функции белка не нарушаются. Высаливание используется для фракционирования белков, т.е. для разделения белков на фракции. Для разделения белков сыворотки крови (альбуминов и глобулинов) используют разные концентрации сернокислого аммония: при 50% насыщении высаливаются высокомолекулярные глобулины, а при 100% насыщении – альбумины. Способность к высаливанию наиболее выражена у анионов солей. При добавлении растворителя или при удалении анионов солей путем диализа структура белка может восстанавливаться.
Необратимое осаждение К факторам, снижающим растворимость, могут быть отнесены факторы, снимающие заряд, гидратную
оболочку и вызывающие частичную денатурацию белка (например, спирт, ацетон). При осаждении белков крепкими кислотами, щелочами, солями тяжелых металлов, при кипячении или действии других агрессивных факторов осаждение будет сопровождаться нарушением природных (нативных) свойств белка. Это связано с тем, что под действием этих факторов происходит разрушение связей, стабилизирующих структурную организацию молекулы белка.
Под действием растворов тяжелых металлов белок может образовывать нерастворимый комплекс с денатурирующими агентами.
Свойства денатурированного белка
1.Уменьшение растворимости и выпадение в осадок.
2.Изменение структуры белка.
3.Потеря нативных свойств белка.
СГМУ им. В.И. Разумовского |
лектор: |
кафедра биохимии |
Русецкая Н.Ю. |
4.Развертывание молекулы белка с освобождением дополнительных функциональных групп (боковых гидрофобных радикалов аминокислот) и образование между ними новых связей.
Процесс последовательного восстановления третичной и четвертичной структур белка, сопровождающийся восстановлением биологических свойств белка, называется ренатурацией. In vivo, в организме, возможна быстрая ренатурация. Это связано с выработкой в живом организме специфических белков шаперонов, которые «узнают» структуру денатурированного белка, присоединяются к нему с помощью слабых типов связи и создают оптимальные условия для ренатурации.
6. Методы выделения белков:
1.Высаливание (см. выше);
2.электрофорез (разделение белков по молекулярной массе и заряду в электрической поле) на различных носителях: бумаге, агарозном, крахмальном, полиакриламидном гелях, иммуноэлектрофорез;
3.гель-фильтрация (фракционирование белков по молекулярной массе на хроматографической колонке).
Очистка белков от низкомолекулярных примесей осуществляется путем диализа с использованием полупроницаемой мембраны, но наиболее эффективным способом очистки белкового раствора является гель-фильтрация.
7. Изменение белков в онтогенезе В онтогенезе изменяется структура многих белков. Например, формирование физиологических типов
гемоглобина в различные периоды онтогенеза: у эмбриона HbP, у плода HbF, у взрослого HbA. У этих типов гемоглобина наблюдается разное сродство к кислороду. Наиболее выражена способность связывать кислород у HbF плода. Изменение белков эмали: амелогенины (преобладают в эмали на ранних стадиях развития) заменяются на энамелогенины у взрослого человека после минерализации эмали.
