
1 модуль / Lekcija_1._Ruseckaja
.pdfМатериалы для образовательного портала 12. 03. 2011 год
Лекция №1.
Тема: «Предмет и задачи биологической химии. История развития биохимии. Простые белки, их структура и свойства»
Лектор: доцент, канд. биол. наук Русецкая Наталья Юрьевна
План:
1.Предмет биологической химии. Биохимия – теоретическая основа биологии и медицины.
2.Биохимическое обследование больного – один из важнейших этапов общего клинического обследования.
3.Особенности клинического обследования ребенка.
4.Общие представления об обмене веществ.
5.Простые белки, их химическое строение и структурная организация.
1.Предмет биологической химии. Биохимия – теоретическая основа биологии и медицины. Биологическая химия – наука, изучающая химическую природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью органов и тканей.
Цель биохимии – применять знания, полученные при изучении биохимии, для изучения других дисциплин (физиология, патофизиология, фармакология, микробиология и мн. др.), а также в профессиональной деятельности врача для выявления нормы и патологии.
2.Биохимическое обследование больного – один из важнейших этапов общего клинического обследования. БИОХИМИЯ – одна из основных медицинских дисциплин. Особое значение приобретает исследование состояния обмена веществ у больного человека. Болезнь – это адаптация обмена веществ к действию повреждающего фактора. Специфика заболеваний проявляется на уровне отдельных органов, но индивидуальность заболеваний проявляется на уровне целостного организма. Причем каждому возрасту присущ свой обмен веществ. Выявить проявление возрастного гомеостаза можно с помощью биохимических исследований: анализа крови, мочи и других методов.
Пути диагностирования:
1) биохимический анализ биологических жидкостей,
2) анализ форменных элементов крови,
3) методы биохимического анализа с использованием функциональной нагрузки,
4) биопсия тканей.
В настоящее время широко используются методы ферментативного диагностирования. Для постановки диагноза инфаркта миокарда, заболеваний печени, панкреатита и других проводят определение активности ферментов.
3. Особенности клинического обследования ребенка. Особенности биохимического анализа у детей имеют свои особенности:
а) биохимический показатель у ребенка не стабилен даже в норме (концентрация глюкозы в крови может увеличиваться, если при заборе крови ребенок плачет); б) некоторые биохимические показатели у детей отличаются от величин у взрослых (активность ряда ферментов, наличие креатина и кетоновых тел в моче и др.);
1
Материалы для образовательного портала 12. 03. 2011 год
в) следует учитывать влияние лекарственных средств (салицилаты увеличивают активность трансаминаз); г) возможно проводить биохимические исследования до рождения (например, определять билирубин
воколоплодных водах).
4.Общие представления об обмене веществ. Обмен веществ, или метаболизм, - совокупность всех химических реакций, протекающих в организме, направленная на сохранение и самовоспроизведение живых систем.
5.Простые белки, их химическое строение и структурная организация. Белки – высокомолекулярные органические азотсодержащие полимеры, построенные из аминокислот. Белки (протеины – «первые») составляют более половины сухого веса организма. Они присутствуют во всех клетках. Любой белок состоит из 20 различных α-аминокислот L-ряда. Аминокислоты (АК) в белках ковалентно связаны между собой пептидными связями. Из 20 аминокислот в различных комбинациях и последовательности образуются различные белки, выполняющие разнообразные функции.
Функции белков:
1.Ферментативная
2.Транспортная
3.Сократительная
4.Структурная
5.Защитная
6.Регуляторная
7.Рецепторная
8.Питательная
Классификация белков.
Белки, которые при гидролизе образуют только АК, называют простыми или протеинами. Белки, которые при гидролизе, кроме АК образуют другие соединения, называют сложными или протеидами.
Классификация аминокислот.
I.Физико-химическая – основана на различиях в физико-химических свойствах аминокислот.
1)Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы и ароматические кольца. К гидрофобным аминокислотам относятся ала, вал, лей, иле, фен, три, мет.
2)Гидрофильные (полярные) незаряженные аминокислоты. Радикалы таких аминокислот содержат в своем составе полярные группировки (-ОН, -SH, -NH2). Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них. К полярным незаряженным относятся гли, сер, тре, тир, цис, глн, асн.
3)Полярные отрицательно заряженные аминокислоты. К ним относятся аспарагиновая и глутаминовая кислоты. Они имеют дополнительную карбоксильную группу в радикале. В нейтральной среде асп и глу приобретают отрицательный заряд.
2
Материалы для образовательного портала 12. 03. 2011 год
4) Полярные положительно заряженные аминокислоты: аргинин, лизин и гистидин. Имеют дополнительную аминогруппу (или имидазольное кольцо, как гистидин) в радикале. В нейтральной среде лиз, арг и гαис приобретают положительный заряд.
II. Биологическая классификация.
1)Незаменимые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать с пищей (вал, иле, лей, лиз, мет, тре, три, фен) и еще 2 аминокислоты относятся к частично незаменимым (арг, гис).
2)Заменимые аминокислоты могут синтезироваться в организме человека (глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин).
III.Химическая классификация. По строению бокового радикала различают алифатические, ароматические, серусодержащие, оксиаминокислоты, диаминомонокарбоновые, дикарбоновые аминокислоты и иминокислоты.
Строение аминокислот Все аминокислоты являются α-аминокислотами. Аминогруппа общей части всех аминокислот
присоединена к α-углеродному атому. Аминокислоты содержат карбоксильную группу –COOH (при физиологическом значении pH эта группа заряжена отрицательно), и аминогруппу -NH2
(при физиологическом значении pH заряжена положительно). В белке ионогенные группы общей части аминокислот участвуют в образовании пептидной связи, и все свойства белка определяются только свойствами радикалов
аминокислот.
Пространственная организация белковой молекулы Существует четыре уровня пространственной организации белка: первичная, вторичная,
третичная и четвертичная структура белковых молекул.
Первичная структура белка - последовательность аминокислот в полипептидной цепи (ППЦ). Пептидная связь формируется только за счет альфа-аминогруппы и альфа-карбоксильной группы аминокислот.
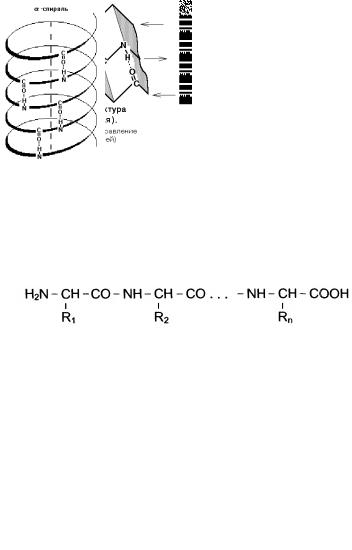
Вторичная структура - это пространственная организация стержня полипептидной цепи в виде α-спирали или β-складчатой структуры.
В α-спирали на 10 витков приходится 36 аминокислотных остатков. Фиксируется α-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка.
3
Материалы для образовательного портала 12. 03. 2011 год
β-Складчатая структура удерживается также водородными связями между С=О и NH-
группами. Если такие связи образуются в пределах одного пептида, то они всегда антипараллельны, а если между разными полипептидами, то параллельны. Белки содержат как спиральные, так и складчатые участки.
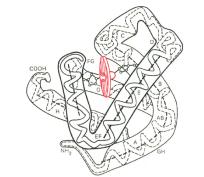
Третичная структура - особое взаимное расположение в пространстве спиралеобразных и складчатых участков полипептидной цепи. В формировании третичной структуры участвуют прочные дисульфидные связи и все слабые типы связей (ионные, водородные, гидрофобные, Ван-
дер-ваальсовые взаимодействия). Выделяют два общих типа третичной структуры:
1) В фибриллярных белках (например, коллаген, эластин) молекулы которых имеют
вытянутую форму и обычно формируют волокнистые структуры тканей, третичная структура представлена либо тройной альфа-спиралью (например, в коллагене), либо бета-складчатыми структурами. В фибриллярных белках гидрофобные радикалы обращены наружу, поэтому
фибриллярные белки нерастворимы в воде. |
|
|
|
|
2) В глобулярных |
белках, молекулы которых имеют форму |
|||
шара или эллипса (от лат. |
globula - шар), встречается сочетание α- |
|||
спирали и β-складчатой структуры. |
Обычно в |
глобулярных |
||
белках гидрофобные участки молекулы находятся |
в |
глубине |
||
молекулы, а гидрофильные радикалы обращены наружу и |
||||
гидратированы, т.е. вокруг полярных радикалов |
формируется |
|||
гидратная оболочка. Поэтому глобулярные белки растворимы в воде. Если белок состоит только из одной ППЦ, то он может иметь только
третичную структуру (например, миоглобин).
Четвертичная структура – трехмерная организация в пространстве нескольких полипептидных цепей. Каждая цепь называется субъединицей (или протомером). Поэтому белки, обладающие четвертичной структурой, называют олигомерными белками. В состав белковой молекулы могут входить одинаковые или разные субъединицы. Например, молекула HbA состоит из двух α- и двух β-субъединиц. Четвертичные структуры белков стабилизируются всеми типами слабых связей, а иногда еще и дисульфидными связями.
Активный центр белковой молекулы При функционировании белков может происходить их связывание с лигандами –
низкомолекулярными веществами. Лиганд присоединяется к определенному участку в белковой молекуле – активному центру. Активный центр формируется на третичном и четвертичном уровнях организации белковой молекулы и образуется благодаря притяжению боковых радикалов определенных аминокислот (между -ОН группами сер формируются водородные связи, ароматические радикалы связаны гидрофобными взаимодействиями, -СООН и –NH2 - ионными связями).
4
