
- •1 Простые и сложные вещества, хим элементы
- •4 Закон сохранения массы веществ. Закон постоянства состава
- •5. Закон эквивалентов и закон кратных отношений
- •6 Газовые законы
- •7 Таблица Менделеева
- •Периодический закон
- •8 Ядерная модель атома Резерфорда
- •9 Квантовая теория строения атома Бора. Корпускулярно-волновая теория.
- •10 Главное квантовое число . Физический смысл и численные значения
- •11 Орбитальное квантовое число. Формы электронных облаков
- •12 Главное, орбитальное, магнитное, спиновые числа для волновых функций частиц
- •13 Принцип Паули. Распределение электронов в атоме по состояниям.
- •14 Запрет Паули ,Правило Хунда
- •15 Основные типы и характеристики химической связи
- •16 Ковалентная связь. Способы образования – обменный и донорно-акцепторный. Свойства ковалентной связи.
- •17 Ионная связь. Энергия ионной кристаллической решетки. Механизм образования и свойства ионной связи.
- •18 Металлическая и водородная связь. Механизм образования и свойства.
- •19 Характеристика раствора. Процесс растворения, растворитель . Насыщенный раствор , растворимость, зависимость растворимости от температуры. Критическая температура растворимости
- •20 Способы выражения концентрации растворов
- •21. Гидраты и кристаллогидраты. Понятие связанной и кристаллизационной воды. Двление пара растворов. Закон Рауля.
- •22 Превращение энергии в химических реакциях. Экзо- эндотермические реакции
- •24 Основные термодинамические функции состояния системы. Энтропия. Стандартная энтропия. Изменение энтропии в различных процессах.
- •26. Направленность протекания реакций при разных знаках термодинамических функций состояния
- •28 Зависимость скорости реакции от концентрации реагирующих веществ. Закон действия масс.
- •29 Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
- •30 Понятие энергии активации. Уравнение Аррениуса.
- •32 Химическое равновесие. Необратимые и обратимые процессы.
- •33 Факторы определяющие направление протекания хим. Реакций
- •34 Понятие константы равновесия
- •35. Смещение химического равновесия принцип ле шателье
- •Принцип Ле-Шателье
- •36. Типы химических реакций.
- •37 Теория электролитической диссоциации . Процесс диссоциации. Сильные и слабые. Степень диссоциации. Сила электролитов.
- •38. Электролиты. Правило Бертолле. Ионообменные реакции и условия их протекания.
- •39. Понятие константа диссоциации. Закон разбавление Оствальда
- •Водородный показатель pH
- •41. Гидролиз солей
- •42. Константа и степень гидролиза . Определение кислотности среды при различных случаях гидролиза.
- •43. Классификация, строение, основные способы получения и свойства комплексных соединений . Устойчивость комплексных соединений.
- •44. Окислительно-восстановительные реакции. Понятие об окислителе и восстановителе. Важнейшие окислители и восстановители.
- •45 Типы окислительно-восстановительных реакций
- •46.Электродный потенциал металла. Гальванические элементы.
- •47. Нормальный водородный электрод . Уравнение Нернста. Автомобильный аккумулятор.
- •49 Коррозия металлов. Классификация коррозионных процессов.
- •50. Химическая коррозия. Способы защиты от коррозии.
- •51. Коррозия металлов. Электрохимическая коррозия. Способы защиты.
- •52. Кислородная и водородная деполяризация.
46.Электродный потенциал металла. Гальванические элементы.
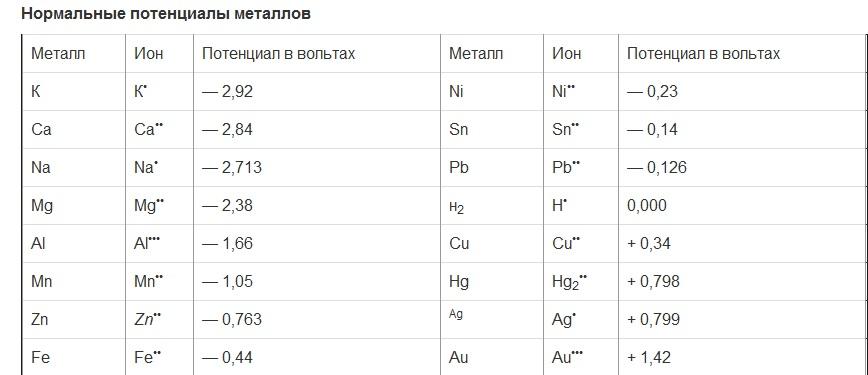
В качестве стандартного электрода, с потенциалом которого сравнивают потенциалы других металлов, принят так называемый нормальный водородный электрод. Последний состоит из платиновой пластинки, покрытой рыхлым слоем платины и погруженной в двунормальный раствор серной кислоты. Через раствор непрерывно пропускают под давлением в 1 ат токчистого водорода, который, приходя в соприкосновение с платиной, в довольно большом количестве поглощается ею. Насыщенная водородом платиновая пластинка ведет себя так, как если бы она была сделана из водорода. При соприкосновении ее с раствором серной кислоты возникает определенная разность потенциалов (потенциал водородного электрода), условно принимаемая при измерениях относительных потенциалов за нуль.
Разность потенциалов между металлом, погруженным в раствор его соли, содержащий 1 грамм ион металла на литр, и нормальным водородным электродом называется нормальным потенциалом металла.
Для измерения нормальных потенциалов обычно пользуются приборами, подобными изображенному на. По существу такой прибор представляет собой гальванический элемент, одним из электродов которого служит испытуемый металл, а другим — водородный электрод. Так как потенциал водородного электрода принимается за нуль, то, измерив разность потенциалов на полюсах такого элемента или его электродвижущую силу, мы непосредственно находим нормальный потенциал металла.
В табл. 27 указаны нормальные потенциалы важнейших металлов . Они берутся со знаком минус, когда потенциал металла ниже потенциала водородного электрода, и со знаком плюс, когда потенциал металла выше его.
Если расположить металлы, включая и водород, по убывающей величине напряжения их электродов, т. е. по убывающим отрицательным нормальным потенциалам (и возрастающим положительным), то получится тот же самый ряд напряжений.
Зная нормальные потенциалы металлов, легко определить электродвижущую силу любого элемента, состоящего из двух металлов, погруженных в растворы их солей. Для этого нужно только найти разность нормальных потенциалов взятых металлов.
Чтобы величина электродвижущей силы имела положительное значение, всегда вычитают из большего потенциала меньший. Например, электродвижущая сила медно-цинкового элемента:
э. д. с. = 0,34 — (—0,763) = 1,103 вольта
Гальванический
элемент – прибор, который преобразовывает
химическую энергию в электрическую.
Одним из таких элементов является
элемент Даниэля – Якоби. Этот элемент
состоит из двух электродов: цинкового
и
медного, – погруженных в соответствующие
сульфатные растворы, между которыми
пористая перегородка:
![]()
При замыкании внешней цепи электроны переходят от Zn к Cu, происходит диффузия цинка в медь:
Образуем
электрохимическую схему![]()
Анод
– отрицательный электрод (слева). Катод
– положительный электрод![]()
Для определения ЭДС этого элемента нужно сравнить стандартные электродные потенциалы обоих электродов. При записи электродных реакций принято, что окисленная форма находится в левой части, а восстановленная – в правой части уравнения.
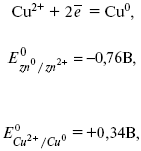
где E0 – электродвижущая сила (ЭДС) гальванического элемента, когда все реагенты в стандартном состоянии.
ЭДС элемента вычисляется вычитанием из потенциала катода потенциала анода.
ЭДС элемента равна +0,34 – (–0,76) = 1,1 В; чем больше электродные потенциалы отличаются друг от друга, тем больше ЭДС. Если погрузить металл в раствор соли большей концентрации, то потенциал нестандартный. Значит, на величину электродного потенциала влияет концентрация и температура. Такая зависимость выражается уравнением В. Нернста.
![]() где
п – число
ионов;R – универсальная газовая
постоянная;Т – температура;С
– концентрация активных
ионов в растворе;F – число Фарадея =
96500 В.
где
п – число
ионов;R – универсальная газовая
постоянная;Т – температура;С
– концентрация активных
ионов в растворе;F – число Фарадея =
96500 В.
