
- •1 Простые и сложные вещества, хим элементы
- •4 Закон сохранения массы веществ. Закон постоянства состава
- •5. Закон эквивалентов и закон кратных отношений
- •6 Газовые законы
- •7 Таблица Менделеева
- •Периодический закон
- •8 Ядерная модель атома Резерфорда
- •9 Квантовая теория строения атома Бора. Корпускулярно-волновая теория.
- •10 Главное квантовое число . Физический смысл и численные значения
- •11 Орбитальное квантовое число. Формы электронных облаков
- •12 Главное, орбитальное, магнитное, спиновые числа для волновых функций частиц
- •13 Принцип Паули. Распределение электронов в атоме по состояниям.
- •14 Запрет Паули ,Правило Хунда
- •15 Основные типы и характеристики химической связи
- •16 Ковалентная связь. Способы образования – обменный и донорно-акцепторный. Свойства ковалентной связи.
- •17 Ионная связь. Энергия ионной кристаллической решетки. Механизм образования и свойства ионной связи.
- •18 Металлическая и водородная связь. Механизм образования и свойства.
- •19 Характеристика раствора. Процесс растворения, растворитель . Насыщенный раствор , растворимость, зависимость растворимости от температуры. Критическая температура растворимости
- •20 Способы выражения концентрации растворов
- •21. Гидраты и кристаллогидраты. Понятие связанной и кристаллизационной воды. Двление пара растворов. Закон Рауля.
- •22 Превращение энергии в химических реакциях. Экзо- эндотермические реакции
- •24 Основные термодинамические функции состояния системы. Энтропия. Стандартная энтропия. Изменение энтропии в различных процессах.
- •26. Направленность протекания реакций при разных знаках термодинамических функций состояния
- •28 Зависимость скорости реакции от концентрации реагирующих веществ. Закон действия масс.
- •29 Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
- •30 Понятие энергии активации. Уравнение Аррениуса.
- •32 Химическое равновесие. Необратимые и обратимые процессы.
- •33 Факторы определяющие направление протекания хим. Реакций
- •34 Понятие константы равновесия
- •35. Смещение химического равновесия принцип ле шателье
- •Принцип Ле-Шателье
- •36. Типы химических реакций.
- •37 Теория электролитической диссоциации . Процесс диссоциации. Сильные и слабые. Степень диссоциации. Сила электролитов.
- •38. Электролиты. Правило Бертолле. Ионообменные реакции и условия их протекания.
- •39. Понятие константа диссоциации. Закон разбавление Оствальда
- •Водородный показатель pH
- •41. Гидролиз солей
- •42. Константа и степень гидролиза . Определение кислотности среды при различных случаях гидролиза.
- •43. Классификация, строение, основные способы получения и свойства комплексных соединений . Устойчивость комплексных соединений.
- •44. Окислительно-восстановительные реакции. Понятие об окислителе и восстановителе. Важнейшие окислители и восстановители.
- •45 Типы окислительно-восстановительных реакций
- •46.Электродный потенциал металла. Гальванические элементы.
- •47. Нормальный водородный электрод . Уравнение Нернста. Автомобильный аккумулятор.
- •49 Коррозия металлов. Классификация коррозионных процессов.
- •50. Химическая коррозия. Способы защиты от коррозии.
- •51. Коррозия металлов. Электрохимическая коррозия. Способы защиты.
- •52. Кислородная и водородная деполяризация.
38. Электролиты. Правило Бертолле. Ионообменные реакции и условия их протекания.
Электроли́т — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Правило Бертолле формулируется так: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода).
Реакция обмена в растворе может изображаться тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении малорастворимые вещества, газы и электролиты изображаются молекулярными формулами.
Пример: обменная реакция растворимой соли со щёлочью. В результате реакции образуется нерастворимое вещество.
Если смешать растворы двух диссоциирующих веществ, то положительно заряженные ионы (катионы) взаимодействуют с ионами, заряженными отрицательно (анионы). Все участвующие в реакции вещества находятся в виде ионов. Связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима. Приведенные примеры свидетельствуют о том, что необходимыми условиями протекания реакций ионного обмена до конца являются: 1) образование осадка; 2) выделение газа; 3) образование малодиссоциирующих молекул воды. Естественно, что в ходе ответа можно приводить другие примеры реакций ионного обмена, но при этом важно помнить об использовании таблицы «Растворимость кислот, оснований и солей в воде», из которой видно, какое вещество растворимо, а какое — нет. Отличительной особенностью реакции ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
39. Понятие константа диссоциации. Закон разбавление Оствальда
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы.
Закон разбавления Оствальда устанавливает связь между степенью диссоциации и концентрацией слабого электролита. Для вывода этой закономерности запишем уравнение диссоциации и выражение для константы кислотности (диссоциации) уксусной кислоты:
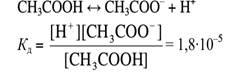 [H+],
[CH3COO–]–
молярные равновесные концентрации
ионов
[H+],
[CH3COO–]–
молярные равновесные концентрации
ионов
[CH3COOН] – молярная равновесная концентрация недиссоциированных молекул кислоты (определяется как разность между общей концентрацией кислоты См и концентрацией еѐ диссоциированных молекул [CH3COOH]дисс).
Равновесные концентрации диссоциированных молекул кислоты, протонов и ацетат-ионов можно выразить через степень диссоциации (α). Тогда в соответствии с уравнением диссоциации получим
![]()
Равновесная концентрация уксусной кислоты (недиссоциированных молекул) будет равна [CH3COOH] = См – [CH3COOH]дисс = См – αCм = См(1 – α)
После подстановки полученных выражений концентраций в уравнение константы диссоциации оно примет вид, называемый законом разбавления Оствальда
![]()
Если степень диссоциации α <<1 (К<10-4) , ею в знаменателе можно пренебречь.
Тогда
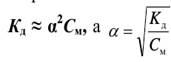 то
есть степень диссоциации увеличивается
с разбавлением.
то
есть степень диссоциации увеличивается
с разбавлением.
40 Ионное произведение воды. Водородный показатель . Кислотность среды. Вода является практически незаменимым растворителем в экспериментальной и прикладной химии, поэтому необходимо изучение ее свойств. Остановимся на таких понятиях как ионное произведение воды и водородный показатель pH.
Ионное произведение воды При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно донором и акцептором протонов по отношению к самой себе.
2H2O ↔ H3O+ + OH—
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+заменить на H+
H2O ↔ H+ + OH—
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH—]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]·[OH—]
При температуре 25ºС KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH—] = 1·10-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14)
