
- •Оглавление
- •Статистическая физика Динамический подход и его бесперспективность
- •Статистический метод описания коллектива частиц
- •Макро- и микросостояния
- •Энтропия и ее статистический смысл
- •Термодинамический способ описания коллектива частиц
- •Внутренняя энергия системы
- •Полная статистическая функция распределения
- •Вырожденные и невырожденные коллективы частиц
- •Функция распределения Максвелла-Больцмана
- •Функция распределения Максвелла по абсолютным значениям скоростей
- •Зависимость распределения Максвелла от температуры
- •Формула Максвелла в приведенном виде
- •Экспериментальная проверка распределения Максвелла. Опыт Штерна
- •Закон равнораспределения
- •Функция Ферми-Дирака
- •Круговые процессы
- •Второе начало термодинамики
- •Тепловой двигатель
- •Цикл Карно
- •Энтропия
- •Явление переноса
- •Фазовые переходы
- •Фазовые переходы
- •Квантовая механика Опыт Резерфорда. Ядерная модель атома
- •Теория Бора для водородоподобных систем
- •Описание движения свободной частицы
- •Частица в бесконечно глубокой одномерной потенциальной яме
- •Уровни энергии частицы в потенциальной яме
- •Потенциальный барьер
- •Гармонический осциллятор
- •Решение уравнения Шредингера для водородоподобного атома
- •Энергия ионизации атома водорода
- •Спин электрона
- •Распределение электрона в атоме
Закон равнораспределения
На
каждую степень свободы молекул приходится
в среднем 1 молекула

Тогда
энергия молекулы будет равна


На
каждую колебательную степень свободы
приходится в среднем
 – одна в виде кинетической, а другая –
потенциальной.
– одна в виде кинетической, а другая –
потенциальной.


Теплоемкость идеального газа при V=const

Уравнение
Майера
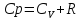

Распределение молекул в поле сил тяготения
Распределение Больцмана
 ,гдеp– давление на высотеh,p0– давление на
поверхности земли,h–
высота, M – молярная масса газа,P=nkT,P0=n0kT,n– концентрация молекул.
,гдеp– давление на высотеh,p0– давление на
поверхности земли,h–
высота, M – молярная масса газа,P=nkT,P0=n0kT,n– концентрация молекул.


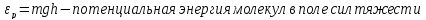
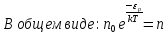
Это распределение Больцмана в потенциальном поле сил.
Опыт Перрена по определению числа Авогадро
Перрен исследовал Броуновское движение и доказал, что частицы имеют распределение по высоте и выражаются формулой



Замерим концентрацию частиц на двух высотах:



Прологарифмируя получим:




Так было экспериментально определено число Авогадро
Квантовые статистики
Фермионы – индивидуалисты и не допускают другие фермионы на свои квантовые состояния, Бозоны – коллективисты – если один бозон имеет энергию, то и все элементы имеют эту энергию.
Если для частиц с полуцелым спином, например, для вырожденного газа электронов в металле справедлива функция распределения Ферми-Дирака.

Функция
распределения
 по своему физическому смыслу означает
вероятность заполнения состояний
частицами.
по своему физическому смыслу означает
вероятность заполнения состояний
частицами.
Умножая эту функцию на число состояний электрона, получим полную функцию распределения Ферми-Дирака в металле:

Для бозонов (частиц с целым или 0 спином) имеет вид:
Функция
Бозе-Эйнштейна:

Эта функция описывает распределения фотонов, т.е. квантов светового излучения и фононов – колебания кристаллической решетки.
Запишем распределение Бозе-Эйнштейна для фотонного газа:
Т.к.
для фотона

Эта
формула показывает среднее число
фотонов, обладающих энергией
 и носит название Формулы Планка. Она
была применена для квантового расчета
спектральной поверхности теплового
излучения.
и носит название Формулы Планка. Она
была применена для квантового расчета
спектральной поверхности теплового
излучения.
Функция Ферми-Дирака
Функция
распределения
 содержит энергию Е и
содержит энергию Е и ,
которая называется химическим потенциалом.
,
которая называется химическим потенциалом.
Химический потенциал в применении к вырожденному электронному газу называется уровнем Ферми.
При

При
любой температуре
 ,
поэтому со статистической точки зрения
уровень Ферми представляет собой
энергетический уровень, вероятность
заполнения которого равна 1/2
,
поэтому со статистической точки зрения
уровень Ферми представляет собой
энергетический уровень, вероятность
заполнения которого равна 1/2
Термодинамика
Первое начало термодинамики:
Количество теплоты, сообщаемое системе, идет на изменение внутренней энергии системы и на совершение системой работы против внешних сил


 малая
теплота
малая
теплота
 -элементарная
работа
-элементарная
работа
dU- малое изменение внутренней энергии
Ни
работа, ни теплота, не являются функциями
состояния системы, а зависят от вида
процесса, а потому
 ,
, –не являются полными дифференциалами.
–не являются полными дифференциалами.
Запишем 1-ое начало термодинамики в виде:

Уравнение Менделеева – Клапейрона
Уравнение
состояния идеального газа — формула,
устанавливающая зависимость между
давлением, молярным объёмом и абсолютной
температурой идеального газа. Уравнение
имеет вид:
 ,
где:
,
где:
p — давление,
 — молярный объём,
— молярный объём,
R — универсальная газовая постоянная (R = 8,3144598(48) Дж⁄(моль∙К))
T — абсолютная температура, К.
уравнение
состояния можно записать:

Работа газа при изменении его объема
Работа газа зависит не только от начального и конечного положения системы, но и от вида процесса, в котором происходит изменение состояния.
Элементарная
работа газа определяется выражением:
 ,
,
А
полная работа газа

Работа положительна, если в процессе происходит расширение газа, и отрицательна, если газ сжимается.
Теплоемкость.
Теплоемкостью тела Cназывается отношение кол-ва теплоты к изменению температуры в данном ТДПР.

Удельная теплоемкость – теплоемкость единицы массы.

Молярная теплоемкость – теплоемкость одного моля в-ва.

Связь между молярной и удельной C.

Молярные теплоемкости при p=constможно выразить через число степеней свободы.


Изм. внутр. энергии можно выразить.
 или
или

Уравнение Майера.

 – показатель адиабаты.
– показатель адиабаты.
Молярную емкость газа можно выразить через показатель адиабаты:

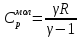

Применение первого начала термодинамики к изопроцессам. Изопроцессы.
1) Изотермический, T=const
Изменение внутренней энергии


Qрасходуется на совершение работы газом против внешних сил.

Теплоемкость
при изотермич. Процессе бесконечно
велика т.к.
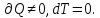
2) Изохорный, V=0
A=0 т.к. ΔV=0
Подводимое тепло идет на изм. внутр. энергии


3) Изобарный, p=const


Или

Колич. теплоты.

Или
в интегральной форме

Адиабатический процесс.
Без
теплообмена с окружающей средой

Осуществляется при быстром расширении или сжатии



Т.е. при адиабатическом процессе соверш. работы происходит за счет убывания внутренней энергии.
A>0 газ охлажд. т.к.U1>U2
A<0 газ нагрев. т.к.U1<U2
C=0
т.к.
Это
следует из

Уравнение Пуассонавыражает связь между т/д параметрами при адиабатич. Процессе.

Уравнение Пуассона в коорд. (T-V) и (T-P):

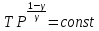
Работа газа при адиабатич. процессе:

Если
при адиабатич. процессе температура
меняется от T1 доT2,
то работу согласно выражениям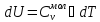 или
или
 и
и можно вычислить по формуле:
можно вычислить по формуле:
