
- •Оглавление
- •Статистическая физика Динамический подход и его бесперспективность
- •Статистический метод описания коллектива частиц
- •Макро- и микросостояния
- •Энтропия и ее статистический смысл
- •Термодинамический способ описания коллектива частиц
- •Внутренняя энергия системы
- •Полная статистическая функция распределения
- •Вырожденные и невырожденные коллективы частиц
- •Функция распределения Максвелла-Больцмана
- •Функция распределения Максвелла по абсолютным значениям скоростей
- •Зависимость распределения Максвелла от температуры
- •Формула Максвелла в приведенном виде
- •Экспериментальная проверка распределения Максвелла. Опыт Штерна
- •Закон равнораспределения
- •Функция Ферми-Дирака
- •Круговые процессы
- •Второе начало термодинамики
- •Тепловой двигатель
- •Цикл Карно
- •Энтропия
- •Явление переноса
- •Фазовые переходы
- •Фазовые переходы
- •Квантовая механика Опыт Резерфорда. Ядерная модель атома
- •Теория Бора для водородоподобных систем
- •Описание движения свободной частицы
- •Частица в бесконечно глубокой одномерной потенциальной яме
- •Уровни энергии частицы в потенциальной яме
- •Потенциальный барьер
- •Гармонический осциллятор
- •Решение уравнения Шредингера для водородоподобного атома
- •Энергия ионизации атома водорода
- •Спин электрона
- •Распределение электрона в атоме
Вырожденные и невырожденные коллективы частиц
По характеру поведения в коллективе все микрочастицы можно разделить на две группы:
Фермионы– Частицы с полуцелым спином – электроны, протоны, нейтроны
Бозоны– Частицы с нулевым или целочисленным спином – фотоны, фононы (кванты звуковых колебаний), колебания кристаллической решетки.
В коллективе фермионыстремятся к уединению, если данное квантовое состояние занято фермионом, то никакой другой фермион данного типа не сможет находиться в этом состоянии.
Принцип запрета Паули:
Бозоны обладают стремлением к объединению. Они могут неограниченно заселять одно и то же состояние.
Предположим, что на Nодинаковых частиц приходитсяGразличных состояний, в которых может находиться отдельная микрочастица.
Микрочастицы будут редко встречаться, если выполняется соотношение:

Такие коллективы называются невырожденными
Если число состояний Gодного порядка с числом N, то имеется условие вырождения

Вырожденные коллективы могут образовыватьсятолько из квантово-механических объектов, т.к. только у таких объектов параметры изменения дискретны.
У классических объектов параметры состояния меняются непрерывно, число состояний Gбесконечно велико и такие объектымогут образовывать только невырожденные коллективы
Функция распределения Максвелла-Больцмана
Расчет для невырожденного идеального газа дает следующий вид функции распределения Максвелла – Больцмана:

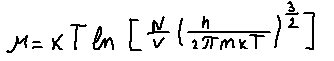

Полная функция распределения частиц по энергиям имеет вид

 Из
функции распределения по энергиям,
подставляя соотношение
Из
функции распределения по энергиям,
подставляя соотношение получаем распределение Максвелла по
скорости:
получаем распределение Максвелла по
скорости:

Средняя
скорость
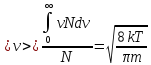

Средняя
квадратичная скорость


Скорость, отвечающая максимуму кривой, называется вероятной скоростью.


Функция распределения Максвелла по абсолютным значениям скоростей


На рисунке изображены графики функции Максвелла для одной и той же массы газа, но для двух различных Т

Площадь заштрихованной криволинейной трапеции на рисунке – это вероятность (доля молекул (dN/N)) того, чтоHмолекулы лежит в интервале отvдоv+dv

Доля
молекул, vкоторых
заключается в пределах отv1
доv2
N– полное число молекул газа
Функция Fм(v) – нормировка на единицу, т.е. площадь под этой кривой = 1

Зависимость распределения Максвелла от температуры
Подставим
значения
 в формулу дляFм(v)
в формулу дляFм(v)
Получим:

С увеличением температуры максимум функции Fм(v) смещается в сторону больших скоростей, а его величина уменьшается.
При этом площадь под всеми кривыми равна 1

На рисунке – распределение Максвелла для разных температур газа
T1<T2<T3, при m=const
Или m1>m2>m3, приT=const
Формула Максвелла в приведенном виде
Введем
относительную скорость молекулы

При переходе к этой переменной учтем равенство


Заменяем
в правой части
 тогда получим
тогда получим
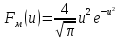
Vв таком виде распределения Максвелла является универсальным: оно не зависит ни от Т, ни от газа
Пример:
найти относительное число молекул dN/Nсо скоростями, отличающимися от наиболее
вероятной не более чем на
В
данном случае u=1 и можно
записать
Замечание:
При статистическом подходе не имеют смысла вопросы:
- какова вероятность в молекуле иметь данную скорость
- сколько молекул имеют вполне определенную скорость
Речь может идти только о числе молекул, имеющих величины скорости в заданном интервале скорости. Оно относится и к энергиям.
Экспериментальная проверка распределения Максвелла. Опыт Штерна
Вдоль оси внутри цилиндра натянута платиновая проволока, покрытая слоем серебра.
При нагревании проволоки электрическим током серебро испарилось. Воздух в приборе откачан.
Прибор
вращается с угловой скоростью
 Атомы серебра осядут не против щели, а
смещаются от точки О на некоторое
расстояние
Атомы серебра осядут не против щели, а
смещаются от точки О на некоторое
расстояние

Таким образом из эксперимента можно найти скорость молекул

Средняя энергия молекул идеального газа
Зная полную функцию распределения частиц идеального газа по энергиям N(E), найдем среднее значение энергии идеального газа



Здесь учтена только энергия поступательного движения молекул.
Запишем уравнение Менделеева-Клапейрона pVm=RTR=K*Na
V– объем одного моля
Давление
газа


Давление идеального газа при данной температуре пропорционально концентрации его молекул.
Основное уравнение МКТ
Оно имеет вид:

Средняя энергия молекул и МК смысл абсолютной температуры

Сравнивая
эти формулы получим
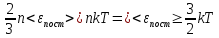
Абсолютная температура есть величина, пропорциональная средней энергии поступательного движения молекул.
В этом и заключается молекулярно-кинетический смысл понятия абсолютной температуры
Т=0
К =>

Закон равномерного распределения энергии молекул по степеням свободы.
Средняя энергия поступательного движения молекул равна



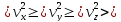
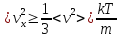
Числом степеней свободы механической системы называют количество независимых величин, с помощь которых может быть задано положение системы.
Одноатомная молекула имеет 3 поступательных степени свободы
Двухатомная молекула с жесткой связью имеет 5 степеней свободы: 3 поступательных и 2 вращательных
Двухатомная молекула с упругой связью имеет 7 степеней свободы (+1 колебательная степень свободы)
Трехатомная молекула с жесткими связями имеет 6 степеней свободы: 3 поступательных и 3 вращательных)
