
- •Оглавление
- •Статистическая физика Динамический подход и его бесперспективность
- •Статистический метод описания коллектива частиц
- •Макро- и микросостояния
- •Энтропия и ее статистический смысл
- •Термодинамический способ описания коллектива частиц
- •Внутренняя энергия системы
- •Полная статистическая функция распределения
- •Вырожденные и невырожденные коллективы частиц
- •Функция распределения Максвелла-Больцмана
- •Функция распределения Максвелла по абсолютным значениям скоростей
- •Зависимость распределения Максвелла от температуры
- •Формула Максвелла в приведенном виде
- •Экспериментальная проверка распределения Максвелла. Опыт Штерна
- •Закон равнораспределения
- •Функция Ферми-Дирака
- •Круговые процессы
- •Второе начало термодинамики
- •Тепловой двигатель
- •Цикл Карно
- •Энтропия
- •Явление переноса
- •Фазовые переходы
- •Фазовые переходы
- •Квантовая механика Опыт Резерфорда. Ядерная модель атома
- •Теория Бора для водородоподобных систем
- •Описание движения свободной частицы
- •Частица в бесконечно глубокой одномерной потенциальной яме
- •Уровни энергии частицы в потенциальной яме
- •Потенциальный барьер
- •Гармонический осциллятор
- •Решение уравнения Шредингера для водородоподобного атома
- •Энергия ионизации атома водорода
- •Спин электрона
- •Распределение электрона в атоме
Макро- и микросостояния
Состояние макроскопического тела может быть задано с помощью параметров состояния P,V,T
Состояние макротела, охарактеризованное настолько подробно, что оказываются заданными состояния всех образующих тело молекул, называется Микросостоянием
Микросостояние – то, как организованно макросостояние.
Число различных микросостояний, соответствующих данному макросостоянию, называется статистическим весомилитермодинамической вероятностью макросостояния.
Пример:
Пусть в сосуде имеется 4 молекулы. Разделим мысленно сосуд на 2 половины.
Рассмотрим способы реализации различных макросостояний:
Макросостояния характеризуются числом молекул слева и числом молекул справа
Слева - 0, справа – 4, способов реализации – 0
Слева – 1, справа – 3, способов реализации – 4
Слева – 2, справа – 2, способов реализации – 6
Всего способов 2^4 = 16
Равновесным является такое макросостояние, которое не имеет тенденции к изменению с течением времени
Равновесное состояние изолированной системы – это такое состояние, статистический вес которого максимален.
В
примере максимальный статистический
вес
Процесс диффузии необратим
Процесс теплопроводности необратим
Энтропия и ее статистический смысл
 ,где
,где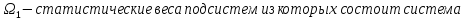

Введем
величину S
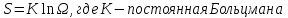
Эту величину называют Энтропией системы
Энтропия
аддитивна

Свойства энтропии:
Энтропия изолированной системы при протекании необратимого процесса возрастает
Энтропия системы, находящейся в равновесном состоянии, максимальна
Это закон возрастания энтропии (2 начало термодинамики)
Итак, энтропия изолированной системы при протекании необратимого процесса не может убывать dS>0
В
общем случае, присоединяя знак = в случае
обратимых (равновесных) процессов, имеем
равенство:

Термодинамический способ описания коллектива частиц
Состояние системы, в котором она может находиться сколь угодно долго называется равновесным.
Равновесное состояние может быть изображено точкой на диаграмме
Процесс,
состоящий из непрерывной последовательности
равновесных состояний, называется
равновесным
Равновесный процесс может быть проведен и в обратном направлении. Поэтому равновесные процессы так же называются обратимыми.
Внутренняя энергия системы
Внутренняя энергия складывается из кинетической энергии частиц, образующих систему, потенциальной энергии взаимодействующих частиц и внутренней энергии самих частиц.
В соответствии с Первым началом термодинамики, изменение внутренней энергии системы равно разности между количеством теплоты, полученного системой извне и работой, совершенной системой против внешних сил.



В общем виде Закон сохранения энергии будет иметь вид:
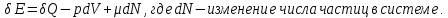

Он выражаетизменение энергии изолированной системы постоянного объема, вызванное изменением в ней числа частиц на единицу.
Условием равновесияпри контакте любых фаз является равенство их химических потенциалов

Полная статистическая функция распределения
Чтобы задать состояние коллектива частиц, надо указать его термодинамические параметры (P,V,T).
Чтобы задать состояние частиц, надо указать значения координатам, импульсам или задать энергию частиц.
Связь
между макропараметрами и микропараметрами
осуществляет полная статистическая
функция распределения
 По формуле
По формуле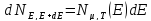
dN– число частиц с энергиями от Е до Е+dЕ
Число частиц

g(E)dEпоказывает число состояний, приходящихся на интервал энергииdE
g(E) характеризует плотность состояний и называется функцией плотности состояний, она показывает сколько состояний имеется в данном интервале энергии
f(E) выражает вероятность заполнения частицами состояний с энергиями от Е доE+dEв случае классической статистики
Зная полную статистическую функцию распределения, можно найти полную энергию коллектива частиц и среднюю энергию частицы.
Полная
энергия
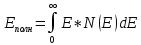
Полное
число частиц

Средняя
энергия частицы

Среднее значение скорости находится по формуле
 N(v)
– функция распределения по скоростям
N(v)
– функция распределения по скоростям
Средняя квадратичная скорость

