
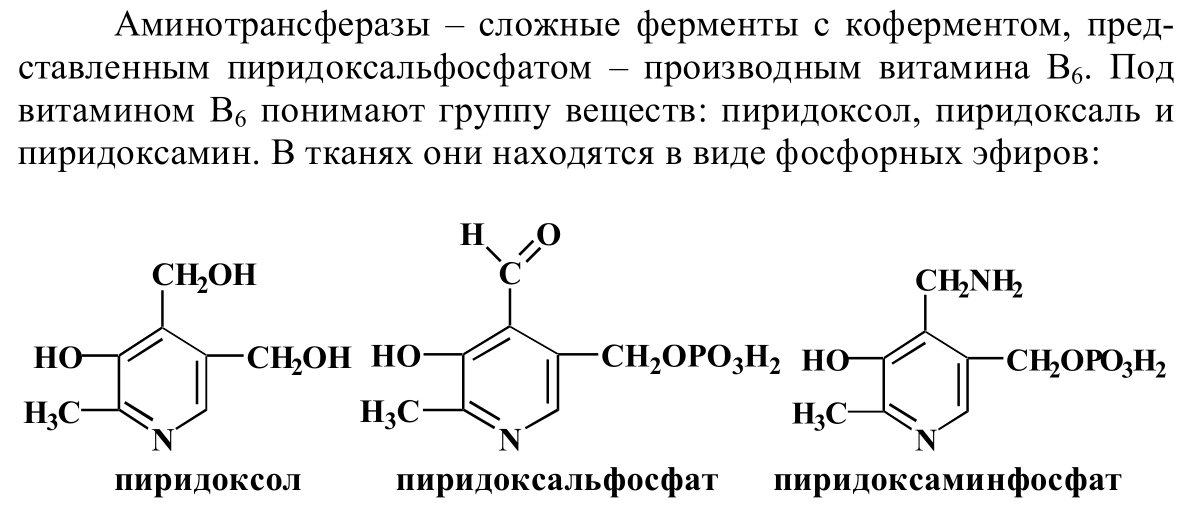
- •2. Трансаминирование аминокислот: химизм, значение. Характери-стика трансаминаз. Непрямое дезаминирование аминокислот.
- •3. Окислительное дезаминирование аминокислот: химизм, характери-стика ферментов. Восстановительное аминирование альфакетоглу-тарата, значение.
- •4. Декарбоксилирование аминокислот. Образование биогенных ами-нов, их роль в регуляции метаболизма и функции.
- •6.Трансметилирование. Метионин и s-аденозилметионин (участие в синтезе креатина, адреналина, фосфатидилхолина, метилировании чужеродных соединений). Участие тетрагидрофолиевой кислоты в метилировании.
- •10. Активация и окисление высших жирных кислот: химизм, энергети-ка, физиологическая роль.
- •2. Окисление глицерина
- •11. Биосинтез и использование кетоновых тел.
- •Реакции 3 этапа
- •13. Биосинтез триацилглицеринов, лицерофосфолипидов.
- •14. Обмен и функции холестерина. Прямой и обратный транспорт хо-лестерина. Биосинтез холестерина: химизм, регуляция.
БИОХИМИЯ. 3 КОЛЛОК
1. ПЕРЕВАРИВАНИЕ БЕЛКОВ. ВСАСЫВАНИЕ АМИНОКИСЛОТ. ДИНАМИЧЕСКОЕ СОСТОЯНИЕ БЕЛКОВ В ОРГАНИЗМЕ. АЗОТИСТЫЙ БАЛАНС. БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ ПИЩЕВЫХ БЕЛКОВ В ПИТАНИИ. РЕГУЛЯЦИЯ ПИЩЕВАРЕНИЯ ГОР-МОНОПОДОБНЫМИ ВЕЩЕСТВАМИ. ВИДЫ КИСЛОТНОСТИ ЖЕЛУДОЧНОГО СОКА.
Переваривание белков происходит в различных отделах пищеварительного тракта (в желудке, двенадцатиперстной кишке и тонком кишечнике) под действием протеолитических ферментов пищеварительных соков. Переваривание белков начинается в желудке под действием
Ферментов желудочного сока. В сутки выделяется от 1,5 до 2,5л сока, который отличается от других пищеварительных соков сильно кислой реакцией. рН его 0,9-1,6 благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка. Секреция соляной кислоты в полость желудка представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ и благодаря наличию в клетках карбоангидразы. Процесс сопровождается уменьшением количества хлоридов в крови.
Роль соляной кислоты:
1. вызывает денатурацию белков;
2. вызывает набухание труднорастворимых белков;
3. растворяет белки, растворимые в кислой среде;
4. активирует пепсиноген;
5. создает рН, необходимое для действия пепсина;
6. стерилизует пищу;
7. способствует всасыванию железа;
8. вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты: пепсин, гастриксин, реннин. Главным из них является пепсин.
Переваривание белков в кишечнике. Образовавшиеся в результате действия пепсина в желудке полипептиды и нерасщепившиеся белки поступают в двенадцатиперстную кишку, куда поступает и сок поджелудочной железы.
Панкреатический сок имеет щелочную реакцию(рН 7,5-8,2), что обусловлено высоким содержанием бикарбонатов. В сутки выделяется до 800 мл сока. Кислое содержимое, поступающее из желудка, нейтрализуется, и пепсин теряет свою активность. В панкреатическом соке содержатся протеолитические ферменты: трипсин, химотрипсин, арбоксипептидаза и эластаза, которые вырабатываются в виде проферментов.
Переваривание сложных белков начинается с отщепления простетической группы, которая в зависимости от химической природы подвергается дальнейшим ферментативным превращениям (например, нуклеиновые кислоты расщепляются панкреатическими РНК-азой и ДНК-азой). Белковая часть гидролизуется рассмотренными выше ферментами до аминокислот.
Всасывание аминокислот происходит путем активного транспорта, т.е. идет с затратой АТФ, против градиента концентрации с участием переносчиков. Выяснено, что существуют специфические транспортные системы, переносящие аминокислоты определенного строения:
1. Нейтральные с небольшим радикалом.
2. Нейтральные с объемным радикалом.
3. Кислые (отрицательно заряженные).
4. Основные (положительно заряженные).
5. Пролин.
В настоящее время расшифрован механизм транспорта аминокислот в клетки кишечника, мозга, почек, получивший название γ-глутамильного цикла. В нем участвуют 6 ферментов и трипептид глутатион. Ключевой фермент – гаммаглутамилтрансфераза (ГГТ) локализован в мембране. Он отщепляет глутаминовую кислоту от глутатиона и переносит ее поступающую в клетку аминокислоту с образованием дипептида. Он оказывается в клетке и расщепляется другим ферментом цикла. аминокислоту и оксопролин. Через ряд реакций оксопролин превращается в глутаминовую кислоту. Из нее, цистеина и глицина, выделившихся при расщеплении глутатиона, происходит ресинтез глутатиона, при этом на активацию каждой аминокислоты затрачивается АТФ,т.е. на ресинтез глутатиона – 3 АТФ.
Судьба аминокислот
Аминокислоты, всосавшиеся через стенку кишечника,поступают в кровь и по системе воротной вены попадают в печень, где используются с различными целями. Главные пути использования следующие:
- Синтез структурных белков.
- Синтез белков плазмы крови.
- Синтез биологически активных веществ (ферментов, пуриновых и пиримидиновых нуклеотидов, аминов, креатина).
- Распад аминокислот с использованием углеродного скелета для глюконеогенеза.
- Значительная часть аминокислот с кровью поступает к органам и тканям. В тканях аминокислоты используются с такими же целями,кроме этого, в эндокринных железах синтезируются гормоны. В тканях, как и в печени, происходит распад аминокислот до СО2, Н2О и ΝН3. О состоянии обмена белков в организме судят по азотистому балансу, т.е. разнице между количеством азота,поступающего в организм,и количеством азота, выводимого из организма( с мочой и калом) в виде конечных продуктов обмена. Возможны три состояния азотистого баланса.
Положительный азотистый баланс- состояние, при котором количество поступающего азота превышает количество выводимого из организма. Такое состояние характерно для детского возраста (у растущих
организмов), беременности, периода выздоровления людей после
перенесенных тяжелых заболеваний, спортсменов в период интенсивной
тренировки. При таком состоянии азотистого баланса синтетические
процессы превалируют над процессами распада белков органов и тканей.
Отрицательный азотистый баланс- состояние, при котором
количество азота, выделяемого из организма, превышает количество азота,
принимаемого с пищей в течение суток.Оно встречается при голодании (частичном или полном), белковой недостаточности, тяжелых раневых и инфекционных заболеваниях, в норме в старческом возрасте. Старики, как правило, теряют в весе, хотя в организм может поступать достаточное количество белков.
Азотистое равновесие - состояние, при котором количество вводимого с пищей азота равно количеству азота, выводимого из организма.
Оно характерно для здорового взрослого человека,находящегося на полноценной диете. Природные белки в связи с разным аминокислотным составом имеют разную пищевую ценность.Чем ближе аминокислотный состав пищевого белка к аминокислотному составу белков человека,тем выше его биологическая ценность. Такими биологически ценными белками для человека являются белки мяса, молока, яиц. Исключение хотя бы одной незаменимой аминокислоты из пищи приводит к отрицательному балансу, остановке роста и развития, прекращению синтеза белков. Недостаточное
поступление одной незаменимой аминокислоты ведет к неполно усвоению других аминокислот, а в последующем также может привести к остановке роста и тяжелым расстройствам.Растительные белки от животных отличаются другим соотношением аминокислот, и поэтому для удовлетворения потребностей человека в белках их требуется значительно больше. Важное значение в удовлетворении потребностей нашего организма в белках имеет способность белков пищи к усвоению, что зависит от способности протеолитических ферментов наших пищеварительных соков расщеплять их до аминокислот. Так, белки шерсти, перьев, волос имеют близкий аминокислотный состав к белкам человека,но не гидролизуются протеолитическими ферментами пищеварительных соков человека большинства животных. Регуляция пищеварения гормоноподобными веществами желудочно-кишечного тракта
Секреция пищеварительных соков находится под контролем сложных нейрогуморальных механизмов, среди которых важное место занимают гормоноподобные вещества желудочно-кишечного тракта.
Секрецию желудочного сока стимулируют гастрин и гистамин. Гастрин – полипептид, вырабатываемый слизистой оболочкой привратника под действием пищи,попадающей в желудок.Секреция его, кроме химических факторов, стимулируется рефлекторным растяжением желудка пищей. Кровотоком гастрин доставляется в клетки слизистой желудка и стимулирует секрецию желудочного сока (воды, электролитов, ферментов).
Гистамин – продукт декарбоксилирования гистидина– вызывает интенсивную секрецию желудочного сока, чем обусловлено его применение в клинике при исследовании функциональной активности слизистой желудка.
Регуляция секреции панкреатического сока осуществляя секретином и холецистокинином. Оба они – полипептиды, синтезируемые
слизистой оболочкой двенадцатиперстной кишки.При поступлении из
желудка кислого содержимого стимулируется образование секретина(под
влиянием соляной кислоты и других химических раздражителей).Он поступает с кровотоком в поджелудочную железу
аденилатциклазную систему стимулирует секрецию ,богатогоска бикарбонатами и с большим содержанием воды.
В ответ на поступление в двенадцатиперстную кишку жирной пищи клетками слизистой оболочкой вырабатывается холецистокинин,который кровью доставляется в поджелудочную железу и стимулирует выработку сока, богатого ферментами (поэтому его раньше называли панкреозимин).
Он также вызывает сокращение гладких мышц желчного пузыря
усиливает двигательную функцию кишечника.
2. Трансаминирование аминокислот: химизм, значение. Характери-стика трансаминаз. Непрямое дезаминирование аминокислот.
![]()

 Значение
процесса переаминирования:
Значение
процесса переаминирования:
1)Путь синтеза в организме заменимых аминокислот.
2)Первый этап непрямого дезаминирования аминокислот.
3)Осуществление взаимосвязи аминокислот, углеводов и липидов
 В
тканях активно дезаминируется лишь
глутаминовая кислота. Изучение азотистого
обмена, активности ферментов привело
к мысли, что дезаминирование большей
части аминокислот идет непрямым пу-тем.
Вначале аминокислоты вступают в
переаминирование с кетокис-
В
тканях активно дезаминируется лишь
глутаминовая кислота. Изучение азотистого
обмена, активности ферментов привело
к мысли, что дезаминирование большей
части аминокислот идет непрямым пу-тем.
Вначале аминокислоты вступают в
переаминирование с кетокис-
лотами: ПВК, ЩУК или a-кетоглутаровой. Образовавшиеся АЛА и АСП вновь вступают в переаминирование сa-кетоглутаровой кисло-той при участии специфических ферментов: аланинаминотрансферазы (АлАТ) и аспартат-аминотрансферазы (АсАТ).
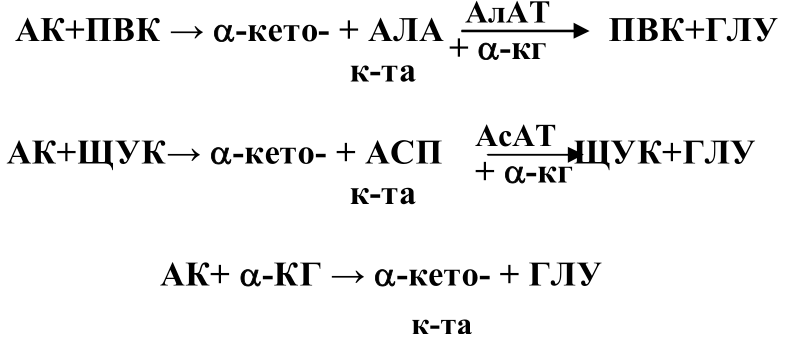

3. Окислительное дезаминирование аминокислот: химизм, характери-стика ферментов. Восстановительное аминирование альфакетоглу-тарата, значение.
Дезаминирование аминокислот.
У животных, растений и большинства бактерий дезаминирование происходит окислительным путем. Процесс идет с участием ферментов оксидаз.Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы.
L-оксидазы имеют простетическую группу ФМН,проявляют относительную и стереохимическую специфичность,мало активны
|
(т.к. опт. |
рН=10) – всего 10% |
активности, |
локализованы в |
| |||||||||||||||||||||||||||||||||||||||||||||||||
|
пероксисомах. |
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||||
|
|
|
D-оксидазы – сложные флавиновые ферменты с простетической |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
|
группой |
ФАД, проявляют относительную и |
стереохимическую |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
|
специфичность, высоко активны, находятся в микросомах. |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Химизм процесса: |
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||
|
R |
ФМН (ФАД) |
R |
+ Н2О |
R |
|
| |||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O + NН3 |
| |||||||||||||||||||||||||||||||||||||||
|
HC |
|
|
NH |
|
C |
|
NH |
|
C |
|
|
| |||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||
|
|
2 |
ФМН (ФАД)×Н2 |
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||||
|
|
COOH |
+ О2 |
|
COOH |
|
|
COOH |
| |||||||||||||||||||||||||||||||||||||||||||||
ФМН
(ФАД) + Н2О2
![]()
![]()
![]()
Аминокислоты наших белков и поступающих с пищей– L-ряда. D-аминокислоты могут поступить с некоторыми бактериями или всо-саться из кишечника, где под действием рацемаз микрофлоры может идти рацемизация L-аминокислот в D-изомеры. Из всех L-оксидаз следует выделить фермент глутаматдегидрогеназу, которая дезамини-рует глутаминовую кислоту и отличается тем, что:
1. Имеет кофермент НАД.
Обладает абсолютной специфичностью.
Высоко активна.
Локализована в митохондриях.
Регуляторный фермент: активируется АДФ, ингибируется АТФ, ГТФ, эстрогенами, тироксином.
При дезаминировании глутаминовой кислоты образуетсяa-кетоглутарат.
Вывод: таким образом, из всех нашихL-аминокислот активно прямо дезаминируется только глутаминовая кислота.
Восстановительное аминирование альфакетоглутарата.
В мышечной ткани этот процесс приводит к образо-ванию еще одной транспортной формы аммиака. При интенсивной
мышечной работе выделяющийся аммиак связываетсяa - с кетоглутаровой кислотой под действием глутаматдегидрогеназы. Образуется глутамат:
НАДФ×Н + Н+ ® НАДФ
NН3 + a-кг глутаматдегидрогеназа ГЛУ
![]()
Глутаминовая кислота вступает в переаминирование с пируватом, образующимся при интенсивной мышечной работе в результате распада гликогена или глюкозы. Образующийся аланин является
транспортной формой аммиака, доставляемой кровью в печень, где он вступает в переаминирование aс-кетоглутаратом, в результате чего получаются пируват и глутамат. Глутаминовая кислота через аспартат (пе-реаминирование со щавелевоуксусной кислотой)включает свою NН2-группу в мочевину. Пируват используется в глюконеогенезе для синтеза глюкозы, которая поставляется печенью мышцам. Этот механизм имеет важной значение для выведения аммиака из мышечной ткани и получил название глюкозо-аланинового цикла.
