
- •Правило Клечковского
- •Билет №11 Химическая связь и строение молекул.
- •Билет №13-14 Кратность связи. Сигма и пи связи, схемы перекрывания ао и прочность связей. Полярные связи и мол-лы.
- •Билет №15 Энергетические диаграммы обр. Молекул n2 и о2. Кратность связи и магнитные св-ва.
- •Билет №16 Ионная связь и её св-ва. Строение ионных кристаллов типа СsCl , NaCl , ZnS (сфалерит) и CaF2 (флюорит)
- •Свойства ZnS (сфалерит)
- •Билет №17 Металлическая связь и её св-ва.Кристаллические структуры металлов типа вольфрама, меди и магния. Координационные числа и плотность упаковки атомов.
- •Билет №19 Агрегатные состояния вещества и их характеристика. Плазма. Стекла и аморфные вещества. Понятие о ближнем и дальнем порядках.
- •Формы плазмы
- •Билет №20 Энергетический (тепловой) эффект изохорного и изобарного химических процессов. Стандартная энтальпия образования химического соединения. Закон Гесса и следствие из него.
- •Билет №23 Направление химической реакции. Понятие о свободной энергии Гиббса и её изменении как движущей силы изобарного процесса. Стандартное изменение энергии Гиббса при хим. Реакции.
- •Билет №24 Скорость гомогенной реакции. Средняя и истинная скорость реакции. Закон действия масс. Константа скорости реакции. Понятие о молекулярности и порядке реакции.
- •Порядок химической реакции
- •Билет №27 Катализаторы химических реакций. Представление о механизме катализа. Специфичность катализа. Примеры и роль каталитических процессов при химической переработке древесного сырья.
- •Билет №28 Растворы. Процессы при образовании растворов. Идеальные и реальные растворы. Гидраты и сольваты.
- •Билет №30 Растворимость газов, жидкостей и твердых веществ в жидкостях. Закон Генри. Ненасыщенные, насыщенные и перенасыщенные растворы.
- •Растворение как физико-химический процес
- •Растворимость
- •Растворы неэлектролитов. Понятие об осмосе и осмотическом давлении. Закон Вант-Гоффа. Изотонические растворы. Роль осмоса в жизни растений.
- •Билет №32 Давление насыщенного пара растворителя над раствором нелетучего растворённого вещества. Закон Рауля. Температура замерзания и кипения растворов (влияние концентрации)
- •Билет №33 Растворы электролитов. Сильные и слабые электролиты. Связь кажущейся степени диссоциации и изотоническим коэффициентом(см. Конспект). Понятие об активности и ионной силе раствора.
- •Билет №34 Обменные реакции между ионами. Молекулярные и ионные уравнения реакций. Условия необратимости ионных реакций.
- •Билет №35 Степень и константа диссоциации слабого электролита. Закон разбавления Оствальда. Ступенчатая диссоциация электролита. Влияние общих ионов на диссоциацию слабых электролитов.
- •Вывод значения pH
- •Билет №37 Растворимость малорастворимых твердых электролитов в воде. Произведение растворимости (пр). Влияние общих ионов на растворимость. Амфотерные гидроксиды и оксиды.
- •Билет №38 Гидролиз солей по катиону, аниону, катиону и аниону. Ступенчатый гидролиз. Необратимый совместный гидролиз солей.
Порядок химической реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
Кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение:
![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
![]()
Период полупревращения:
![]()
Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]()
или
![]()
В первом случае скорость реакции определяется уравнением
![]()
Линейная форма уравнения:
![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
![]()
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Период полупревращения (для случая равных начальных концентраций!):
![]()
Билет №25
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Понятие об активных частицах и энергии активации. Уравнение Аррениуса.
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
Различают
среднюю скорость ![]()
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак ( - ) – что вещество расходуется в ходе реакции.
Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от температуры. Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза:
![]() (3.9)
(3.9)
где![]() -
скорости реакции при Т1
и Т2;
γ – термический коэффициент скорости
химической реакции
-
скорости реакции при Т1
и Т2;
γ – термический коэффициент скорости
химической реакции ![]()
Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений. Только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы - активными молекулами с большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовались.

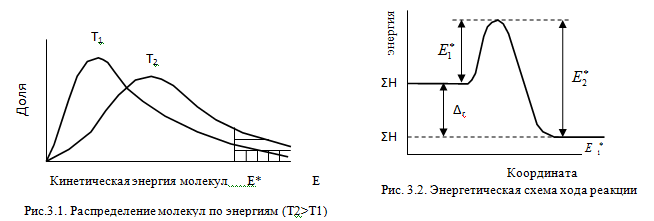
Изменение
энергии в ходе химической реакции
показано схемой процесса активации
(рис.3.2). По оси ординат отложена
потенциальная энергия системы. Абсцисса
- координата реакции или реакционного
пути. В процессе химического превращения
переход системы из начального состояния
с энергией ΣНi в конечное состояние с
ΣНf происходит через энергетический
барьер ![]() .
.
Энергия
активации (Е*)
-
это энергия, необходимая для перевода
в состояние активированного комплекса
1 моль реагирующих веществ. Разность
ΣНf - ΣНi составляет тепловой эффект
реакции (ΔrH). Для обратной реакции
тепловой эффект будет иметь ту же
величину, но противоположный знак. Для
обратной реакции энергия активации
составит величину. ![]()
Зависимость
константы скорости химической реакции
от температуры описывается уравнением
Аррениуса: ![]() (3.10)
(3.10)
где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ; Е* - энергия активации; R – универсальная газовая постоянная; Т – температура , К. Константа скорости, а следовательно и скорость химической реакции экспоненциально растет с увеличением температуры.
Энергия активации:
|
|
|
|
Уравне́ние
Арре́ниуса
устанавливает зависимость константы
скорости химической
реакции
![]() оттемпературы
оттемпературы
![]() .
.
Согласно
простой модели столкновений химическая
реакция между двумя исходными веществами
может происходить только в результате
столкновения молекул
этих веществ. Но не каждое столкновение
ведёт к химической реакции. Необходимо
преодолеть определённый энергетический
барьер, чтобы молекулы начали друг с
другом реагировать. То есть молекулы
должны обладать некой минимальной
энергией (энергия
активации
![]() ),
чтобы этот барьер преодолеть. Израспределения
Больцмана
для кинетической энергии молекул
известно, что число молекул, обладающих
энергией
),
чтобы этот барьер преодолеть. Израспределения
Больцмана
для кинетической энергии молекул
известно, что число молекул, обладающих
энергией
![]() ,
пропорционально
,
пропорционально![]() .
В результате скорость химической
реакции представляется уравнением,
которое было получено шведским химикомСванте
Аррениусом
из термодинамических соображений:
.
В результате скорость химической
реакции представляется уравнением,
которое было получено шведским химикомСванте
Аррениусом
из термодинамических соображений:
![]()
Здесь
![]() характеризует
частоту столкновений реагирующих
молекул,
характеризует
частоту столкновений реагирующих
молекул,![]() —универсальная
газовая постоянная.
—универсальная
газовая постоянная.
В
рамках теории активных соударений
![]() зависит
от температуры, но эта зависимость
достаточно медленная:
зависит
от температуры, но эта зависимость
достаточно медленная:
![]()
Оценки
этого параметра показывают, что изменение
температуры в диапазоне от 200 °C до
300 °C приводит к изменению частоты
столкновений
![]() на
10 %.
на
10 %.
В
рамках теории активированного комплекса
получаются другие зависимости
![]() от
температуры, но во всех случаях более
слабые, чем экспонента.
от
температуры, но во всех случаях более
слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Билет №26
Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия. Особенность гетерогенных равновесий. Смещение истинного химического равновесия. Принцип Ле Шателье и примеры его применения.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO 3 = 2KCl + 3O 2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
![]() ,
,
∆H = -46,2 кДж / моль
В технике обратимые реакции, как правило, невыгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми.
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа, например
ВаСl2 + Н 2SО 4 = ВаSО4↓ + 2НСl
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Mg + 1/2 О2 = МgО, ∆H = -602,5 кДж / моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка.
Обратимые реакции не доходят до конца и заканчиваются установлением химическою равновесия. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно,
химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. И поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ - как исходных, так и образующихся - остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например [Н2], [N2], [NH3], тогда как неравновесные концентрации обозначают так:
CH2, CN2, CNH3.
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ - и давление. При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции. Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования.
Конста́нта равнове́сия — величина, определяющая для данной химической реакциисоотношение между термодинамическимиактивностями(либо, в зависимости от условий протекания реакции,парциальными давлениями,концентрациямиилифугитивностями) исходных веществ и продуктов в состояниихимического равновесия(в соответствии сзаконом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле[1]:
![]()
где νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры [2].
Константа равновесия реакций в гетерогенных системах
Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением:
![]()
где fi — фугитивность компонентов газовой фазы, а ak — активность компонентов конденсированной фазы.
Если конденсированные фазы (твёрдые или жидкие) представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия (то есть в левую часть выражения выше). Условно можно принять их равными единице и, таким образом, исключить из выражения.
Например, для реакции твёрдофазного восстановления оксида железа:
FeOт + COг = Feт + CO2г
константа равновесия (при условии, что газовая фаза идеальна) имеет вид:
![]()
Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы - температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении - уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии.
Направление сдвига химического равновесия определяется принципом Ле-Шателье: если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в том направлении, которое ослабит эффект внешнего воздействия.
Влияние температуры на состояние равновесия различно для эндотермических (DН° > 0) и экзотермических (DН°< 0) реакций. В соответствии с принципом Ле-Шателье изменение температуры смещает направление этих реакций (показано стрелкой), тем самым уменьшая эффект внешнего воздействия на систему


