
Замараев - часть 1
.pdf
Это равенство справедливо, если CB × V* << 1, т. е. когда можно пренебречь попаданием в объем V* одновременно двух и более частиц B по сравнению с вероятностью попада- ния только одной частицы. В этом случае можно считать, что PA+B совпадает с вероятностью найти хотя бы одну частицу B в объеме V* рядом с частицей A.
Концентрация таких пар частиц:
CA+B(t) = CA(t) × PA+B(t) = CA(t) × CB(t) × V*.
Реакцию между находящимися в контакте частицами A и B
можно рассматривать как мономолекулярное превращение комплекса (A + B). Закон действующих масс применительно к
этому комплексу имеет вид
dCA +B(t) = -k1 ×CA+B(t) . dt
Учитывая, что A и B гибнут, только если они находятся в ком- плексе, получаем
|
|
|
dCA (t) |
= |
dCB |
(t) |
= |
dCA+B (t) |
|
= - k1 |
×CA+B (t) . |
|
|||||||||
|
|
|
|
|
dt |
|
|
dt |
|
dt |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Так как CA+B(t) = CA(t) × CB(t) × V*, то |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
dCA (t) |
= |
dCB(t) |
= - k1 × V * ×CA (t)× CB(t) |
, |
|
|||||||||||
|
|
|
|
|
dt |
|
|
dt |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
dCA (t) |
|
= |
|
|
dCB (t) |
|
= - k2 × CA (t)× CB (t) |
, |
(2.2) |
||||||||||
|
|
|
|
|
dt |
|
|
dt |
|
|
|
||||||||||
где k2 = k1 × V * .
Это – закон действующих масс для бимолекулярной реак- ции в дифференциальной форме. Он имеет вид кинетическо- го уравнения второго порядка. Размерность константы скоро-
сти [k2] = [k1 × l3] = [с–1 × см3].
в) Тримолекулярные реакции
Рассмотрим тримолекулярную реакцию
A + B + С ¾® X
в системе с V = const.
18
Будем следить за частицей A.
Вероятность PA( t) превращения A за время t равняется произведению вероятностей двух независимых событий:
1)все три частицы A, B и C находятся рядом внутри эф- фективного реакционного объема V* (вероятность PA+B+C);
2)тройка находящихся рядом частиц A + B + C реагирует
(вероятность PA( t)).
Считая попадание частиц B и С в объем V* рядом с A не- зависимыми событиями, находим вероятность того, что в объеме вокруг A находится по одной частице B и C:
PA+B+C = CB × V* × CC × V*
(при CB × V*, CC × V* << 1).
Тогда концентрация таких троек частиц
CA+B+C(t) = CA × CB × CC × (V*)2 .
Рассматривая реакцию в комплексе (A + B + C) как моно- молекулярную, можно записать закон действующих масс для комплекса:
dCA+B+C(t) |
= - k1 |
× CA+B+C(t). |
|
dt |
|||
|
|
Учитывая, что A, B и C гибнут, только если они находятся в комплексе, получаем
dCA (t) |
= |
dCB (t) |
= |
dCC (t) |
= |
dCA+B+C (t) |
= -k |
1 |
×(V*)2 |
× C |
A |
× C |
×C |
C |
|||||||||
|
|
|
|
|
|||||||||||||||||||
dt |
|
dt |
|
|
|
|
dt |
|
|
dt |
|
|
|
|
|
B |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dCA |
(t) |
= |
dCB (t) |
= |
dCC |
(t) |
= -k3 |
× CA × CB |
×CC |
, |
(2.3) |
|||||||||
|
|
|
dt |
|
|
dt |
dt |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где k3 = k1 × (V*)2.
Это – закон действующих масс для тримолекулярной реак- ции в дифференциальной форме. Он имеет вид кинетическо- го уравнения третьего порядка.
Размерность константы скорости [k3] =[k1 ×V*2]= [k1 × l6][с–1 × см6].
19
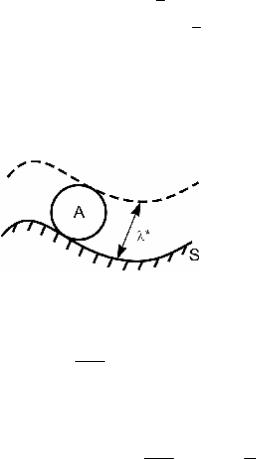
2.1.2. Закон действующих масс для реакций на поверхности твердого тела
Такие реакции лежат в основе гетерогенного катализа.
а) Взаимодействие молекул газа с однородной поверхностью
Рассмотрим взаимодействие частиц A с некоторой одно- родной поверхностью s в системе с постоянным объемом V:
A + s ¾® X .
Этот процесс можно рассматривать как состоящих из двух независимых событий:
1)попадание A в объем V* = S × λ* вблизи поверхности, где λ* – эффективная толщина реакционного слоя, S – площадь поверхности (рис. 2.2);
2)реакция A с поверхностью внутри реакционного объема.
Рис. 2.2. Эффективный объем V* для
реакции на поверхности
Формально данная реакция аналогична рассмотренной выше бимолекулярной реакции, и закон действующих масс
для нее можно записать в виде
dCdtA = - k1 × V * ×CA ×CS = - k1 ×S × l * ×CA ×CS ,
где вместо концентрации вещества B стоит концентрация CS. Мы рассматриваем всю поверхность как одну частицу, по-
этому CS = 1/V и
dCdtA = -k1 × l * × SV ×CA ,
или
20

dCA |
= - kS × |
S |
×CA . |
(2.4) |
dt |
|
V |
|
|
Константа скорости
kS = k1 × l *
имеет размерность
[kS] = [t–1 × l] = [с–1 × см].
Таким образом, скорость рассматриваемой гетерогенной реакции пропорциональна отношению S/V. Наличие множи- теля S/V в выражении (2.4) для CA отражает, во-первых, тот факт, что гибель A идет только на поверхности, поэтому ее скорость пропорциональна S. Кроме того, чем больше объем системы V, тем в меньшей мере гибель A на поверхности скажется на концентрации A в объеме. Поэтому скорость об- ратно пропорциональна V.
б) Бимолекулярная реакция между молекулами газа и адсорбированными молекулами
Рассмотрим реакцию
A + BS ¾® X
между молекулами A, находящимися в газовой фазе, и моле- кулами B, адсорбированными на поверхности. Данную реак- цию можно рассматривать как реакцию частиц A с однород- ной поверхностью площадью SB:
SB = qB × S,
где S – полная площадь поверхности, а θB – доля поверхности, занятая частицами BS. Тогда уравнение (2.4) принимает вид
dCA |
= - k |
|
× |
S |
×C |
|
× q . |
(2.5) |
dt |
|
S |
|
V |
|
A |
B |
|
Выведем теперь уравнение для ddtqB .
Для этого обозначим через V* = σ* × λ* реакционный объем вокруг частицы BS. Здесь σ* – площадь поверхности, зани-
21
маемая одной частицей BS, а λ* имеет тот же смысл, что в пункте «а» данного параграфа.
N |
= |
S |
|
|
– число центров адсорбции для молекул BS, а |
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||
o |
|
s * |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
N × q |
= q |
× |
= N |
|
– число частиц BS. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
o B |
|
|
B |
|
|
s * |
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Очевидно, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dNA |
|
|
|
|
dN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
BS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dC |
A |
= |
|
1 |
× |
dNB |
S |
|
= |
1 |
× |
|
S |
|
|
× |
dq |
B |
|
, |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
dt |
|
V |
|
dt |
|
|
|
V |
s * |
|
|
dt |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
dqB |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
= |
V |
× s * × |
dCA |
= – |
|
V |
|
× s * ×k |
|
|
× |
|
S |
×C |
|
× q = |
|
|
|||||||||||||||||||||
|
|
|
|
|
S |
|
|
S |
|
|
|
V |
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
dt |
|
|
|
|
dt |
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
A |
B |
|
|
||||||||||||||
= - k |
S |
× s * ×C |
A |
× q = - k |
1 |
× l * ×s * ×C |
A |
|
× q = - k × V * × C |
A |
× q . |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
123 |
B |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k2 |
|
|
|
Итак, закон действующих масс для рассматриваемой сис-
темы имеет вид |
|
|
|
|
|
|
|
|
|
|
|
|
ì dq |
|
|
|
|
|
|
|
|
||
|
ï |
B |
= – k2 ×CA × qB |
, |
|||||||
|
dt |
||||||||||
|
ï |
|
|
|
|
|
|
|
(2.6) |
||
|
í |
|
|
|
|
|
|
|
|
||
|
ï |
dCA |
= – k |
|
× |
S |
× C |
|
× q . |
||
|
ï |
|
S |
|
A |
||||||
|
dt |
|
|
|
V |
B |
|||||
|
î |
|
|
|
|
|
|
||||
Как и ранее, размерность [k2] = [с–1 × см3]. |
|||||||||||
Величину q = |
NBS |
|
часто называют покрытием поверхно- |
||||||||
|
|||||||||||
B |
No |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
сти частицами BS. θB изменяется в интервале 0 £ θB £ 1 .
22
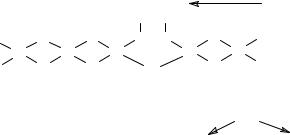
в) Взаимодействие молекул газа с неоднородной поверхностью
Пусть поверхность является неоднородной и состоит из n различных участков, каждый из которых однороден.
Пример. Поверхность катализатора Pt/SiO2 содержит уча- стки четырех типов (рис. 2.3), т. е. n = 4:
1)атомы O поверхности SiO2;
2)группы OH поверхности SiO2 (результат гидролиза по- верхности);
3)Pto – платина в состоянии, близком к металлической Pt;
4)Ptδ+ – платина в состоянии с дефицитом электронной плотности.
|
|
|
|
Участок 2 |
|
Результат гидролиза |
|
Участок 1 |
|
|
H |
H |
|
||
|
|
|
|
||||
|
|
|
|
|
|
||
Si |
O Si |
O |
Si |
O |
O |
Si |
O Si |
|
O |
O |
|
O |
|
|
O |
/ / / / |
....../ / / / / / / |
/ / / / / / / / / |
/ / / / / / / / / |
|||
|
|
Pto |
|
Ptδ+ |
|
|
|
|
|
oooooooo |
|
o |
o |
|
|
SiO2 |
SiO2 |
|
|
SiO2 |
|
Участок 3 |
Участок 4 |
|
|||
Рис. 2.3. Различные участки поверхности катализатора Pt/SiO2
В этом случае закон действующих масс надо записать по-
рознь для каждого из однородных участков
|
|
|
æ dC |
ö |
= - kS × |
S |
i × CA . |
|
||
|
|
|
ç |
|
A |
÷ |
|
(2.7) |
||
|
|
|
|
|
|
|||||
|
|
|
è |
dt øi |
i |
V |
|
|||
æ dC |
A |
ö |
|
|
|
|
|
|
|
|
Здесь ç |
|
÷ – скорость гибели A на i-м участке. |
|
|||||||
dt |
|
|||||||||
è |
øi |
|
|
|
|
|
|
|
||
23
Учитывая независимость событий гибели на различных участках, для полной скорости гибели A получим
dC |
A |
n |
æ dC |
A |
ö |
æ |
1 |
n |
ö |
|
|
|
= åç |
|
÷ |
ç |
|
× å kSi |
÷ |
×CA . |
|||
dt |
dt |
= – ç |
V |
× Si ÷ |
|||||||
i=1 |
è |
øi |
è |
i=1 |
ø |
|
|||||
|
|
|
|
|
|
|
1442443 |
|
|||
kэф
Вновь получим закон действующих масс с эффективной кон-
стантой скорости
|
1 |
n |
|
kэф = |
× å kSi ×Si . |
||
V |
|||
|
i=1 |
Размерность [kэф] = [c–1], [kSi ] = [c–1 × см].
г) Бимолекулярная реакция в адсорбированном слое
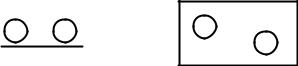
Рассмотрим бимолекулярную реакцию AS + BS ® X между двумя частицами A и B, адсорбированными на поверхности твердого тела (рис. 2.4).
As Bs
AB
// / / / / / / / / /
As Bs
A
B
Вид сбоку Вид сверху
Рис. 2.4. Схематическое изображение адсорбированных молекул AS и BS
В этом случае надо повторить вывод закона действующих масс для бимолекулярной реакции в газах с той лишь разни- цей, что вместо эффективного реакционного объема V* сле- дует ввести эффективную реакционную площадку σ*, а вме- сто объемных концентраций реагирующих веществ (т. е. чис- ла частиц, отнесенного к единице объема) – их поверхност- ные концентрации (т. е. число частиц, отнесенное к единице поверхности).
24

Получим |
|
|
|
|
|
|
|
|
|
|
|
||
|
dCAS |
= |
dCBS |
= - k |
1 |
× s * × C |
× C |
BS |
= - k |
2S |
× C |
AS |
× C . (2.8) |
|
|
|
|||||||||||
|
dt |
dt |
|
AS |
|
|
BS |
||||||
|
|
|
|
|
|
|
|
|
|
||||
Концентрации CAS и CBS имеют размерность
[CAS ] = [CBS ] = [см–2] .
Константа скорости k2S имеет размерность
[k2S] = [k1 × s*] = [c–1 × см2] .
Другая форма уравнения (2.8). Обозначим через Co = NSo
поверхностную концентрацию центров адсорбции для моле-
–2 |
|
|
|
|
|
CA |
S |
||
кул A и B. Размерность [Co] = [см ]). Обозначим qA = |
|
|
|
||||||
Co |
|||||||||
|
|
|
|
|
|
||||
– покрытие поверхности частицами AS, q |
|
= |
CB |
S |
– покрытие |
||||
B |
Co |
||||||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
поверхности частицами BS.
Преобразуем уравнение (2.8) из уравнения для Ci в урав-
нение для θi. Для этого подставим в него |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
CAS |
= qA × Co , |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
CBS |
= qB × Co . |
|
|
|
|
|
|
|||||
Получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
× |
dqA |
= C × |
dqB |
= – k |
|
× C2 |
× q |
|
|
× q |
|
||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
o |
|
dt |
o |
dt |
|
|
2S |
o |
|
A |
B |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
dqA |
= |
dqB |
= – k2θ × qA × qB |
|
|
, |
(2.9) |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
dt |
|
|
dt |
|
|
|
|
|
|
|
|
|
|
где k2θ = k2S ×Co . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Размерность [k2θ] = [k2S × Co] = [с–1 × см2 × |
см–2] = [c–1]. |
|
|||||||||||||||||
25

2.1.3. Интегральная форма закона действующих масс
а) Мономолекулярные реакции
Интегрируя уравнение (2.1) в пределах по концентрации от Co до C(t) и по времени от 0 до t, получаем
C(t) = Co × e−k1t , |
(2.10) |
где Co – начальная концентрация вещества A, а k имеет раз- мерность с–1, [k1] = [с–1].
Физический смысл константы k1 легко понять, вычислив среднее время жизни частицы A:
|
∞ |
|
|
∞ |
∞ |
|
∞ |
|
|
|
||||||||
|
|
|
|
|
|
|||||||||||||
tA |
= òt × |
dP(t) |
|
|
|
|
∞ |
|
|
|
|
|
1 |
, |
||||
× dt = òt × dP(t) = - t × P |
0 |
+ òP × dt = òP × dt = |
||||||||||||||||
|
k |
1 |
||||||||||||||||
|
o |
dt |
o |
0 |
0 |
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||||
(P(t) = e−k1t ).
Следовательно, 1/k1 – это среднее время жизни частиц
A. Величину 1/k1 для мономолекулярных реакций также часто
называют средним временем превращения, характеристическим временем реакции или временем релаксации.
б) Бимолекулярные реакции
Чтобы проинтегрировать уравнение (2.2), обозначим на- чальные концентрации веществ A и B через CoA = a , CBo = b и
введем глубину превращения
x = a – CA = b – CB.
Тогда уравнение (2.2) примет вид
dxdt = k2 ×(a - x)×(b - x) ,
или
k2dt = |
dx |
. |
|
(a - x)×(b - x) |
|||
|
|
Рассмотрим случай a ¹ b.
Примем для определенности, что a > b, тогда
26

|
|
|
|
|
|
|
æ |
x ö |
|
||
|
|
x |
dx |
|
1 |
|
ç1- |
|
÷ |
|
|
|
|
|
|
|
|
||||||
k2 |
× t = |
|
= |
×ln |
è |
a ø |
. |
(2.11) |
|||
ò (a - x)×(b - x) |
(a - b) |
æ |
|
||||||||
|
|
|
|
x ö |
|
||||||
|
|
o |
|
|
|
|
ç1- |
|
÷ |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
è |
b ø |
|
||
Обозначив k2 ×(a - b) = k′2 , получим
|
x = a ×b × |
ek′2t -1 |
|
||
a × ek′2t - b |
|||||
или |
|
||||
|
|
|
|||
CA = |
a - b |
× a , |
CB = |
||
a - b × ek′2t |
|||||
, |
|
a - b |
×b . |
a × ek′2t - b |
В этом случае величина
t = 1
k2 × (a - b)
не имеет такого простого смысла, как для мономолекулярных реакций.
Однако τ приобретает простой смысл, если a >> b. В этом случае концентрацию CA в уравнении (2.2) можно считать по- стоянной:
CA(t) » a,
и уравнение (2.2) приобретает вид кинетического уравнения
первого порядка с константой скорости k′2 = k2 × a
и характеристическим временем превращения вещества B tB = k21× a .
Зависимость CB от времени имеет вид
CB(t) = b × e−k2at .
Аналогичным образом, при b >> a получим CB = b – константа,
CA = a × e−k2bt
27
