
Замараев - часть 1
.pdf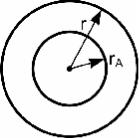
Здесь J – вектор плотности потока частиц, т. е. количество вещества, диффундирующего в 1 с через 1 см2 поверхности,
перпендикулярной направлению J .
Второй закон Фика (уравнение непрерывности):
¶C |
r |
= -divJ = D ×Ñ2 ×C , |
|
¶t |
|
¶C ¶t
|
|
|
ß |
|
|
|
|
|
|
æ |
¶2C |
+ |
¶2C |
+ |
¶2C ö |
||||
= D ×ç |
|
2 |
|
2 |
|
2 |
÷ . |
||
ç |
¶x |
|
¶y |
|
¶z |
÷ |
|||
è |
|
|
|
|
|
ø |
|||
Рассмотрим бимолекулярную реакцию в изотропной жид-
кости
A + B ¾® X.
Столкновения A c B осуществляются путем диффузии. Рассмотрим поток частиц B в направлении частиц A. В изо-
тропной жидкости этот поток будет сферически симметрич- ным, т. е. распределение концентраций B относительно A бу- дет только функцией расстояния r между ними.
Очертим вокруг частицы A сферу радиуса r (рис. 2.8): Если концентрация A равна
CA, то в единице объема сум-
марная поверхность сфер радиуса r, окружающих частицы
Рис. 2.8. Сферы радиуса r и rA вокруг частицы A, rA – собственный радиус час- тицы A
A, равна 4pr2CA.
В отсутствие реакции суммар- ный поток через эту поверх- ность при любом r равен нулю, так как диффузия частиц B в
равной мере происходит как в направлении A, так и в проти- воположном направлении.
Если же при встречах A с B
возможна реакция со скоростью
48

W, то возникает результирующий поток частиц B в сторону A, так как поток в обратном направлении будет частично подав- лен из-за гибели B.
Очевидно, что суммарный поток f, т. е. число частиц B, пе- ресекающих любую сферу, окружающую A, равен скорости
реакции
f= 4pr2CAJ = –W .
Вэтом выражении J – плотность потока (отрицательная, так как поток направлен к началу координат).
Согласно первому закону Фика,
J = - (DA + DB )× dCB(r) , dr
где CB(r) – локальная концентрация B вблизи A как функция расстояния до центра A, а DA и DB – коэффициенты диффу- зии A и B.
Подставляя это выражение для J в предыдущее уравнение для f и обозначая DA + DB = D, получаем
2 |
|
|
dCB(r) |
|
|
|
||
–4pr × CA × D |
|
|
|
= f |
|
|||
|
dr |
|
||||||
|
|
ß |
|
|
|
|
||
|
dCB(r) |
|
f |
|
|
|
||
|
= – |
|
|
. |
(2.19) |
|||
|
dr |
|
4πr2 ×D ×CA |
|||||
При r ® ¥ CB(r) ® CB, |
где CB – обычная средняя концен- |
|||||||
трация частиц B.
Интегрируя уравнение (2.19) в пределах от r = r до r = ¥ с учетом этого условия, получаем
CB - CB(r) = – 4pD×fCA ×r .
Саму реакцию можно рассматривать как бимолекулярный процесс, описываемый законом действующих масс
W = k2 × CA × CB(r = rA + rB),
49
где rA и rB – радиусы частиц A и B, CB (r = rA + rB) – значение
CB(r) при r = rA + rB.
Учтем, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
B |
(r = r + r ) = C |
B |
- |
k2CACB (r = rA + rB ) |
, |
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
A B |
|
|
|
4pD ×(rA |
+ rB )× CA |
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
ß |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
é |
|
|
|
|
|
k2 |
|
|
|
ù |
|
|
|
|
|
|||
CB (r = rA + rB )× ê1+ |
|
|
|
|
|
|
|
|
|
|
ú |
= CB , |
||||||||
|
4pD ×(rA |
|
|
|
|
|||||||||||||||
|
|
ë |
|
|
+ rB )û |
|
|
|
|
|
||||||||||
|
|
|
|
|
ß |
|
|
CB |
|
|
|
|
|
|
|
|
||||
|
|
CB (r = rA + rB ) = |
|
|
|
|
|
|
|
|
|
, |
|
|
|
|||||
|
|
1+ |
|
|
k2 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
4pD ×(r |
A |
+ r |
) |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
ß |
|
|
|
|
|
k2CACB |
|
|
|
||||||
W = k2CACB (r = rA + rB ) = |
|
|
|
|
|
. (2.20) |
||||||||||||||
|
|
|
|
|
|
k2 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
1+ |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
4pD ×(r |
+ r ) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
B |
|
Мы вновь получили закон действующих масс |
||||||||||||||||||||
|
|
W = kэф × CA × CB, |
|
|
|
|
|
|
|
|
||||||||||
но с эффективной константой скорости |
|
|
|
|
|
|
|
|
||||||||||||
|
|
kэф = |
|
|
|
|
|
k2 |
|
|
|
, |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
k2 |
|
|
|
|
|
|
|
|
|
|||
|
|
1+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
4pD×(r + r |
) |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
A |
B |
|
|
|
|
|
|
|
|
||
т. е. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
kэф |
= |
|
k2kD |
, |
|
|
|
|
|
|
(2.21) |
||||||
|
|
|
k2 + kD |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где kD = 4pD × (rA + rB) – так называемая диффузионная кон-
станта скорости.
При быстрой диффузии, когда k2 << kD , W = k2 × CA × CB,
50

т. е. эффективная константа скорости равна истинной констан- те скорости k2. Скорость суммарного процесса диффузия +
реакция лимитируется собственно реакцией. Такой случай называется случаем кинетического контроля реакции.
При медленной диффузии, когда k2 >> kD, W = kD × CA × CB,
т. е. kэф = kD. Скорость процесса лимитируется диффузией.
Такой случай называется случаем диффузионного контроля реакции.
Выражение (2.21) можно переписать в виде
1 |
= |
1 |
+ |
1 |
. |
(2.22) |
kэф |
|
|
||||
|
k2 |
kD |
|
|||
1
Величина k2CA имеет физический смысл среднего време-
ни, необходимого для превращения частицы B, которая уже продиффундировала к частице A.
1
Величина kDCA имеет физический смысл среднего време-
ни, необходимого для диффузии частицы B к частице A.
Величина |
|
1 |
|
= |
1 |
|
+ |
|
1 |
|
имеет физический смысл |
||
k |
|
C |
|
k C |
|
k |
|
C |
|
||||
|
эф |
A |
|
A |
D |
A |
|||||||
|
|
|
|
2 |
|
|
|||||||
среднего времени жизни частицы B.
Для частиц сферической формы Di можно выразить через
уравнение Эйнштейна
D1 = |
kБ × T |
, |
6p × h ×r |
||
|
i |
|
где h – вязкость, T – температура, kБ – постоянная Больцма- на. Отсюда
|
2 |
|
k |
Б |
× T (r |
+ r )2 |
|||
kD = |
|
× |
|
|
|
A |
B |
. |
|
3 |
|
h |
|
|
|||||
|
|
|
|
rA × rB |
|||||
При rA = rB имеем
51

kD = |
8 |
× |
kБ × T |
. |
(2.23) |
3 |
|
||||
|
|
h |
|
||
Уравнение (2.23) весьма полезно для оценки kD в различ- ных ситуациях.
Например, для водных растворов при 300 К h = 10–2 пз и
k |
D |
» |
8 ×1,4 × |
10−16 × 300 |
см3 × с–1 |
» 10–11 см3 × с–1 » |
|
3 |
×10−2 |
||||||
|
|
|
|
» 6 × 109 л × моль–1 × с–1.
Аналогичным образом можно рассмотреть совместное протекание диффузии и реакции для процесса гибели частиц жидкости или газа на стенках реактора или любой другой твердой поверхности, например, поверхности катализатора. И
в этом случае эффективная константа скорости может быть представлена в виде уравнения (2.21):
kэф = k2 +× kD , k2 kD
где диффузионная константа скорости kD пропорциональна ко- эффициенту диффузии D:
kD = a × D.
Однако значение коэффициента a в этом выражении будет зависеть от геометрической формы поверхности и может от- личаться от значения a = 4p × (rA + rB), полученного для бимо- лекулярной реакции в жидкости.
2.3.2. Кинетическое описание простых систем (примеры)
а) Рекомбинация атомов
Рассмотрим реакцию рекомбинации атомов водорода в различных встречающихся на практике случаях.
Случай 1. Рекомбинация в жидкости или в объеме твер- дого тела при случайном начальном распределении.
52
Здесь мы имеем дело с обычной реакцией второго порядка,
|
· |
|
¾¾® H2 , |
|
|
|||
|
|
2 H |
|
|
||||
поэтому |
|
dC ∙ |
|
|
|
|
|
|
|
|
= - 2 k2эф × C2∙ |
|
|
||||
|
|
H |
|
|
|
|||
|
|
dt |
|
|
||||
|
|
|
|
H |
|
|
||
и |
|
|
|
|
|
|
|
|
C ∙ = |
Co |
|
, |
t1/2 = |
1 |
. |
||
1+ 2 k2эф × Co × t |
|
|||||||
H |
|
|
2 k2эф × Co |
|||||
Энергия, выделяющаяся при рекомбинации, тут же пере- дается соседним молекулам, которые всегда есть и в жидко- сти, и в твердом теле. Поэтому обратный процесс распада молекул H2 подавлен:
k2эф = |
k2 × kD |
. |
|
||
|
k2 + kD |
|
При h = 1 спз (H2O при 300 К) |
|
|
k2 » 10–10 c–1 см3, |
kD » 10–11 c–1 см3 . |
|
Следовательно, k2 >> kD и kэф » kD.
Мы приняли, что для рекомбинации атомов энергия акти- вации собственно реакции равна нулю, т. е. k2 = k20, где k20
– предэкспоненциальный множитель. В |
этом случае при |
h = 10–2 P k2эф = kD, так как k2 >> kD. |
рекомбинацию с |
Рассмотрим теперь активированную |
|
E = 3 ккал / моль. |
|
k2 = k2o × e–E/RT = 10–10 × e–3000/2 × 300 c–1 см3 =
=10–10 × e–5 = 10–10 – 5/2,3 » 10–12 c–1см3.
Вэтом случае k2 << kD и k2эф = k2 .
Как видим, диффузия может лимитировать скорость бимо- лекулярной реакции в жидкости только при очень малых Е.
53

Случай 2. Рекомбинация при парном распределении.
Такое распределение может возникнуть, например, при диссоциации молекул H2 на атомы (рис. 2.9):
а) в элементарной ячейке («клетке») жидкости или твердо- го тела;
б) на одном или соседних атомах поверхности твердого тела.
а 

 "Клетка" б
"Клетка" б
H H |
. . |
||||
|
|
|
|
||
|
|
|
Hs Hs |
||
|
|
|
|
|
|
|
|
/ / / / |
/ / / / / / / / / / / |
||
|
|
||||
|
|
|
|
|
|
∙
Рис. 2.9. Парное распределение атомов H в элементарной ячейке жидкости или твердого тела (а) и на поверхности твердого тела (б)
В этом случае для рекомбинации атомам не надо предва-
рительно сталкиваться и реакция идет как мономолекулярная реакция в паре:
dCdtH = 2 dCdtпар ,
dCпар = - k1Cпар ,
dt
CH = 2 Cпар = 2 C(парo) × e−k1t .
Это реакция первого порядка.
54

Случай 3. Рекомбинация при начальном расположении
∙
атомов H группами по n атомов.
|
|
|
dCлок |
= - 2k2эф × C2лок , |
|
|
n |
dt |
∙ |
где Cлок |
= |
– локальная концентрация атомов H . |
||
|
|
|
|
∙ |
Такое распределение атомов H возможно, например, в |
||||
треках, образующихся при низкотемпературном радиолизе застеклованных растворов кислот.
Если считать, что все n атомов в группе могут равноверо- ятно взаимодействовать друг с другом, то внутри группы
Vгр
Отсюда
C(o)
Cлок = 1+ 2 k лок× C(o) × t .
2эф лок
Таким же образом изменяется концентрация в других группах. Пусть C(локo) одинаковы для всех групп.
|
|
|
|
|
|
|
|
|
|
|
|
∙ |
|
|
|
|
Поскольку общее число атомов H |
|
|
|
|
||||||||||||
|
|
|
|
NH = åCлок × Vгр = Cлок × åVгр , |
|
|
||||||||||
то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
å |
V |
|
|
|
|
C(o) |
|
|
|
|
|
|
|
|
|
|
|
гр |
|
|
|
|
& |
|
, |
|
|
|
|
|
C∙ |
= Cлок × |
|
|
= |
|
|
|
H |
|
|
|
|||
|
|
|
1 |
|
|
|
|
|||||||||
|
|
H |
|
V |
|
|
+ 2 k2эф × C(o)лок × t |
|
|
|||||||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C∙ |
= |
NH |
|
, |
C(o)∙ |
= |
NH(o) |
|
, t1/2 = |
1 |
|
. |
||||
V |
V |
2 kэф × |
|
|||||||||||||
H |
|
|
H |
|
|
|
C(o)лок |
|||||||||
55

Случай 4. Рекомбинация в газах.
В этом случае реакция является тримолекулярной
∙∙
H + H + M ¾¾® H2 + M ,
поскольку в отсутствие M молекула H2, образующаяся при
двойных столкновениях
∙ ∙
H+ H ¾¾® H2,
имеет энергию, равную энергии ее диссоциации. Следова-
∙
тельно, она распадется обратно на атомы H за время поряд- ка характеристического времени одного колебания, т. е. за
t = 1n » 10−13 с.
Кинетическое уравнение для рассматриваемой тримолеку- лярной реакции:
dC∙
dtH = - 2 k3 ×CM × C2∙ .
H
∙
При этом роль M может играть либо третий атом H , либо лю- бая другая частица M1, имеющаяся в системе.
При CM1 >> CH имеем
dC∙
dtH = - 2 k3 × CM1 × C2∙ ,
H
где CM1 = const.
Тогда
C∙ |
= |
|
|
|
C(∙o) |
|
. |
|
|
|
H |
|
|||
|
+ 2 k |
|
× C |
|
|||
H |
1 |
3 |
× C(o) × t |
||||
|
|
|
|
M |
H |
||
|
|
|
|
|
1 |
|
|
Это – кинетическое уравнение второго порядка с эффек-
тивной константой скорости
56
kэф = 2 k3CM1 и t1/2 = |
|
|
1 |
|
. |
|
2 k |
3 |
× C |
M |
× C(o) |
||
|
|
|
H |
|||
|
|
|
|
1 |
|
|
Случай 5. Гибель на стенках реакционного сосуда.
Гибель по такому каналу является одним из механизмов обрыва цепей при цепных реакциях.
В рассматриваемом случае рекомбинация состоит из двух стадий:
∙ |
¾¾® HS |
|
|
|
|
|
|
|
|
|
H + s |
(более медленная стадия) |
|
||||||||
и |
|
|
|
|
|
|
|
|
|
|
2 HS ¾¾® H2 |
(существенно более быстрая стадия). |
|||||||||
Тогда |
скорость |
гибели |
определяется скоростью |
только |
||||||
|
|
|
|
|
|
|
|
|
∙ |
® ги- |
первой стадии, реакцию можно записать в виде H + s |
||||||||||
бель и |
|
|
|
|
|
|
|
|
|
|
|
|
|
dC∙ |
|
|
|
So |
|
|
|
|
|
|
H |
= - k |
|
× |
× C , |
|
||
|
|
|
|
|
|
|
||||
|
|
|
dt |
|
r |
|
V H |
|
||
где kr |
– эффективная константа скорости гибели, So – пло- |
||||
щадь поверхности. |
|
|
|
|
|
Отсюда |
|
|
|
|
|
|
C∙ = C(o)∙ × e−kr |
So |
t . |
||
|
|
V |
|||
|
H |
H |
|
|
|
При этом |
kS × kD |
|
|
|
|
|
kr = |
|
, |
|
|
|
kS + kD |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
∙ |
где kD |
– константа скорости диффузии атома H к стенке, |
||||
kS – константа скорости его реакции со стенкой.
Для газов коэффициент диффузии равен (с точностью до численного коэффициента порядка единицы)
D » n × l ,
57
