
- •Оглавление
- •Введение
- •Лабораторная работа 1 Основные классы неорганических соединений
- •Теоретическое введение
- •Химические свойства оксидов
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 2 Определение молярной массы эквивалентов цинка
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Давление насыщенного водяного пара при различных температурах
- •Примеры решения задач
- •3,5 Г/моль n2 – х
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 3 Определение теплоты реакции нейтрализации
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •После подстановки справочных данных из табл. Б. 1 получаем:
- •Таким образом, тепловой эффект реакции равен –853,8 кДж, а составляет –822,2 кДж/моль.
- •Подставляем в формулу справочные данные из табл. Б. 1 и получаем:
- •Используя справочные данные табл. Б. 1 получаем:
- •Решение. ВычисляемDh°х.Р.ИDs°х.Р.:
- •Задачи и упражнения для самостоятельного решения
- •При сгорании 1 л с2н4при нормальных условиях выделяется 59,06 кДж теплоты. Определить стандартную энтальпию образования этилена. (Ответ: 52,3 кДж/моль).
- •3.3. А). Сожжены с образованиемH2o (г)равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ:5,2).
- •Лабораторная работа 4 Скорость химической реакции
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Опыт 2. Зависимость скорости реакции от температуры
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 5 Катализ
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 6 Химическое равновесие
- •Теоретическое введение
- •Выполнение работы
- •Для опыта удобно воспользоваться реакцией
- •Опыт 2. Влияние изменения температуры на смещение равновесия
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 7 Определение концентрации раствора кислоты
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 8 Реакции в растворах электролитов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Сравнение химической активности кислот
- •Опыт 2. Реакции, идущие с образованием осадка
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 9 Гидролиз солей
- •Теоретическое введение
- •Выполнение работы
- •Опыт 2. Смещение равновесия гидролиза при разбавлении раствора
- •Опыт 3. Смещение равновесия гидролиза при изменении температуры
- •Опыт 4. Реакции обмена, сопровождаемые гидролизом
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 10 Коллоидные растворы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 11 Окислительно-восстановительные реакции
- •Теоретическое введение
- •2O−2 – 4ē → o20 ½3 − окисление
- •Выполнение работы Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция (групповой)
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 12 Коррозия металлов
- •Теоретическое введение
- •Выполнение работы Опыт 1. Влияние образования гальванической пары на процесс растворения металла в кислоте
- •Опыт 2. Роль защитной пленки в ослаблении коррозии
- •Примеры решения задач
- •Для первого электрода
- •Для второго электрода
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 13 Электролиз
- •Теоретическое введение
- •Выполнение работы Опыт 1. Электролиз раствора иодида калия
- •Опыт 2. Электролиз раствора сульфата натрия
- •Опыт 3. Электролиз раствора сульфата меди
- •Опыт 4. Электролиз с растворимым анодом
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 14 Химические свойства металлов
- •Теоретическое введение
- •Выполнение работы
- •Опыт 4. Действие щелочи на металлы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 15 Комплексные соединения
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 16
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 17 Жесткость воды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 18 Алюминий, олово, свинец
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 19 Металлы подгрупп меди и цинка
- •Теоретическое введение
- •Выполнение работы
- •Задачи для самостоятельного решения
- •Лабораторная работа 20 Хром
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 21 Марганец
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •21.3. Рассчитать молярную массу эквивалентов перманганата калия в реакции
- •Лабораторная работа 22 Железо, кобальт, никель
- •Теоретическое введение
- •Выполнение работы
- •Опыт 3. Получение и свойства гидроксида никеля (II)
- •Опыт 6. Получение комплексных соединений кобальта
- •Опыт 7. Получение комплексных соединений никеля
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 23 Галогены
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 24 Кислород. Пероксид водорода
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 25 Сера
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •25.13. Закончить уравнения реакций гидролиза в молекулярном и ионном виде:
- •Лабораторная работа 26 Азот
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 27 Углерод, кремний
- •Теоретическое введение
- •Выполнение работы
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 28 Углеводороды
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 29 Спирты, альдегиды, кетоны
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 30 Органические кислоты
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 31 Распознавание высокомолекуляных материалов
- •Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 32 Получение фенолоформальдегидных смол
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 33 Качественный анализ металлов
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 34 Качественные реакции на анионы
- •Теоретическое введение
- •Выполнение работы
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Лабораторная работа 35 Количественное определение железа в растворе его соли
- •Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Заключение
- •Библиографический список
- •Требования к оформлению отчета по лабораторной работе
- •ИрГту кафедра химии и пищевой технологии Отчет
- •Стандартные энтальпии образования ∆fН°298, энтропии s°298 и энергии Гиббса образования ∆fG°298 некоторых веществ при 298 к (25 °с)
- •Плотность раствора соляной кислоты при 15 °с
- •Растворимость некоторых солей и оснований в воде
- •Стандартные электродные потенциалы (jo) при 25 °с и электродные реакции для некоторых металлов
- •Периодическая система
- •Элементов д.И. Менделеева
Лабораторная работа 2 Определение молярной массы эквивалентов цинка
Цель работы: изучить понятия «эквивалент», «молярная масса эквивалентов» и закон эквивалентов.
Задание: провести реакцию взаимодействия цинка с соляной кислотой и определить объем выделившегося водорода. На основании полученных данных вычислить массу водорода и молярную массу эквивалентов цинка. Выполнить требования к результату работы, оформить отчет, решить задачу.
Теоретическое введение
Эквивалент (Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (½ H2SO4, ½ H2O). Эквивалент – безразмерная величина, состав которой выражают с помощью знаков и формул. Например,
Э (NaOH) = NaOH; Э (H2SO4) = ½ H2SO4; Э (MgCl2) = ½ MgCl2; Э (Са) = ½ Са.
Единицей количества вещества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моля эквивалентов называется молярной массой эквивалентов (Mэк) и выражается в г/моль.
При определении молярной массы эквивалентов необходимо исходить из конкретной реакции, в которой участвует данное вещество.
Молярная масса эквивалентов вещества В, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле
![]() ,
,
где МВ– молярная масса вещества В;nē– число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
Например, в реакции Mg0+ 2H+Cl=Mg+2Cl2+H20степень окисления магния изменяется от 0 до +2. Следовательно, магний теряет 2 электрона, т.е. одному электрону эквивалентна условная частица ½ атомаMg:
Э(Mg)
= ½Mg;Мэк
(Mg) =![]() = 12 г/моль.
= 12 г/моль.
У водорода степень окисления меняется от +1 до 0, а т.к. молекула водорода состоит из двух атомов, то число принятых электронов будет равно 2. Таким образом, одному электрону эквивалентна условная частица ½ молекулы Н2:
Э(Н2)
= ½ Н2 ;Мэк (Н2)
=![]() = 1 г/моль.
= 1 г/моль.
Закон эквивалентов: массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов:
![]() .
.
Выполнение работы
Определение молярной массы эквивалентов цинка проводится в приборе, изображенном на рисунке.
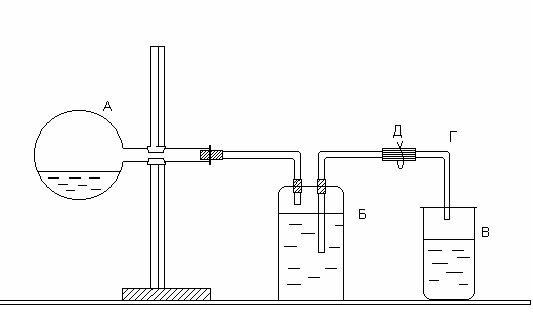
Рис. Прибор для определения молярной массы эквивалентов цинка
Прибор состоит из трех частей: колбы А, двугорлой склянки Вульфа Б и приемника В. Отверстия двугорлой склянки закрываются резиновыми пробками, через которые проходят стеклянные трубки: короткая, оканчивающаяся сразу под пробкой, и длинная, доходящая почти до дна склянки. Короткая стеклянная трубка соединяется резиновой трубкой с колбой А, а длинная − со стеклянной трубкой Г, опущенной в приемник В. Работу следует выполнять в следующем порядке. В колбу налить 10–15 мл соляной кислоты. Закрепить колбу в горизонтальном положении. Получить у преподавателя навеску цинка и поместить ее в сухое горло колбы. Закрыть колбу резиновой пробкой и проверить герметичность прибора. Для этого открыть зажим Д и с помощью резиновой груши вдуть воздух в прибор через стеклянную трубку Г. В приборе создается избыточное давление, вследствие чего вода из трубки Г вытекает. Когда давление внутри прибора станет равным атмосферному, вода из трубки перестанет течь. Закрыть зажим Д. Если вода из трубки Г не уходит, прибор герметичен. Воду из приемника вылить и поставить его под трубку Г.
Наклонить колбу так, чтобы навеска цинка упала в кислоту, и открыть зажим. Водород, выделившийся при взаимодействии металла с кислотой, вытесняет воду из склянки Б в приемник В. Когда весь металл растворится, закрыть зажим, осторожно вынуть из приемника трубку Г (следить, чтобы из нее не вылилась вода) и измерить мерным цилиндром объем воды в приемнике. Этот объем равен объему водорода, выделившегося при взаимодействии цинка с кислотой. Записать показания барометра и термометра.
Требования к результатам работы
Исходные данные и результаты расчетов занести в табл. 2.1.
Таблица 2.1
