
Литература от Абакумова ч1 / 0917183_820FF_lekcii_po_processam_i_apparatam_himicheskih_tehnologiy
.pdf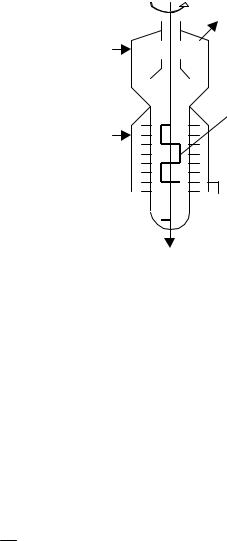
|
|
исходный |
вторичный |
раствор |
пар |
|
лопасти |
пар |
|

 к
к
упаренный раствор
Роторный выпарной аппарат Рис .4.34
2.2.2 Однокорпусное (однократное) выпаривание.
Процесс выпаривания непрерывный.
Материальный баланс по общему количеству продуктов:
|
|
|
(4.71) |
|
|
|
Lн |
Lк W |
кг |
|
|||
|
|
|
|
|
||
Здесь |
Lн,к расходы исходного и |
упаренного растворов, |
; |
|||
|
||||||
с
вторичного пара, кг .
с
Материальный баланс по нелетучему продукту:
W выход
Lн |
Xн Lк Xк |
(4.72) |
где |
Xн,к концентрация |
растворенного продукта в исходном и упаренном |
растворе, 1кг на 1кг продукта.
Искомые величины: L,W,Xк .
|
|
|
X |
н |
|
|
|
|
|||
Lк |
Lн |
|
|
|
|
|
|||||
Xк |
(4.73) |
||||||||||
|
|
|
|
||||||||
|
|
|
|
|
Xн |
|
|||||
|
|
|
|
|
|||||||
W Lн (1 |
) |
|
|||||||||
|
|
|
|||||||||
|
|
|
|
|
|
Xк |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Xк |
|
|
Lн Xн |
(4.74) |
|||||||
|
|
|
|
|
|||||||
Lн W
По двум исходным уравнениям три величины найти невозможно, поэтому одной из величин, например, Xк задаемся.
41
Тепловой баланс.
|
|
|
|
|
|
|
|
|
(4.75) |
||
D HГ |
LН HН |
LК HК |
W HВП |
D HГК QП QR |
|||||||
Здесь D расход греющего пара, |
кг |
; H энтальпия, |
Дж |
; QП потери теплоты в |
|||||||
|
|
||||||||||
|
|
|
|
Дж |
|
|
с |
|
кг |
||
|
|
|
|
|
|
|
|
|
|
|
|
окружающую |
среду, |
|
; |
Qк теплота |
концентрирования, равная теплоте |
||||||
|
|
||||||||||
|
|
|
|
с |
|
|
|
|
|
|
|
растворения, но с обратным знаком.
Индексы н – начальное, к – конечное, ВП – вторичный пар, п – потери, ГК – конденсат греющего пара.
Запишем частный случай, рассматривая исходный раствор как смесь упаренного раствора и испаряемой влаги при постоянной температуре кипения:
|
|
|
|
|
|
|
LН CНТКИП LК CКТКИП WCВТКИП |
|
(4.76) |
|
|||
где СВ – удельная теплоемкость воды при температуре Ткип . |
|
|||||
Тогда получим: |
|
|
|
|
||
|
|
|
|
|
|
(4.77) |
Q D(HГ НГК ) LН СН (ТКИП ТН ) W(НВП СВТКИП ) QКОНЦ QП |
||||||
|
|
НГК ) количество |
теплоты, выделяющееся |
в |
выпарном |
аппарате при |
D(HГ |
||||||
конденсации D. |
|
|
|
|
||
|
|
|
|
до Ткип . |
|
|
LН CН (ТКИП ТН ) нагревание исходного сырья от Тн |
|
|||||
W(HВП СВТКИП ) теплота на испарение растворителя при ТКИП
При небольшой степени концентрирования и хорошей изоляции выражение
(QКОНЦ QП ) мало и ей можно пренебречь.
Если предположить, что ТН ТКИП , то есть раствор поступает в аппарат при температуре кипения, то
|
D(НГ СГТКОНД ) W(НВП СВТКИП ) |
(4.78) |
|
|
|||||||||||||||
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
НВП СВТКИП |
|
|
rП |
|
|
|
|
|
|
|
|
|||||
|
D |
|
|
|
|
|
|
(4.79) |
|
|
|
|
|||||||
|
|
|
r |
|
|
|
|
|
|||||||||||
|
|
|
Н |
Г |
С |
Г |
Т |
КОНД |
|
|
|
|
|
|
|
|
|||
W |
|
|
|
|
|
R |
|
|
|
|
|
|
|
||||||
rП теплота парообразования; |
|
|
|
|
|
|
|
||||||||||||
rК теплота конденсации греющего пара. |
|
|
|
||||||||||||||||
Если в |
качестве |
греющего |
пара |
используют насыщенный |
водяной |
пар, а |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
упаривают |
|
водный раствор, |
то |
D |
1. Это означает, что |
на |
испарение 1кг |
||||||||||||
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
W |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
растворителя затрачивается 1кг греющего пара. Реально, |
D |
1.05 1.15 |
то есть |
||||||||||||||||
|
|||||||||||||||||||
W
пара необходимо больше на 1.05 1.15. Основная расчетная формула:
42
|
(4.80) |
Q FП К ТП |
|
Искомая величина |
FП , К коэффициент теплопередачи определяется по |
известным формулам. Возникает проблема расчета полезной разности температур ТП .
2.2.3 Температурные потери.
Обычно в выпарных установках известны давления греющего пара и вторичных паров, то есть их температуры. Разность между температурами греющего и вторичного паров называют общей разностью температур выпарных аппаратов:
(4.81)
ТОБЩ связана с полезной разностью температур
ТП |
ТОБЩ |
(4.82) |
ТП |
ТГ ТВП ТГ ТКИП |
(4.83) |
здесь концентрационная температурная депрессия.
гидростатическая температурная депрессия.
гидравлическая температурная депрессия.
определяют как разницу температур кипения раствора и чистого
растворителя при p cosnst :
ТКИП (р) Т КИП(ч.р.) |
(4.84) |
Таким образом, температура образующегося при кипении раствора вторичных паров ниже, чем температура кипения самого раствора, то есть часть температур теряется бесполезно.
характеризует повышение температуры кипения раствора с увеличением гидростатического давления. Обычно по высоте кипятильника определяют среднее давление, и для этого давления определяют среднюю температуру кипения раствора Тср .
pср |
ра |
|
пж gH |
|
|
(4.85) |
|
|
|
|
|
||||||
|
|
2 |
|
|
|
|
||
здесь |
|
ра давление в |
аппарате, |
пж плотность парожидкостной смеси |
||||
( пж ж ),Н высота кипятильных труб. |
|
|||||||
|
|
|
2 |
|
|
|
(4.36) |
|
Тср |
ТВП |
|
|
|||||
где |
Тср температура |
кипения |
раствора при р рср , |
ТВП температура |
||||
вторичных паров при давлении ра . |
|
|
||||||
Гидравлическая температурная депрессия связана с потерей давления насыщенных вторичных паров при прохождении через каплеотбойник и при движении по трубопроводам. При снижении давления падает температура насыщенного пара.
43

2.2.4 Многокорпусное выпаривание.
В многокорпусном выпарной установке вторичный пар предыдущего корпуса используется в качестве греющего пара в последующем корпусе. Такая организация выпаривания приводит к значительной экономии греющего пара.
Если принять D 1по всем корпусам, то общий расход греющего пара на
W
процесс уменьшается пропорционально числу корпусов. Практически, в реальных условиях такое соотношение не выдерживается, оно, как правило, ниже.
Материальный баланс.
Уравнения материальных балансов для многокорпусной выпарной установки представляют собой систему уравнений, записанных для каждого корпуса в отдельности. Уравнения материальных балансов позволяют определить количество испаренной воды в установке и концентрацию растворенного вещества по корпусам при условии, если задан закон распределения испаренной воды по корпусам.
|
|
XН |
|
(4.87) |
|
W общ L(1 |
) |
||||
|
|||||
ХК
n
W т W i |
|
|
|
(4.88) |
||||
|
1 |
|
|
|
|
|
|
|
для первого корпуса: |
|
|||||||
|
|
|
|
|
|
|
|
|
ХR1 |
|
LH ХН |
|
|
|
|
(4.89) |
|
|
|
|
|
|
|
|||
|
LH W1 |
|
|
|
|
|||
для второго корпуса: |
|
|||||||
|
|
|
|
|
|
|
|
|
ХК2 |
|
|
LH XH |
|
(4.90) |
|||
|
|
|
|
|||||
|
|
LH W1 W 2 |
|
|||||
для n-корпуса: |
|
|||||||
|
|
|
|
|
|
|
|
|
ХRn |
|
|
LH XH |
|
|
|
(4.91) |
|
|
|
n |
|
|||||
LH W i
1
Тепловой баланс:
Уравнение теплового баланса для n-корпуса:
|
|
|
|
|
|
|
W n 1 Hn 1 Ln 1 H p(n 1) Ln H pn W n 1 HГ(n 1) W n HnBП QnП Qконц.
Здесь:
W n 1 - расход греющего пара для n-корпуса
W n - расход вторичного пара.
(4.92)
44
|
- |
расход исходного раствора. |
Ln 1 |
||
|
- |
расход упаренного раствора. |
Ln |
||
Hn 1 |
- энтальпия греющего пара. |
|
H p(n 1) |
- |
энтальпия исходного раствора. |
Н pn |
- |
энтальпия упаренного раствора. |
HnBП |
- |
энтальпия вторичного пара. |
НГ(n 1) - энтальпия конденсата греющего пара.
Спомощью системы уравнений тепловых балансов для всех корпусов и уравнений баланса испаряемой жидкости определяют расход греющего пара в первом корпусе, расходы выпаренной воды в каждом корпусе и их тепловые нагрузки.
2.2.5 Полезная разность температур в многокорпусной установке и ее распределение по корпусам.
Тn Тобщ |
(4.93) |
Тобщ ТГ Тбк |
(4.94) |
где ТГ температура греющего пара в первом корпусе, Тбк температура вторичного пара, поступающего в барометрическую камеру.
n |
n |
n |
|
|
|
|
(4.95) |
|
|
||
1 |
1 |
1 |
|
|
|
Величина |
|
небольшая, обычно, ее не рассчитывают, принимают для каждого |
|||
аппарата ~ 1-1.50C. |
|
|
|
||
Тn распределяют между выпарными аппаратами различными способами. |
|||||
1 способ. |
|
|
|
|
|
Поверхности теплопередачи по корпусам равны: F1 F2 |
... Fn |
(4.96) |
|||
2 способ. Суммарная поверхность теплообмена корпусов установки минимальна.
n |
|
Fi min . |
(4.97) |
1 |
|
45

1способ.
F1 F2 |
... Fn F |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
Тn |
|
Q |
|
|
|
|
в корпусе |
|||||||||
KF |
||||||||||||||||
|
|
|
|
|
|
|
||||||||||
Тn |
ТП1 |
ТП2 ... ТnH |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
ТП |
|
|
1 |
|
|
Q |
|
|
||||||||
F |
K |
|||||||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Q |
|
|
|
|
|
|
|
|
||||||
F |
K |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||
TП |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
Q1 |
TП |
|||||||||||
|
|
|
|
|
||||||||||||
ТП1 |
K1 |
|
|
|
|
и.т.д. |
||||||||||
|
|
|
|
|
||||||||||||
QK
(4.98)
(4.99)
(4.100)
2 способ. (Без вывода) для любого n-го корпуса:
|
|
|
|
|
|
|
|
Тn |
|
|
Т |
ПН |
( |
Qn |
) |
0.5 |
|
(4.101) |
|||
Kn |
|
|
|
|||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
( |
Q |
)0.5 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
K |
|
|
46
3 Массопередача
3.1 Общие сведения
В химической технологии широко распространены и имеют важное значение п р о ц е с с ы м а с с о п е р е д а ч и , характеризуемые переходом одного или нескольких веществ из одной фазы в другую. Путем переноса одного или более компонентов из фазы в фазу можно разделять как гетерогенные, так и гомогенные системы (газовые смеси, жидкие растворы и др.), причем наиболее часто процессы массопередачи используют для разделения гомогенных систем.
Виды процессов массопередачи. В промышленности применяются в основном следующие процессы массопередачи между газовой (паровой) и жидкой, между газовой и твердой, между твердой и жидкой, а также между двумя жидкими фазами:
А б с о р б ц и я — поглощение газа жидкостью, т. е. процесс разделения, характеризуемый переходом вещества из газовой фазы в жидкую. Обратный процесс выделения газа из жидкости называется д е с о р б ц и ей. Э к с т р а к ц и я (в системе жидкость — жидкость)— извлечение вещества, растворенного в жидкости, другой жидкостью, практически не смешивающейся или частично смешивающейся с первой. При этом извлекаемый компонент исходного раствора переходит из одной жидкой фазы в другую.
Р е к т и ф и к а ц и я — разделение гомогенных жидких смесей путем многократного взаимного обмена компонентами между жидкой и паровой фазами, движущимися обычно противотоком друг к другу.
А д с о р б ц и я — поглощение компонента газа, пара или раствора твердым пористым поглотителем, т. е. процесс разделения, характеризуемый переходом вещества из газовой (паровой) или жидкой фазы в твердую. Обратный процесс — д е с о р б ц и я проводится после адсорбции и часто используется для регенерации поглощенного вещества из поглотителя.
Разновидностью адсорбции является ионный обмен — процесс разделения, основанный на способности некоторых твердых веществ (ионитов) обменивать свои подвижные ионы на ионы растворов электролитов.
5.Сушка — удаление влаги из твердых материалов главным образом путем ее испарения. В этом процессе влага переходит из твердой фазы в газовую или паровую.
6.К р и с т а л л и з а ц и я — выделение твердой фазы в виде кристаллов из растворов или расплавов. Кристаллизация характеризуется переходом вещества из жидкой фазы в твердую вследствие изменения его растворимости.
7.Р а с т в о р е н и е и э к с т р а к ц и я (в системе твердое тело — жидкость). Растворение характеризуется переходом твердой фазы в жидкую (растворитель) и представляет собой, таким образом, процесс, обратный кристаллизации. Избирательное растворение, предназначенное для
47
извлечения того или иного компонента из твердого пористого материала, называется экстракцией из твердого, или в ы щ е л а ч и в а нием.
Подобно теплопередаче м а с с о п е р е д а ч а представляет собой сложный процесс, включающий перенос вещества (массы) в пределах одной фазы, перенос через поверхность раздела фаз и его перенос в пределах другой фазы. Как известно, при теплопередаче обменивающиеся теплом среды в большинстве случаев разделены твердой стенкой, в то время как массопередача происходит обычно через границу раздела соприкасающихся фаз.
Перенос вещества из фазы к границе раздела фаз или в обратном направлении, т. е. в пределах одной из фаз, называется массоотдач ей.
Процессы массопередачи можно разделить на две группы. К одной группе относятся процессы (абсорбция, экстракция и др.), в которых участвуют минимально три вещества: одно образует первую фазу, другое — вторую фазу, а третье представляет собой распределяемое между фазами вещество. Вещества, составляющие каждую из фаз, являются лишь носителями распределяемого вещества и сами не переходят из фазы в фазу. Так, например, при поглощении аммиака водой из его смеси с воздухом вода и воздух служат носителями распределяемого вещества — аммиака.
К другой группе относятся процессы (например, ректификация), в которых вещества, составляющие две фазы, обмениваясь компонентами, сами непосредственно участвуют в массопередаче и уже не могут рассматриваться как инертные носители распределяемого вещества.
Распределяемое вещество внутри каждой фазы переносится путем диффузии, поэтому процессы массопередачи называются также диффузионными процессами.
Для диффузионных процессов, по аналогии с процессами переноса тепла, принимают, что количество переносимого вещества пропорционально поверхности раздела фаз и движущей силе. Движущая сила характеризуется степенью отклонения системы от состояния динамического равновесия, выражаемой наиболее точно разностью химических потенциалов распределяемого вещества. Диффундирующее в пределах фазы вещество перемещается от точки с большей к точке с меньшей концентрацией, и в расчетах движущую силу проиессов массопереноса выражают приближенно через разность концентраций, подобно тому, как в процессах теплопереноса ее выражают разностью температур. Расчетные выражения движущей силы не одинаковы для процессов массоотдачи и массопередачи и будут рассмотрены ниже для каждого из этих процессов.
Процессы массопередачи с твердой ф а з о й отличаются специфическими особенностями переноса распределяемого вещества внутри твердой фазы. Поэтому закономерности массопередачи в системах с твердой фазой описаны отдельно.
Процессы массопередачи избирательны в тех случаях, когда поглотитель извлекает только один компонент (или несколько компонентов) исходной смеси и практически не извлекает остальных ее компонентов. Эти процессы
48

большей частью обратимы, т. е. могут протекать в противоположных направлениях в зависимости от температуры, давления и других условий их проведения. При этом направление перехода вещества из фазы в фазу определяется концентрациями распределяемого вещества в фазах и условиями равновесия.
Способы выражения состава фаз. Обычно количественный состав фаз выражают:
в объемных к о н ц е н т р а ц и я х , принимая за единицу массы 1 кг или 1 кмоль; объемная концентрация представляет собой число килограммов (или киломолей) данного компонента, приходящееся на единицу объема фазы (в кг/м3 или кмоль/м3); в в е с о в ы х и л и мольных долях, представляющих собой
отношение килограммов (или киломолей) данного компонента к массе всей фазы, выраженной общим числом килограммов или киломолей соответственно; 3)в о т н о с и т е л ь н ы х к о н ц е н т р а ц и я х , т. е. в виде отношения
килограммов (или киломолей) данного компонента, являющегося распределяемым веществом, к числу килограммов (или киломолей) компонента — носителя, количество которого остается постоянным в процессе массопередачи.
Весовые и мольные доли. Пусть имеется смесь, состоящая из компонентов А, В, ..., К, ..., N, весовые доли (или весовые проценты) которых в смеси ХА, хв, ..., хк, ..., XN и молекулярные веса равны МА, Мв, ..., Мк, ,.„ MN.
Число молей любого компонента, например компонента K, приходящееся на 1 кг смеси, составляет ~хк/Мк. Соответственно содержание этого компонента в смеси (в мол. долях)
(1)
Для обратного пересчета выразим весовые доли х компонентов через мольные доли х.
Массы отдельных компонентов, содержащихся в 1 кмоль смеси, составляют МaХА, Мвхв, ..., Мкхк, ..., MNxN, а общая масса 1 кмоль смеси:
Соответственно весовая доля K-го компонента:
(2)
Для двухкомпонентной (бинарной) смеси, состоящей из компонентов А и В, выражения (1) и (2) упрощаются. Если весовая доля одного из компонентов (например, компонента A) равна хд, его мольная доля хA и молекулярный вес МA, то содержание другого компонента (с молекулярным весом MB) будет (1 — ХА) или (1 — хA соответственно. Поэтому мольный состав смеси (по компоненту A)
49
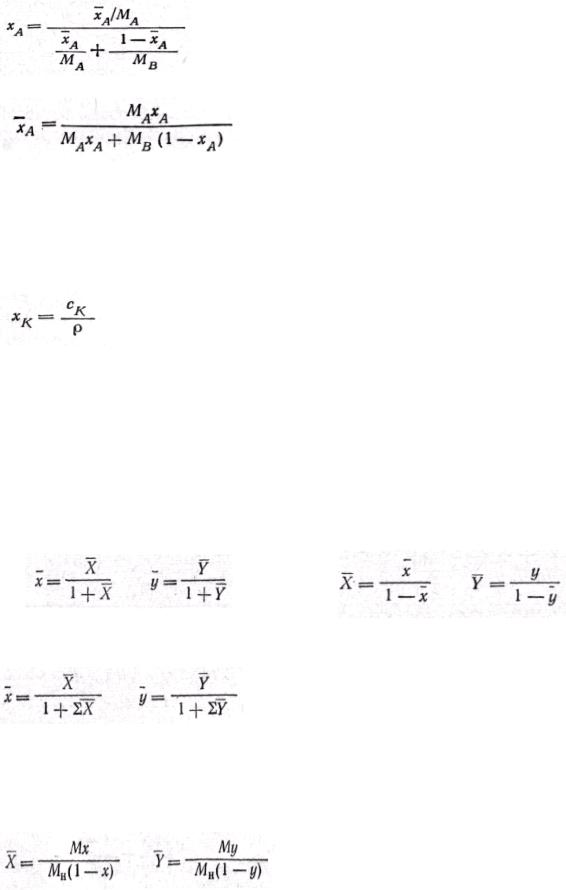
(3)
и ее весовой состав по тому же компоненту
(4)
Объемная концентрация и весовые доли. Обозначим объемные концентрации компонентов в смеси через СА, св, ..., ск, ..., CN , кг/м3. Сумма ca+cb+…+cK+…+cN представляет собой массу-смеси в 1 м2 ее объема, или плотность р смеси. Соответственно весовая доля любого (например, K-го) компонента выражается через его объемную концентрацию с к следующим образом:
(5)
Относительные концентрации, весовые и мольные доли. Пусть X и Y выражают относительные весовые концентрации распределяемого компонента во взаимодействующих фазах Фх и Фу соответственно, т. е. количества его, приходящиеся на один килограмм носителя в каждой фазе.
Общая масса фазы, состоящей из распределяемого компонента и 1 кг носителя, призраком выражении концентрации равна (1 + X) кг (жидкая фаза) и (1 + Y) кг (газовая или паровая фаза).
Соответственно весовые концентрации х и у распределяемого компонента в фазах:
(6) |
|
откуда |
(7) |
Для |
|
многокомпонентных смесей весовые концентрации |
компонентов |
определяются по уравнениям: |
|
(6а)
где ∑Х и ∑К — сумма относительных весовых концентраций всех компонентов смеси (кроме носителя) в фазах Фх и Фу.
В случае выражения концентраций распределяемого компонента в мольных долях его относительные весовые концентрации определяются из следующих зависимостей:
(7а)
где М и Мн — молекулярный вес распределяемого компонента и носителя,
кг.
50
