Пятичленные гетероциклы с одним гетероатомом.
Пиррол, фуран и тиофен являются пятичленными гетероциклическими соединениями с одним гетероатомом.

Нумерация атомов в составе гетероцикла начинается с гетероатома и идет против часовой стрелки. Положения 2- и 5-называют -положениями, 3- и 4- – -положениями.
По формальным признакам эти соединения относятся к ароматическим, так как они представляют собой сопряженные циклические -системы, в состав которых входит 6 электронов – 4 электрона диеновой системы – и пара электронов гетероатома. Цикл является практически плоским, из чего следует, что состояние гибридизации гетероатома близко к sp2.
Фуран и его производные бурно реагирует с сильными, кислотами. Тиофен намного более устойчив в кислых средах, чем пиррол и фуран.
Пиррол — ароматический пятичленный азотистый гетероцикл, обладает слабыми кислотными свойствами. Содержится вкостном масле(которое получают присухой перегонкекостей), а также вкаменноугольной смоле. Пиррольные кольца входят в составпорфиринов—хлорофилларастений,гемагемоглобиновицитохромови ряда других биологически важных соединений.
Фуран(оксол-2,4-диен) — органическое соединение с формулой C4H4O. Пятичленный гетероциклс одним атомомкислорода. Представляет собой бесцветную жидкость с характерным запахом.
Тиофе́н — ароматический пятичленный гетероцикл, содержащий один атом серы в цикле,
Хорошо растворим в углеводородах и др. органических растворителях, не растворим в воде. Молекула тиофена плоская.
Получение фурана ,пиррола ,тиофена и их гомологов из 1,4-дикетонов.
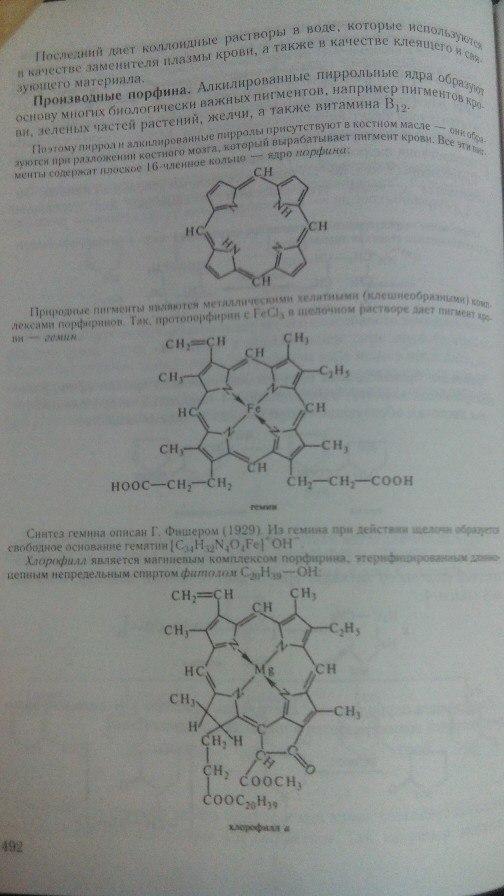
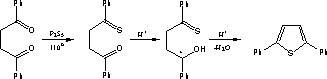
Пиррол, фуран, тиофена и их производные могут быть получены из одних и тех же предшественников – 1,4-дикарбонильных соединений. Этот метод называется синтезом Пааля-Кнорра. Так, производные фурана образуются при действии на 1,4-дикетоны дегидратирующими веществами – (Р2О5, H2SО4, ZnCl2 и др.). При взаимодействии с аммиаком или первичными аминами образуются производные пиррола. Реакция с неорганическими сульфидами, например с P2S5 приводит к образованию производных тиофена.

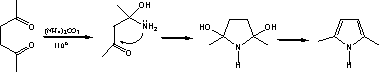
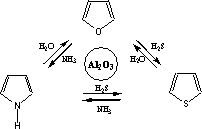
Поскольку образование гетероцикла пиррола, фурана и тиофена может происходить из одних и тех же исходных 1,4-дикарбонильных соединений, в соответствующих условиях возможны и их взаимопревращения. Эта реакция была открыта Юрьевым и носит его имя. Превращения происходят при нагревании гетероцикла в присутствие окиси алюминия при 400 °С в токе H2S, NH3 или H2O, однако высокий выход достигается только в случае использования фурана в качестве исходного соединения.
Еще один общий метод получения пятичленных гетероциклов основан на использовании в качестве исходного соединения слизевой кислоты и других дикарбоновых кислот – продуктов окисления сахаров. Сухая перегонка слизевой кислоты приводит к образованию пирослизевой или -фуранкарбоновой кислоты. При пиролизе аммонийной соли слизевой кислоты образуется пиррол.

Декарбоксилирование пирослизевой кислоты является методом получения фурана.
Промышленным способом получения фурфурола – фуран-2-карбальдегида является кислотный гидролиз полисахаридов, в состав которых входят пентозы – пятиатомные сахара, содержащиеся в различном растительном сырье. Так, фурфурол получают из шелухи семян подсолнечника, кукурузных початков, соломы, отрубей, вследствие чего он и получил свое название (латинское furfur – отруби).

Далее фурфурол превращают в пирослизевую кислоту либо по реакции Канницаро, либо окислением кислородом воздуха в присутствии щелочных растворов солей меди или серебра, Полученную кислоту декарбоксилируют в фуран нагреванием до 200-250° С. Сам фурфурол так же может быть превращен в фуран нагреванием при 400 С в присутствии катализаторов – хромитов цинка или марганца.
Пиррол в промышленности получают фракционной перегонкой каменноугольной смолы и костяного масла – вещества, образующегося при сухой перегонке костей. Кроме того, его получают из фурана по методу Юрьева, а также взаимодействием ацетилена с формальдегидом и аммиаком.
Сукцинимид, по сути, является производным пиррола и может быть превращен в пиррол восстановлением цинком.

Наиболее общий лабораторный метод синтеза производных пиррола заключается во взаимодействии монооксимов -дикетонов с кетонами в уксусной кислоте в присутствие цинка (синтез Кнорра). Суть этого превращения заключается в том, что на первой стадии реакции оксимная группа восстанавливается цинком в кислой среде в аминогруппу. Кетонная группа в этих условиях не затрагивается. Далее происходит конденсация образующегося -аминокетона с кетоном, а за этим следует циклизация. Побочным продуктом в этой реакции является дигидропиразин, образующийся в результате конденсации двух молекул аминокетона между собой (стр. 68).

ПРЕДЛОЖИТЕ МЕХАНИЗМ РЕАКЦИИ ДЛЯ СТАДИИ ОБРАЗОВАНИЯ ЦИКЛА В СИНТЕЗЕ ПИРРОЛОВ ПО КНОРРУ.
ПРИ ВЗАИМОДЕЙСТВИИ -АМИНОКЕТОНОВ С ЭФИРАМИ АЦЕТИЛЕНДИКАРБОНОВОЙ КИСЛОТЫ МОГУТ БЫТЬ ПОЛУЧЕНЫ ПРОИЗВОДНЫЕ ПИРРОЛА, А ПРИ ВЗАИМОДЕЙСТВИИ -ОКСИКЕТОНОВ (АЦИЛОИНОВ) С ТЕМ ЖЕ РЕАГЕНТОМ – ПРОИЗВОДНЫЕ ФУРАНА. ПРЕДЛОЖИТЕ МЕХАНИЗМ ЭТИХ ПРЕВРАЩЕНИЙ И ОХАРАКТЕРИЗУЙТЕ УСЛОВИЯ, В КОТОРЫХ ОНИ БУДУТ ПРОИСХОДИТЬ.
С высоким выходом замещенные пирролы образуются при взаимодействии азлактонов с ацетиленами. Азлактоны -гетероциклические соединения, образующиеся при взаимодействии аминокислот с хлорангидридами карбоновых кислот. Замыкание азлактонного цикла представляет, по сути, модификацию, приводящую одновременно к увеличению кислотности С-Н связи углерода, связанного с атомом азота. Вследствие этого азлактон способен вступать в реакцию присоединения по Михаэлю по ацетиленовой кратной связи. Далее следует замыкание цикла по связи C=N в составе азлактонного цикла и отщепление молекулы CO2, завершающее образование пиррольного цикла.

Тиофен обычно содержится в качестве примеси в бензоле, получаемом из каменноугольной смолы (до 0.5%). Температуры кипения бензола и тиофена близки (80 и 84 °С соответственно), что затрудняет их разделение перегонкой, однако бензол может быть очищен от примеси тиофена химически.
Предложите химический метод отделения примеси тиофена от бензола, используя представления об относительной реакционной способности этих соединений.
В промышленности тиофен получают взаимодействием бутана, бутена или бутадиена с серой при высокой температуре (600°) с малым временем контакта реагирующих веществ – около 1 сек и немедленным охлаждением. При этом в реакцию вступает только часть реагентов, их отделяют от циклических продуктов, и вновь вводят в реакцию. Отметим, что сера в этой реакции выступает в качестве дегидрирующего окислителя, под действием которого гидрированные производные тиофена превращаются в тиофен.

Тиофен может быть получен в лабораторных условиях взаимодействием динатриевой соли янтарной кислоты с P2S3. Этот метод интересен тем, что и замещенные янтарные кислоты в тех же условиях образуют соответствующие замещенные производные тиофена.
Еще одно превращение, при котором образуется тиофен, открытое Чичибабиным, заключается во взаимодействии ацетилена с сероводородом при 400-450 °С на окиси алюминия. Эта реакция не имеет препаративного значения, однако, интересна своим сходством с реакций, тримеризации ацетилена с образованием бензола.

Юрьева реакция,
превращение фурана в его аналоги — пиррол (X = NH), тиофен (X = S), селенофен (X = Se):

Осуществляется пропусканием паров фурана соответственно с аммиаком, сероводородом или селеноводородом над окисью алюминия (Al2O3) при 400—450 °С. Выход 30—40%. В Ю. р. вступают также гидрированные аналоги и гомологи фурана. Например, тетрагидрофуран почти количественно превращается в тетрагидротиофен. Открыта в 1935 советским химиком Ю. К. Юрьевым (1896—1965). Применяется в органическом синтезе для получения некоторых замещенных пирролов.
Галогенирование тиофена
Галогенирование тиофена происходит очень быстро и как при комнатной температуре, так и при -30 °С в темноте легко проходит тетразамещение . Скорость галогенирования тиофена при 25 °С примерно в 108 раз больше, чем бензола. Образование как 2,5-дибром - и 2,5-дихлортиофенов, так и 2-бром- и 2-иодтиофенов гладко происходит в различных контролируемых условиях. Контролируемое бромирование 3-бромтиофена дает 2,3-ди-бромтиофен.
 Трибромирование
тиофена гладко протекает в 48%-ном
растворе НВг. Давно известно, что при
обработке полигалогенотиофенов цинком
и кислотой удается селективно удалять
α-галоген, что делает доступным получение
3-бромтиофена, а 3,4-дибромтиофен
аналогично образуется при восстановлении
тетрабромида. При
использовании боргидрида натрия из
2,3,5-трибромтиофена получают 2,3-дибромтиофен
(в присутствии катализатора Pd(0))или
2,4-дибромтиофен (без
катализатора).
Трибромирование
тиофена гладко протекает в 48%-ном
растворе НВг. Давно известно, что при
обработке полигалогенотиофенов цинком
и кислотой удается селективно удалять
α-галоген, что делает доступным получение
3-бромтиофена, а 3,4-дибромтиофен
аналогично образуется при восстановлении
тетрабромида. При
использовании боргидрида натрия из
2,3,5-трибромтиофена получают 2,3-дибромтиофен
(в присутствии катализатора Pd(0))или
2,4-дибромтиофен (без
катализатора).
 Моноиодирование
α-замещеиных тиофенов, независимо
оттого, оказывают ли эти заместители
активирующее или дезактивирующее
влияние, идет по второму α-положению
при действии иода и иодбензолдиацетата.
3-Алкилтио-фены можно монобромировать
или моноиодировать по положению 2 при
использовании N-бромсукцинимида
или иода в присутствии оксида ртути(II)
соответственно.
Нитрование
тиофена
Нитрование
тиофена следует проводить в отсутствие
азотистой кислоты, которая может
привести к взрыву; наиболее удобно
использование ацетилнитрата или
тетрафторбората нитрония. Наряду с
преимущественным образованием
2-нитросоединения получают и 3-изомер
с выходом -10%. Дальнейшее нитрование
как 2-, так и 3-нитротио-фенов также
приводит к образованию смесей: из
2-нитротиофена образуются эквивалентные
количества 2,4- и 2,5-динитротиофенов, а
из 3-изомера — в основном 2,4-динитротиофен.
Аналогично, предсказуемая смесь изомеров
образуется при нитровании замещенных
тиофенов: например, 2-метилтиофен
дает смесь
2-метил-5- и 2-метил-З-нитротиофенов, а 3-метилтиофен
-4-метил-2- нитро- и 3-метил-2-нитротиофены
в соотношении 4:1 в каждом
случае.
Моноиодирование
α-замещеиных тиофенов, независимо
оттого, оказывают ли эти заместители
активирующее или дезактивирующее
влияние, идет по второму α-положению
при действии иода и иодбензолдиацетата.
3-Алкилтио-фены можно монобромировать
или моноиодировать по положению 2 при
использовании N-бромсукцинимида
или иода в присутствии оксида ртути(II)
соответственно.
Нитрование
тиофена
Нитрование
тиофена следует проводить в отсутствие
азотистой кислоты, которая может
привести к взрыву; наиболее удобно
использование ацетилнитрата или
тетрафторбората нитрония. Наряду с
преимущественным образованием
2-нитросоединения получают и 3-изомер
с выходом -10%. Дальнейшее нитрование
как 2-, так и 3-нитротио-фенов также
приводит к образованию смесей: из
2-нитротиофена образуются эквивалентные
количества 2,4- и 2,5-динитротиофенов, а
из 3-изомера — в основном 2,4-динитротиофен.
Аналогично, предсказуемая смесь изомеров
образуется при нитровании замещенных
тиофенов: например, 2-метилтиофен
дает смесь
2-метил-5- и 2-метил-З-нитротиофенов, а 3-метилтиофен
-4-метил-2- нитро- и 3-метил-2-нитротиофены
в соотношении 4:1 в каждом
случае.
 Сульфирование
Получение
тиофен-2-сульфокислоты при сульфировании
серной кислотой уже давно известно,
однако использование комплекса
пиридинсульфотриоксид, возможно, более
удобный метод. 2-Хлорсульфонилирование
и 2- тиоцианирование также достаточно
эффективны.
Сульфирование
Получение
тиофен-2-сульфокислоты при сульфировании
серной кислотой уже давно известно,
однако использование комплекса
пиридинсульфотриоксид, возможно, более
удобный метод. 2-Хлорсульфонилирование
и 2- тиоцианирование также достаточно
эффективны.

Ацилирование Ацилирование по Фриделю-Крафтсу наиболее часто используется для тиофенов и обычно дает хорошие выходы в контролируемых условиях. Несмотря на то, что при взаимодействии тиофена с AlCl3 получаются смолы, их образования можно избежать, если добавлять катализатор к тиофену и ацилирующему агенту. Наиболее часто в качестве катализатора используют хлорид олова. Эффективный метод — ацилирование ангидридами, катализируемое фосфорной кислотой. В реакциях с ацетил-п-толуолсульфонатами в отсутствие катализаторов с высоким выходом образуется 2-ацетилтиофен. При формилировании тиофена по Вильсмейеру получают 2-формилтиофен. 2-Формилпроизводное образуется также из 3-фенилтиофена в условиях реакции Вильсмейера.

Гидрирование:
Гидрирование (гидрогенизация), присоединение Н2 к органическим соединениям (обратная реакция наз.дегидрирование.). гидрирование и дегидрирование связаны подвижным равновесием, положение которого определяется температурой и давлением Н2. Гидрирование обычно происходит при сравнительно низких температурах (20-200 °С), дегидрирование – при более высоких. Повышение давления благоприятствует гидрированию.
Обычно гидрирование осуществляют в условиях гетерогенного или гомогри гетерогенном гидрировании увеличение числа и объема заместителей при кратной связи приводит к затруднению координации соед. с пов-стью катализатора и доступа к нему Н2. Скорость гидрирования часто определяется природой гидрируемой связи. Достаточно легко гидрируются ацетилены. олефины. нитросоединения. труднее-ароматич.углеводороды. альдегиды. кетоны. карбоновые кислоты и их производные (см. табл.). Недостаток процесса-невысокая селективность вследствие протекания побочных реакций крекинга. гидрогенолиза и т.п.енного катализа.

Пиридин —
шестичленный
ароматический гетероцикл с
одним атомом азота,
бесцветная жидкость с резким неприятным
запахом; смешивается с водой и органическими
растворителями. Пиридин —
слабоеоснование,
дает соли с
сильными минеральными кислотами,
легко образует двойные
соли и комплексные
соединения.
![]()
Основные свойства гетероциклических соединений обусловлены неподеленной парой электронов гетероатома, способной присоединять протон. Такими свойствами обладает пиридиновый атом азота, у которого n-электроны находятся на sp2-гибридной орбитали и не вступают в сопряжение. Пиридин является основанием и с сильными кислотами образует пиридиниевые соли, подобные аммониевым солям.

Аналогично основные свойства проявляют и другие гетероциклы, содержащие пиридиновый атом азота. Так, имидазол и пиразол образуют соли с минеральными кислотами за счет пиридинового атома азота.

Пиррольный атом азота в молекулах имидазола, пиразола и, естественно, самого пиррола не склонен связывать протон, так как его неподеленная пара электронов является частью ароматического секстета. В результате пиррол практически лишен основных свойств.
|
|
В то же время пиррольный атом азота может служить центром кислотности. Пиррол ведет себя, как слабая NH-кислота, поэтому протон будет отщепляться только при действии очень сильных оснований, например амида натрия NaNH2 или гидрида натрия NaH. За счет пиррольного атома азота в реакциях со щелочными металлами также образуются соли, которые легко гидролизуются.

Таким образом, имидазол и пиразол могут проявлять как основные, так и кислотные свойства, т. е. являются амфотерными соединениями.

Гетероциклы, содержащие пиридиновый атом азота, проявляют и нуклеофильные свойства, т. е. способность атаковать атом углерода, несущий частичный положительный заряд (электрофильный центр). Так, взаимодействие пиридина с галогеноалканами приводит к образованиюалкилпиридиниевых солей.

Реакции электрофильного замещения для пиридина
Реакции электрофильного замещения для пиридина идут с большим трудом, что обусловлено -дефицитностью ядра и способностью атома азота образовывать соли с протонными кислотами и комплексы с кислотами Льюиса, что еще больше уменьшает нуклеофильность ядра. По способности к электрофильному замещению пиридин напоминает нитробензол. Атака электрофилами идет по положению 3.

Наиболее характерными для пиридина являются реакции нуклеофильного замещения, которые идут по положениям 2 и 4. Примерами таких реакций является взаимодействие пиридина с амидом натрия (реакция Чичибабаина) и со щелочами.
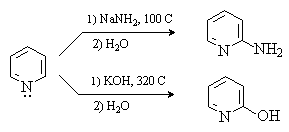
Окисление и восстановление
Цикл пиридина устойчив к действию окислителей.
Алкилпиридины окисляются с образованием пиридинкарбоновых кислот.

Пиридин гидрируется в жестких условиях с образованием насыщенного гетероцикла – пиперидина.
![]()
Соли алкилпиридиния легко восстанавливаются комплесными гидридами металлов
40.Ответы имеются в 39ом вопросе
42.Фотографии