
Ответы на вопросы:
7. Алкены
Алкены(олефины)-это углеводороды, в молекулах которых содержатся атомы углерода, соединенные между собой двойной связью. Простейщий представитель- этилен C2H4? Общая формула CnH2n(при n≥2)
Гомологический ряд
|
этен(этилен) |
C2H4 |
|
пропен |
C3H6 |
|
бутен |
C4H8 |
|
пентен |
C5H10 |
|
гексен |
C6H12 |
|
гептен |
C7H14 |
|
октен |
C8H16 |
|
нонен |
C9H18 |
|
децен |
C10H20 |
Изомерия алкенов
Наряду
со структурной изомерией углеродного
скелета для алкенов характерны, во-первых,
другие разновидности структурной
изомерии - изомерия положения кратной
связи и межклассовая изомерия.
Во-вторых,
в ряду алкенов проявляется пространственная
изомерия, связанная с различным положением
заместителей относительно двойной
связи, вокруг которой невозможно
внутримолекулярное вращение.
Структурная
изомерия алкенов
1. Изомерия углеродного
скелета (начиная с С4Н8):
 2.
Изомерия положения двойной связи
(начиная с С4Н8):
2.
Изомерия положения двойной связи
(начиная с С4Н8): 3.
Межклассовая изомерия с циклоалканами,
начиная с С3Н6:
3.
Межклассовая изомерия с циклоалканами,
начиная с С3Н6: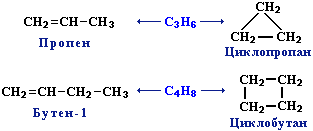 Пространственная
изомерия алкенов
Пространственная
изомерия алкенов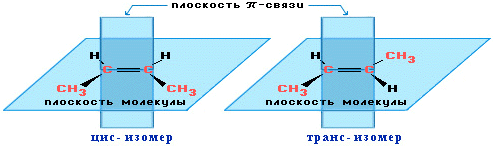 Вращение
атомов вокруг двойной связи невозможно
без ее разрыва. Это обусловлено
особенностями строения p-связи
(p-электронное облако сосредоточено над
и под плоскостью молекулы). Вследствие
жесткой закрепленности атомов поворотная
изомерия относительно двойной связи
не проявляется. Но становится возможной
цис-транс-изомерия.
Алкены, имеющие у
каждого из двух атомов углерода при
двойной связи различные заместители,
могут существовать в виде двух
пространственных изомеров, отличающихся
расположением заместителей относительно
плоскости p-связи. Так, в молекуле бутена-2
СН3–СН=СН–СН3 группы СН3 могут находиться
либо по одну сторону от двойной связи
в цис -изомере, либо по разные стороны
в транс-изомере.
ВНИМАНИЕ! цис-транс-
Изомерия не проявляется, если хотя бы
один из атомов С при двойной связи имеет
2 одинаковых заместителя.
Вращение
атомов вокруг двойной связи невозможно
без ее разрыва. Это обусловлено
особенностями строения p-связи
(p-электронное облако сосредоточено над
и под плоскостью молекулы). Вследствие
жесткой закрепленности атомов поворотная
изомерия относительно двойной связи
не проявляется. Но становится возможной
цис-транс-изомерия.
Алкены, имеющие у
каждого из двух атомов углерода при
двойной связи различные заместители,
могут существовать в виде двух
пространственных изомеров, отличающихся
расположением заместителей относительно
плоскости p-связи. Так, в молекуле бутена-2
СН3–СН=СН–СН3 группы СН3 могут находиться
либо по одну сторону от двойной связи
в цис -изомере, либо по разные стороны
в транс-изомере.
ВНИМАНИЕ! цис-транс-
Изомерия не проявляется, если хотя бы
один из атомов С при двойной связи имеет
2 одинаковых заместителя.
Промышленные
способы получения алкенов.
1)
Дегидрирование алканов
Это один из
промышленных способов получения алкенов.
Температура: 350—450 °C, катализатор —
Cr2O3. Также используются алюмомолибденовые
и алюмоплатиновые катализаторы[15]. Для
получения транс-алкенов используют
MOH/EtOH, для цис-производных NaNH2/NH3
![]() 2)Крекинг
алканов.
При температуре 450 – 700°С
алканы распадаются за счет разрыва
связей С–С (более прочные связи С–Н
при такой температуре сохраняются) с
образованием алканов и алкенов с меньшим
числом углеродных атомов. Например:
2)Крекинг
алканов.
При температуре 450 – 700°С
алканы распадаются за счет разрыва
связей С–С (более прочные связи С–Н
при такой температуре сохраняются) с
образованием алканов и алкенов с меньшим
числом углеродных атомов. Например:
C6H14
 C2H6
+ C4H8
3)Гидрирование
ацетилена.
C2H6
+ C4H8
3)Гидрирование
ацетилена.
Ni,t
HC = CH + H2 -------- > H2C = CH2
ацетилен этилен
Лабораторные способы получения алкенов.
1.
Дегидратация спиртов.
Дегидратацию
спиртов ведут при повышенной температуре
в присутствии сильных минеральных
кислот
![]() 2.
Дегидрогалогенирование и дегалогенирование
алканов.
Отщепление галогенов у
дигалогеналканов происходит в присутствии
цинка
2.
Дегидрогалогенирование и дегалогенирование
алканов.
Отщепление галогенов у
дигалогеналканов происходит в присутствии
цинка![]() Дегидрогалогенирование
проводят при нагревании действием
спиртовыми растворами щелочей.
Дегидрогалогенирование
проводят при нагревании действием
спиртовыми растворами щелочей.![]()
Правило Зайцева. Более старая формулировка правила гласит: отщепление атома водорода в реакциях элиминирования происходит преимущественно от наименее гидрогенизированного атома углерода. Согласно п. З., при отщеплении от алкилгалогенида молекулы НХ (X — атом галогена) отрыв водорода происходит от того атома углерода, с которым связано наименьшее число атомов водорода, т. е. от наименее гидрогенизованного.
Дегалогенирование дигалогенидов. СН3-СН-СН2 + Zn (Mg) ¾¾
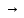 СН3-СН=СН2 + ZnBr2
СН3-СН=СН2 + ZnBr2
Значение алкенов в промышленности органического синтеза Получение алкенов. В промышленности важным источником непредельных соединений являются продукты крекинга и пиролиза нефтяных фракций, а также газы коксования (этилен, пропилен). С той же целью часто применяются способы дегидрогенизации алканов на катализаторах 1. Обычным способом получения алкенов в лабораторных условиях является дегидратация спиртов Алкены. Диеновые углеводороды | Способы получения. Крекинг алканов является важнейшим промышленным способом получения алкенов из высококипящих фракций нефти. Под действием сильного нагревания (до 700°С) в молекулах алканов гомолитически расщепляются -связи при этом образуется смесь низкомолекулярных алканов и алкенов г) Дегидрирование алканов проводят при 500°С в присутствии катализатора: Химические свойства алкенов определяются наличием в их молекулах двойной связи
Полимеризация
степень полимеризации- число молекул, соединяющихся друг с другом.




10. Химические св-ва алкенов.
1)Гидрирование:
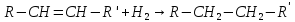 Гидрирование
алкенов непосредственно водородом
происходит только в присутствии
катализатора. Гетерогенными катализаторами
гидрирования служат платина, палладий,
никель.2)Галогенирование
(присоединение
галогенов) :
Галогенирование алкенов,
проходящее в отсутствие инициаторов
радикальных реакций —
Гидрирование
алкенов непосредственно водородом
происходит только в присутствии
катализатора. Гетерогенными катализаторами
гидрирования служат платина, палладий,
никель.2)Галогенирование
(присоединение
галогенов) :
Галогенирование алкенов,
проходящее в отсутствие инициаторов
радикальных реакций —
типичная
реакция электрофильного присоединения.
Она проводится в среде неполярных
инертных растворителей.
 3)Гидрогалогенирование.
Электрофильное
присоединение галогенводородов к
алкенам происходит по правилу
Марковникова:
3)Гидрогалогенирование.
Электрофильное
присоединение галогенводородов к
алкенам происходит по правилу
Марковникова: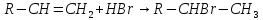 4)Гидратация:
Реакция присоединения
воды к алкенам протекает в присутствии
серной кислоты:
4)Гидратация:
Реакция присоединения
воды к алкенам протекает в присутствии
серной кислоты: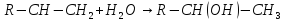 Реакция протекает по правилу
Марковникова.
Реакция протекает по правилу
Марковникова.
Правило Морковникова

Пероксидный эффект Караша (Хараша) –
только HBr в присутствии радикалов или О2 присоединяется против правил Морковникова


Окисление в мягких условиях – реакция Вагнера:
СН2=СН2+2КМnO4+4H2O = 3CH2OH-CH2OH+2MnO2+2KOH
CH2=CH2+H2O2 OsO4= CH2OH-CH2OH
Окисление в жестких условиях:

 СН3-СН=СН2
KMnO4,
100C=
СН3-С-ОН
+ НО-СН = СН3-СН=О+О=СН+Н2
СН3-СН=СН2
KMnO4,
100C=
СН3-С-ОН
+ НО-СН = СН3-СН=О+О=СН+Н2
ОН ОН
Окисление на серебряном катализаторе:

 СН2=СН2+О2
Ag,
150C
=
СН2-СН2
СН2=СН2+О2
Ag,
150C
=
СН2-СН2
О
Озонолиз:
на первом этапе образуется двучленный озонит, который разрушается водой

 С=С+О3
= О = С=О+С=
С=С+О3
= О = С=О+С=
С-О-О-С
Аллильное замещение
Взаимодействие гомологов этилена с галогенами при высокой температуре ведет только к замещению атома водорода в аллильном положении на галоген называется аллильным замещением:
СН3-СН=СН2+Сl2 300-450C=Cl-CH2-CH=CH2+HCl

28. Природные источники. В промышленности нафталин, главным образом, получают из каменноугольной смолы, где его содержание составляет около 10 %. Наряду с нафталином из каменноугольной смолы выделяют также некоторые его моно- и диметильные производные. 2. Получение нафталина из ацетилена. При пропускании ацетилена через нагретые до 700-800 °С трубки наряду с бензолом образуется также и нафталин.
НАФТАЛИН
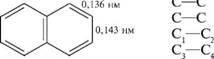
нафталин состоит из двух конденсированных бензольных колец. Два атома углерода (9 и 10) — общие для двух колец.
Многоядерные арены
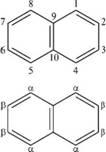
и отличие от бензола атомы углерода в молекуле нафталина неравноценны. Положения 1, 4, 5, 8 равнозначны, их принято обозначать буквой а и называть а-положениями. Положения 2, 3, 6 и 7 также равнозначны, их обозначают буквой р и называют р-положе-ниями.
Для монозамещенного нафталина возможны два изомера (а- и р -), а при наличии двух одинаковых заместителей — 10 изомеров:
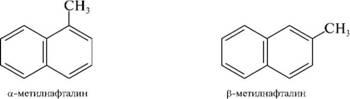
Химические свойства
Нафталин, сходный с бензолом по своему строению, обладает ароматическим характером, т. е. легко нитруется, сульфируется и т. д.
1. Присоединение водорода (гидрирование). К двойным связям нафталина может присоединяться водород. В зависимости от условий гидрирования получают дигидронафталин, тетрагидронафталин и декаги-дронафталин. Продукты восстановления нафталина – тетралин и декалин – получили широкое применение в технике в качестве растворителей, горючего и т. д.
2. Замещение атомов водорода.
Атомы водорода в нафталине легко замещаются, причем в большинстве случаев легче получаются а-произ-водные. Во многих случаях b-производные получаются более длительным путем.
3. Окисление.
Энергичное окисление нафталина или более легко идущее окисление его окси– и аминопроизводных приводит к образованию нафтохинонов.
Правило Хюккеля: ароматической является плоская моноциклическая сопряженная система, содержащая (4n + 2) -электронов (где n = 0,1,2...).
Таким образом, ароматическими будут плоские циклические сопряженные системы, содержащие 2, 6,10, 14 и т.д. -электронов.
Плоские циклические сопряженные системы, содержащие 4n -электронов (n=1,2…), неустойчивы, так как обладают незамкнутой электронной оболочкой с частично заполненными несвязывающими орбиталями. Такие системы относят к антиароматическим.
Критерии ароматичности
Правило Хюккеля представляет собой теоретический обоснованный метод, позволяющий предсказать, будет ли моноциклическая система ароматической. Для проверки правильности предсказания необходимо располагать экспериментальными критериями ароматичности Важнейшими из физических критериев ароматичности являются энергетические, магнитные и структурные свойства сопряженных циклических систем.
Энергетические критерии
Основной признак ароматического характера соединения – повышенная термодинамическая устойчивость, которая является следствием циклической делокализации -электронов. Выигрыш в энергии за счет делокализации называют энергией делокализации или энергией резонанса. Энергия делокализации не является измеряемой физической величиной, так как для ее определения необходимо сравнивать бензол с реально не существующим гипотетическим 1,3,5-циклогексатриеном, имеющим локализованные простые и двойные связи.
Эмпирическая оценка энергии делокализации может быть проведена путем сравнения теплот гидрирования бензола и циклогексена. Однако такая оценка не является корректной, так как не учитывает вклад в разность между энергиями бензола и циклогексатриена наряду с -делокализацией такого фактора, как изменение длин связей.
Соединения с положительными значениями энергии делокализации относят к ароматическим, с отрицательными – к антиароматическим.
Антиароматичность, таким образом, означает дестабилизацию при циклической делокализации -электронов.
На этом основании бензол можно отнести к ароматическим, а циклобутадиен - к антиароматическим структурам.
Структурные критерии:
Ароматические соединения отличаются особой геометрией молекулы. Для них характерна тенденция к расположению всех атомов ароматического цикла в одной плоскости, что необходимо для эффективного перекрывания атомных р-орбиталей, и выравнивание длин связей в цикле. Отметим, что полная эквивалентность длин связей наблюдается только в бензоле и моноциклических ионах С3Н3+, С5Н5-, С7Н7+: в неароматических соединениях наблюдается альтернирование (чередование) двойных и одинарных связей, тогда как для ароматических соединений характерно отсутствие альтернирования длин связей. Поскольку в настоящее время существуют надежные экспериментальные методы определения геометрических параметров молекулы (рентгеноструктурный анализ, исследование дифракции электронов и нейтронов), копланарность и степень выравниваниия связей могут быть использованы в качестве критериев ароматичности.
Магнитные критерии:
Наиболее простым и надежным методом определения ароматичности является определение положения сигналов протонов сопряженного циклического полиена в спектрах ядерного магнитного резонанса (ЯМР). Метод основан на том, что в ароматических соединениях при облучении внешним магнитным полем с напряженностью Н0 индуцируется диамагнитный кольцевой ток, который в свою очередь, вызывает возникновение внутреннего локального магнитного поля, направленного противоположно внешнему магнитному полю. Это локальное магнитное поле усиливает внешнее магнитное поле снаружи ароматического кольца и направлено против него внутри кольца:
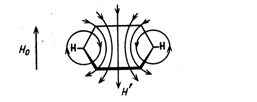
В результате все внешние протоны ароматического кольца дезэкранируются и вступают в резонанс при более низких значениях Н0, что означает смещение их сигналов в область более слабого поля.
Реакции электрофильного замещения.
В реакции электрофильного замещения (нитрование, сульфирование, галогенирование) нафталин вступает значительно легче бензола. При этом образуются в основном продукты а-замещения. Это обусловлено тем, что в а-положении нафталинового ядра выше электронная плотность и при атаке в а-положение образуется более стабильный ст-комплекс, чем в р-положении:

1. Нитрование.
Нафталин довольно легко нитруется нитрующей смесью с образованием в основном а-изомера:
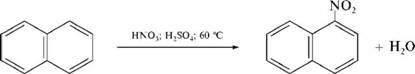
а-нитронафтапин
2. Сульфирование.
Для сульфирования нафталина используют концентрированную Н2804, причем в зависимости от температуры, при которой проводится реакция, получают а- или р-продукты замещения. При температуре 80 °С реакционной среды образуется а-нафталинсульфокислота, а при 160 °С — р-нафталинсульфокислота:
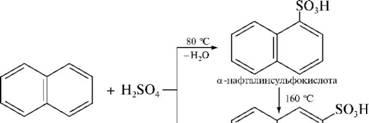
160 I
"Н2° ^ I ^
р -нафталинсульфокислота
При нагревании а-изомера до температуры 160 °С он полностью превращается в р-нафталинсульфокислоту.
3. Галогенирование. При температуре 90—110 °С в присутствии катализатора РеС13 нафталин хлорируется с образованием преимущественно а-хлорнафталина. Реакция протекает по механизму £_:
С1

+ НС1
а-хлорнафталин
положительного заряда будут вносить только структуры (II) и (III) (о-атака) и (VIII) и (X) (п-атака). В этом случае более выгодно мета-замещение, приводящее к образованию s-комплекса, в котором делокализация положительного заряда осуществляется с помощью трех структур (V)-(VII).
При наличии нескольких заместителей одного рода их общее влияние на скорость реакций SE усиливается. В случае удаления функциональной группы от ароматического кольца вдоль по углеродной цепи заместителя ее электронное и ориентирующее влияние на протекание реакций SE резко уменьшается. При несогласованной ориентации двух заместителей образуется сложная смесь продуктов, причем предпочтение отдается ориентирующему действию заместителя I рода.
|
ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ НА ОРИЕНТАЦИЮ В РЕАКЦИЯХ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ SE | ||
|
активирующие орто- и пара-ориентанты |
дезактивирующие орто- и пара-ориентанты |
дезактивирующие мета-ориентанты |
|
-O- , -OH , -OR , -NH2 , -NHR , -NR2 , -NHCOCH3 (+Mэфф ;-Iэфф) -Alk , -Ar (+Iэфф) |
-Cl, -Br, -I, -F (+Mэфф < -Iэфф) -СH=CHNO2 ,-CH2Cl, |
+ + -NH3 , -NR3 , -СF3 , -ССl3 (-Iэфф) ; -SO3H , -SO2R, -СOOH , -СOOR, -CONH2 , -СHO, -COR, -СN, -NO (-Iэфф ; -Mэфф) |
По силе влияния на связанное с ними бензольное ядро орто- , пара-ориентанты могут быть расположены в следующий ряд:
(ориентанты I рода)
-O- > -NR2 > -NHR > -NH2 > -OH > -OR > -Alk
По силе воздействия на связанное с ними ароматическое ядро заместители второго рода могут быть расположены в следующий ряд:
(ориентанты II рода)
+
- NR3 > -NO2 > -CCl3 > -SO3H > -COR > -CN > -COOH
Нафталин вступает в реакции электрофильного замещения легче, чем бензол. При этом заместитель обычно вступает в a-положение т.к. в этом случае возникает более энергетически выгодный s-комплекс, чем в b-положении. В первом случае s-комплекс стабилизируется перераспределением электронной плотности без нарушения ароматичности второго кольца, во втором случае такая стабилизация невозможна:
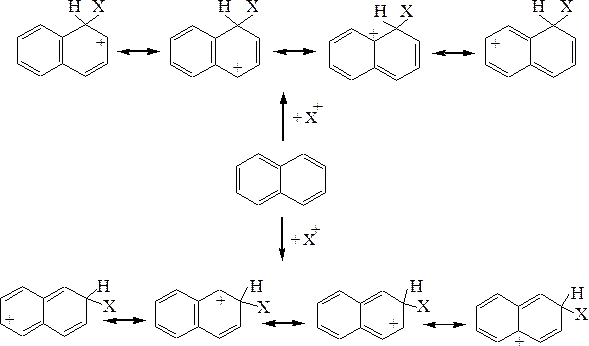
Если в одном из колец нафталина находятся пассивирующие его электроноакцепторные заместители (ориентанты II рода), то реакции SEидут по более активному незамещенному кольцу. Электронодонорные заместители (ориентанты I рода, кроме Hal), напротив активирует кольцо, в котором они находятся, и реакция SE протекают по замещенному кольцу.
IV.4. Окисление и восстановление
Окисление. Бензольное кольцо, в силу своей особой стабильности, устойчиво к действию большинства окислителей. Однако, алкильные группы, связанные с кольцом, легко окисляются под действием окислителей, таких как бихромат натрия в кислой среде, оксид хрома (VI) в уксусной кислоте или перманганат калия. В результате образуются продукты окислительной деструкции боковых цепей - ароматические карбоновые кислоты:
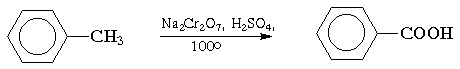
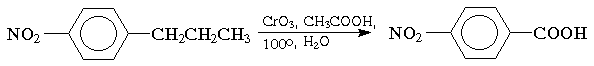
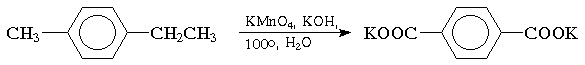
При окислении трехокисью хрома в уксусном ангидриде происходит окисление метильной группы алкиларенов до альдегидной; дальнейшему окислению до кислоты препятствует образование диацетата, который устойчив в этих условиях. Катализируемый кислотой гидролиз в водном спирте приводит к ароматическому альдегиду:
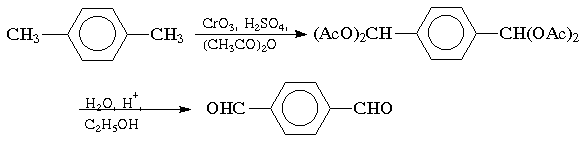
Бензиловые спирты гладко окисляются до альдегидов при применении в качестве окислителя свежеосажденной двуокиси марганца:
![]()
Окисление
конденсированных ароматических
углеводородов приводит к различным
продуктам в зависимости от используемого
реагента и условий реакции. Реагенты
на основе хрома (VI) в кислой среде окисляют
нафталин и алкилнафталины до нафтохинонов,
тогда как бихромат натрия в водном
растворе окисляет только алкильные
группы. Окисление нафталина перманганатом
калия в щелочной среде сопровождается
деструкцией одного ароматического
кольца с образованием моноциклических дикарбоновых
кислот: 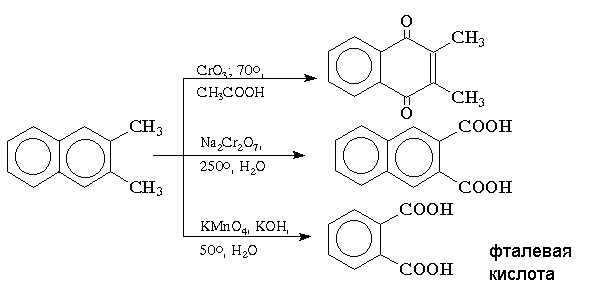
Антрацен гладко окисляется бихроматом натрия в серной кислоте или оксидом хрома (VI) в уксусной кислоте до антрахинона:
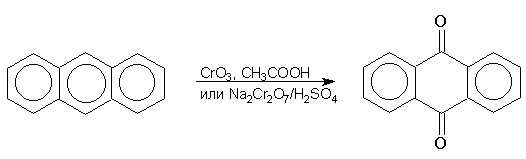
Гидрирование. Хотя ароматическое кольцо бензола гидрируется в значительно более жестких уловиях, чем двойная или тройная связь алкенов и алкинов, бензол и его производные могут быть прогидрированы до производных циклогексана над никелем Ренея (Т 120-150о и давление 100-150 атм). Более эффективны катализаторы платиновой группы, среди которых лучшими являются родий или рутений, нанесенные на окись алюминия.
При гидрировании диалкилбензолов на Rh или Ru обычно образуется в основном цис-изомер. Гидрирование на никеле Ренея не отличается стереоселективностью, всегда образуется смесь цис-,транс-изомеров. Каталитическое гидрирование бензольного кольца невозможно остановить на первой или второй стадии, поскольку циклогексадиены и циклогексены гидрируются с большей скоростью, чем ароматические соединения.
Восстановление по Берчу. Ароматическое кольцо аренов может быть восстановлено раствором натрия в жидком аммиаке в присутствие спирта как протонирующего агента. Бензол восстанавливается при этом до несопряженного циклогексадиена-1,4: (прим.44),
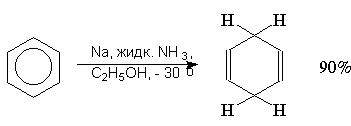
Для этой реакции предложен механизм, включающий последовательное образование анион-радикала, радикала и аниона циклогексадиена:


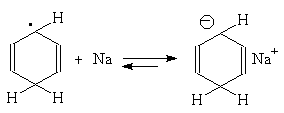
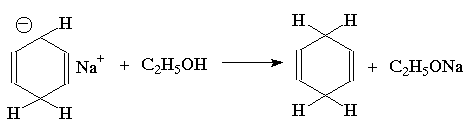
Влияние заместителей в бензольном кольце согласуется с приведенным выше механизмом: скорость восстановления возрастает при наличии электроноакцепторных заместителей и протонирование при этом происходит в положения 1- и 4- бензольного кольца; восстановление аренов с электронодонорными заместителями протекает медленнее, и протонируются положения 2- и 5-:
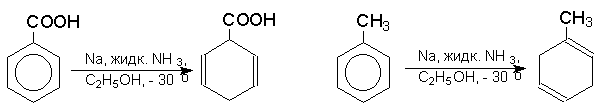
При восстановлении нафталина в подобных образуется 1,4-дигидронафталин:
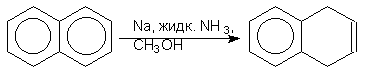
Замещенные
нафталины ведут себя подобно производным
бензола: при наличие в ![]() -положении
электроноакцепторной группы образуются
1,4-дигидропроизводные, а при наличии
электронодонорного заместителя -
5,6-дигидропроизводные
-положении
электроноакцепторной группы образуются
1,4-дигидропроизводные, а при наличии
электронодонорного заместителя -
5,6-дигидропроизводные
29.Практически все то,что и в 28ом вопросе
33.



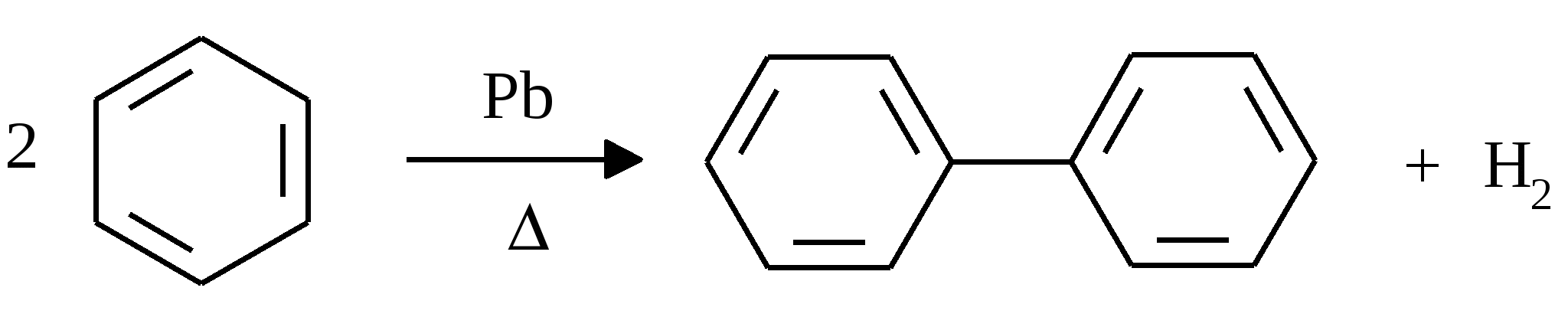
34. Дифенил.
Дифенил —
кристаллическое вещество с Т. пл. = 700C,
которое можно получить при пропускании
паров бензола через расплавленный
свинец.
Получение по реакции Вюрца — Фиттига
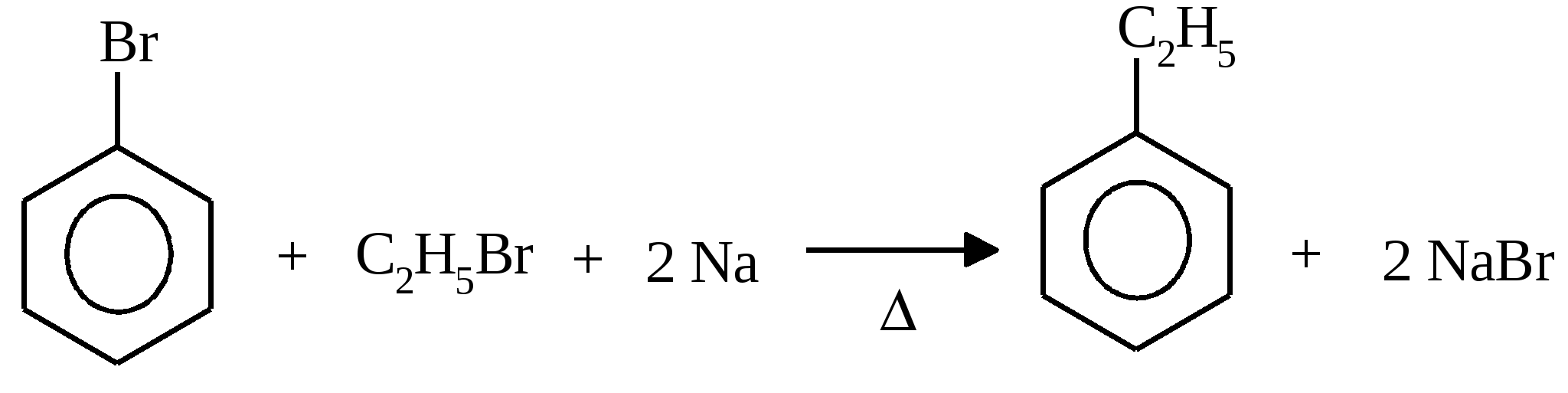
Дифенил, C6H5—C6H5, бесцветные кристаллы; tпл 171°С, tkип 254—255°С. Д. нерастворим в воде, хорошо растворим в органических растворителях; содержится в антраценовом масле, выделяемом из каменноугольной смолы. В промышленности его получают дегидрированием бензола при 750—800°С.
Д. — полупродукт в производстве некоторых красителей; в смеси с дифениловым эфиром (73,5%) применяется как высокотемпературный теплоноситель, известный под названием "даутерм"
Реакции дифенила
Бензольные кольца дифенила сопряжены и почти копланарны. Реакции SE идут поочередно в оба цикла:

Влияние заместителей на скорость и направление реакций SЕ.
Различные заместители меняют электронную плотность в бензольном кольце: увеличивают или уменьшают, причем она становится не одинаковой на различных атомах углерода. Это изменяет скорость реакций SЕ и делает её неодинаковой для различных положений цикла.
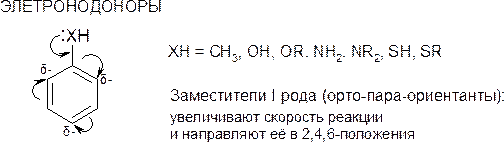

Электрофилом называют частицу, имеющую вакантную орбиталь, на которую может быть принята пара электронов для образования s-связи. По современным представлениям, реакция электрофильного замещения включает в себя два этапа. Сначала образуется p-комплекс электрофила с ароматическим кольцом, которое выступает в роли p-донора. p-Комплекс затем перерождается в катионный s-комплекс - частицу, содержащую один sp3-гибридный атом в кольце. При этом одна пара p-электронов превращается в связывающую пару новой экзоциклической s-связи. На этой стадии происходит разрушение ароматичности ядра, для чего требуется большая затрата энергии. Поэтому активационный барьер данной стадии чаще всего является максимальным на всей координате реакции, а сама стадия является лимитирующей. В отличие от s-комплекса, возникающего в реакциях ионного присоединения к алкенам, аренониевый у-комплекс стабилизирован посредством делокализации положительного заряда, который оказывается сосредоточенным в пара- и двух орто-положениях по отношению к реагирующему атому. Второй этап представляет собой обратный процесс - отрыв протона от s-комплекса с образованием конечного продукта. Это - стадия ароматизации, т.е. возрождение циклической p-электронной системы, она протекает при участии противоиона электрофила или частиц среды, которые отрывают и акцептируют протон.
Изменения энергетики частиц в процессе замещения в кольце бензола можно представить на графике энергетического профиля реакции SE2.
35. Классификация органических реакций и реагентов
План
Классификация по конечному результату.
Классификации по типу разрыва связей и типу реагента.
Последовательные реакции. Скорость-определяющая стадия процесса.
Параллельные реакции. Кинетический и термодинамический контроль.
Существуют разные системы классификации органических реакций, которые основаны на различных признаках. Среди них можно выделить классификации по конечному результату реакции и по механизму ее протекания.
Конечный результат реакции выражается стехиометрическим уравнением, которое отражает ее внешние признаки, например: образование одного нового соединения из двух или нескольких исходных, замещение одного фрагмента молекулы на другой, перераспределение связей между атомами в молекуле и т.д. По стехиометрическому результату различают:
реакции присоединения (символ Ad), например:
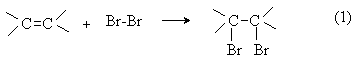
- реакции замещения (символ S), например:
R-H + Cl-Cl R-Cl + HCl (2)
Y- + R-X R-Y + X- (3)
реакции элиминирования (символ Е), например:
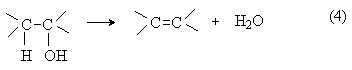
перегруппировки, например:
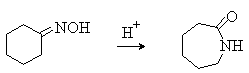
Классификация по конечному результату основана на формальных признаках, так как стехиометрическое уравнение, как правило, не отражает механизм реакции. Любая реакция состоит из элементарных актов химического взаимодействия. Простые реакции состоят из однотипных элементарных актов и включают одну элементарную стадию. Сложные реакции состоят из разнотипных элементарных актов и включают несколько элементарных стадий. Под механизмом реакции понимают совокупность элементарных стадий, через которые протекает реакция, и характер этих стадий (способ разрыва и образования связей, природа реагентов и интермедиатов).
Элементарные реакции в зависимости от типа разрыва связей делят на три основные типа.
Гетеролитические реакции - реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов.
A : B A: + B
В ходе таких реакций часто образуются ионные интермедиаты (промежуточные частицы) – карбокатионы и карбоанионы, например:
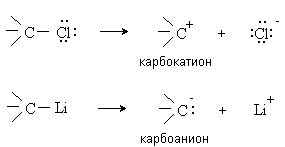
Карбкатионы представляют собой положительно заряженные частицы с тремя заместителями при центральном атоме углерода, имеющем одну вакантную несвязывающую орбиталь. Карбанионы – отрицательно заряженные частицы с тремя заместителями при центральном атоме углерода, имеющем несвязывающую орбиталь с парой электронов.
Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону.
A : B A + B
В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например:

Синхронные реакции – это особый тип реакций, в которых разрыв старых и образование новых связей происходят одновременно за счет согласованного перемещения электронов в циклическом комплексе. Примером таких реакций может служить реакция Дильса-Альдера:

Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат. При этом считается, что реагент атакует субстрат. Субстратом, как правило, считают молекулу, которая предоставляет атом углерода для новой связи. Например, в реакции (1) алкен является субстратом, а молекула брома реагентом. По типу реагента реакции делятся на электрофильные (Е), нуклеофильные(N) и радикальные (R).
В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой или анионом (Hal-, OH-, RO-, RS-, RCOO-, R-, CN-, H2O, ROH, NH3, RNH2 и др.). Все нуклеофилы – основания Льюиса. Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т.е. с частичным или полным положительным зарядом). При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ SN) у насыщенного атома углерода:
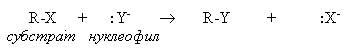
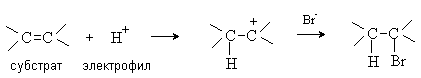
В электрофильных реакциях атакующий реагент (электрофил) имеет вакантную орбиталь и является нейтральной молекулой или катионом (Cl2, SO3, BF3, H+, Br+, R+, NO2+, и др.). Все электрофилы – кислоты Льюиса. Электрофил атакует в субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад, а образование новой связи происходит за счет пары электронов субстрата. Пример электрофильной реакции – электрофильное присоединение (символ AdE) к С=С связи:
В радикальных реакциях реагент имеет неспаренный электрон и является свободным радикалом (Cl , R и др.). В ходе радикальных реакций связь в субстрате разрывается гомолитически, а новая связь образуется за счет неспаренного электрона свободного радикала и одного из электронов старой связи. Примером радикальных реакций может служить радикальное замещение (символ SR) в алканах:
R-H + Cl R + HCl
R + Cl-Cl R-Cl + Cl
В зависимости от числа частиц, участвующих в элементарных реакциях, различают мономолекулярныеи бимолекулярные реакции. Часто разные способы классификации используют в сочетании друг с другом. Например, далее будут рассмотрены реакции мономолекулярного и бимолекулярного нуклеофильного замещения (символы SN1 и SN2), мономолекулярного и бимолекулярного элиминирования (символы Е1 и Е2 ) и др.
Лишь незначительное число органических реакций являются элементарными. Большинство из них являются сложными и состоят из нескольких последовательных или параллельных элементарных стадий.
В последовательных реакциях продукт одной элементарной реакции является исходным веществом для другой, например:
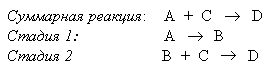
В ходе таких реакций образуются промежуточные соединения (интермедиаты), которые не входят в суммарное уравнение. В приведенной реакции таким интермедиатом является В. Интермедиаты в органических реакциях – это, как правило, высокореакционноспособные частицы – карбокатионы, карбоанионы, свободные радикалы. Энергетическая диаграмма реакции, протекающей через образование интермедиата представлена на рисунке.

Энергетическая диаграмма содержит два максимума, которые соответствуют переходным состояниям Х1 и Х2. Образование интермедиата В протекает через переходное состояние Х1, которому соответствует достаточно высокая энергия активации Еа1. Благодаря высокой реакционной способности интермедиат В с небольшой энергией активации Еа2 (переходное состояние Х2) превращается в стабильный конечный продукт D. Таким образом, стадия образования интермедиата является медленной (лимитирующей) и определяет скорость процесса в целом.
Выделение в механизме реакций скорость-определяющей стадии имеет принципиальное значение, поскольку все факторы, влияющие на эту стадию, аналогичным образом влияют на скорость реакции в целом. При оценке влияния различных факторов на скорость реакции оценивают их влияние на энергии исходного и переходного состояний скорость-определяющей стадии. Факторы,стабилизирующие переходное состояние в большей степени, чем исходное, уменьшают энергию активации и увеличивают скорость реакции, и наоборот. Переходные состояния имеют практически нулевое время жизни, поэтому их структуру нельзя определить экспериментально. Она может быть оценена теоретически, путем сравнения их с реальными частицами, близкими к ним по энергии. Такими частицами могут быть интермедиаты, которые можно рассматривать как модели переходных состояний.
В параллельных (конкурирующих) реакциях из одних и тех же реагентов образуются разные продукты.
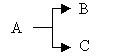
Энергетическая диаграмма такого процесса приведена на рисунке.

Состав продуктов конкурирующих реакций может зависеть от относительных скоростей их образования (кинетический контроль) или от их относительной термодинамической стабильности (термодинамический контроль).
Если обе конкурирующие реакции необратимы, то состав продуктов определяется относительной скоростью их образования (кинетический контроль). Тогда в рассмотренной выше реакции будет преобладать продукт С, так как его образованию предшествует переходное состояние с меньшей энергией.
Если хотя бы одна из конкурирующих реакций обратима, то соотношение продуктов может быть иным. Если остановить реакцию задолго до достижения равновесия, то реакция будет подчиняться кинетическому контролю и основным ее продуктом будет вещество С. Если же довести процесс до состояния равновесия, то в реакционной смеси будет преобладать термодинамически более устойчивый продукт В. В этом случае реакция подчиняется термодинамическому контролю. На рисунке приведен случай несовпадения кинетического и термодинамического контроля продуктов реакции. Возможен случай, когда термодинамически устойчивый продукт образуется с большей скоростью, т. е. является и кинетически, и термодинамически контролируемым.
Реагирующие органические частицы
Два типа разрыва ковалентной связи - гомолитический и гетеролитический - обуславливают три основных, наиболее часто встречающихся типа частиц в химических реакциях органических соединений: свободные радикалы, электрофилы, нуклеофилы.
Свободные радикалы
Свободные радикалы – это электрически нейтральные частицы, имеющие неспаренный электрон, образующиеся при, гомолитическом разрыве ковалентной связи. Частицы, имеющие два неспаренных электрона, называют бирадикалами. Наличие неспаренного электрона приводит к тому, что свободные радикалы парамагнитны. Неспаренный электрон может принадлежать как атому углерода, так и другому атому (гетероатом), например, азоту, кислороду, сере, галогенам и т. д. Устойчивость радикалов определяется возможностью делокализации неспаренного электрона и уменьшается в ряду:
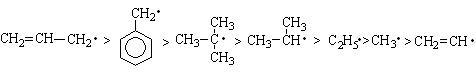
Радикалы, имеющие неспаренный электрон на более электроотрицательном атоме, какправило, более устойчивы, например:
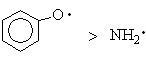
Свободные радикалы — химически активные частицы, поэтому выделить их удается только в отдельных случаях, когда они стабилизированы сопряжением, экранированы объемными заместителями.
Электрофилы
Электрофилами называют частицы, являющиеся акцепторами электронов. Электрофилами могут быть как положительно заряженные, и нейтральные частицы, имеющие атом с вакантной орбиталью (кислоты Льюиса). Положительный заряд положительный заряд частицы может располагаться на атоме углерода или гетероатоме (водороде, азоте, кислороде и т.д.). Если заряд (+) располагается на атоме углерода, то частица называется карбокатионом. Карбокатионы часто являются промежуточными частицами в химических реакциях. Устойчивость карбокатионов зависит от делокализации положительного заряда, т.е. от положительных эффектов (+М и +I) со стороны групп, связанных с содержащим заряд атомом, например, в следующем ряду устойчивость уменьшается слева направо:
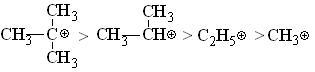
Ниже приведены типичные электрофильные частицы:
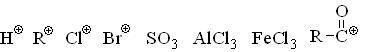
Нуклеофилы
Нуклеофилами называют частицы, являющиеся донорами электронов. Донорами электронов могут служить отрицательно заряженные ионы и нейтральные частицы, имеющие атом с неподеленной парой электронов (основания Льюиса). Отрицательный заряд отрицательно заряженной частицы может локализоваться на атоме углерода или гетероатоме (водороде, азоте, кислороде, галогене). Если заряд (-) локализован на атоме углерода, то такая частица называется карбанионом.На устойчивость карбанионов влияет сопряжение, индуктивный, мезомерный эффекты, электроотрицательность и состояние гибридизации отрицательно заряженного атома.Устойчивость карбанионов уменьшается в следующем ряду слева направо:
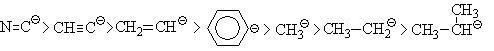
Ниже приведены типичные нуклеофильные частицы:
![]()
Наряду со свободными радикалами, электрофилами инуклеофилами в химических реакциях органических соединий встречаются и менее распространенные частицы, такие, как карбены, катион-радикалы, анион-радикалы.
39. РАЗЛИЧНЫЕ ТИПЫ БОЛЕЕ СЛОЖНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ:
с двумя одинаковыми (диоксан), или различными (тиазол, оксазин) гетероатомами. Биядерные соединения: с конденсированными (индол) или разделенными циклами (бипиридил). Краун-эфиры – соединения с крупными циклами (макроциклические).
