
- •13.Использование мутационных дефектов регуляции микробного метаболизма с целю получения сверхпродуцентов бав.
- •14. Способы выделения мутантных штаммов с дефектами метаболитической регуляции.
- •15. Влияние проницаемости клеточных мембран на контроль микробного метаболизма.
- •18. Биохимические механизмы потребления углеводов. Их регуляция.
- •19. Ассимиляция н-алканов микроорганизмами.
- •20. Биохимические механизмы утилизации ароматических углеводородов.
- •25. Биохимические механизмы потребления метана,метанолы,формальдегида:ростовая модель.
15. Влияние проницаемости клеточных мембран на контроль микробного метаболизма.
Клеточная мембрана представляет собой двойной слой (бислой) молекул класса липидов, большинство из которых представляет собой так называемые сложные липиды-фосфолипиды. Молекулы липидов имеют гидрофильную («головка») и гидрофобную («хвост») часть. При образовании мембран гидрофобные участки молекул оказываются обращены внутрь, а гидрофильные -- наружу. Мембраны - структуры инвариабельные, весьма сходные у разных организмов. Некоторое исключение составляют, пожалуй, археи, у которых мембраны образованы глицерином и терпеноидными спиртами. Толщина мембраны составляет 7-8 нм.
Биологическая мембрана включает и различные белки: интегральные (пронизывающие мембрану насквозь), полуинтегральные (погруженные одним концом во внешний или внутренний липидный слой), поверхностные (расположенные на внешней или прилегающие к внутренней сторонам мембраны). Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки, и клеточной стенкой (если она есть) снаружи. Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Питательные вещества проникают в клетку несколькими способами.
1. Пассивная диффузия, т.е. перемещение веществ через толщу мембраны, в результате чего выравниваются внутренняя концентрация веществ и осмотическое давление по обе стороны оболочки. Таким путем могут проникать питательные вещества, когда концентрация в среде значительно превышает концентрацию веществ в клетке.
2. Облегченная диффузия – проникновение питательных веществ в клетку с помощью активного переноса их особыми молекулами – переносчиками, называемыми пермеазами. Это вещества ферментной природы, которые локализованы на цитоплазматической мембране и обладают специфичностью. Каждая пермеаза адсорбирует соответствующее питательное вещество на наружной стороне цитоплазматической мембраны, вступает с ним во внутреннюю связь и диффундирует через мембрану, отдавая на внутренней стороне транспортируемое ею вещество в цитоплазму. Этот процесс совершается без использования энергии, так как перемещение веществ происходит от более высокой концентрации к более низкой.
3. Активный транспорт питательных веществ осуществляется также с помощью пермеаз, но этот процесс требует затраты энергии. В этом случае питательное вещество не может проникнуть в клетку, если концентрация его в клетке значительно превышает концентрацию в среде.
4. В ряде случаев транспортируемое вещество может подвергаться химической модификации, и такой способ переноса веществ получил название переноса радикалов или транслокации химических групп. По механизму передачи транспортируемого вещества этот процесс сходен с активным транспортом.
Выход веществ из микробной клетки осуществляется или в виде пассивной диффузии, или в процессе облегченной диффузии с участием пермеаз.
16. Метаболитическая регуляция гликолиза и глюконегенеза. Регуляция гликолиза1. Регуляция активности гексокиназы. Гексокиназа катализирует процесс превращения глюкозы в глюкозо-6-фосфат. Активность гексокиназы аллостерически ингибируется продуктом реакции – глюкозо-6-фосфатом.2. Регуляция активности фосфофруктокиназы. Фосфофруктокиназа катализирует превращение фруктозо-6-фосфата и АТФ во фруктозо-1,6-дифосфат и АДФ. Активность фосфофруктокиназы аллостерически ингибируется конечным продуктом гликолиза в целом – АТФ. Это ингибирование снимается, когда возрастает концентрация АДФ или АМФ. Цитрат (ионизированная форма лимонной кислоты) является аллостерическим ингибитором активности фосфофруктокиназы. Фруктозо-2,6-дифосфат (именно -2,6-, а не 1,6-) аллостерический активатор активности фосфофруктокиназы.3. Регуляция активности пируваткиназы. Высокие концентрации ацетил-КоА, АТФ, длинноцепочечных жирных кислот аллостерически ингибируют активность пируваткиназы. сАМФ («с» значит «циклический») может действовать и как ингибитор, и как активатор активности пируваткиназы. Фруктоза-1,6-дифосфат повышает активность пируваткиназы.Итог: суть регуляции гликолиза в следующем – большое содержание в клетке высокоэнергетических молекул таких как АТФ и продуктов расщепления глюкозы (ацетил-КоА, цитрат) свидетельствует о том, что в клетке достаточно энергии и расщепление глюкозы надо замедлить. Недостаточный запас энергии в клетке сопровождается большим содержанием АМФ и малым АТФ и вызывает активацию гликолиза для увеличения выработки энергии.
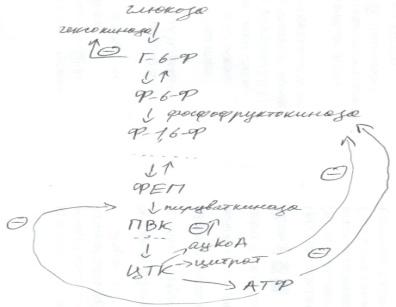

Эффект Пастера: этот эффект также относится к регуляции гликолиза. Суть этого явления в том, что при переходе с дыхания на брожение сильно повышается активность регуляторных ферментов гликолиза, что приводит к увеличению потребления глюкозы и ускорению хода гликолиза в целом. Причина ускорения гликолиза при этом вызвана тем, что при дыхании расщепление одной молекулы глюкозы даёт 32 молекулы АТФ, а при брожении расщепление одной молекулы глюкозы даёт только 2 молекулы АТФ, поэтому для поддержания содержания АТФ на достаточно высоком уровне при брожении приходится потреблять в 16 раз больше молекул глюкозы.
Регуляция глюконеогенеза1. Регуляция активности пируваткарбоксилазы. Ацетил-КоА аллостерически повышает активность пируваткарбоксилазы.2. Регуляция активности фруктозо-1,6-бифосфатазы. АМФ и фруктозо-2,6-дифосфат (не -1,6-) аллостерически ингибируют активность фруктозо-1,6-бифосфатазы.Итог: суть регуляции глюконеогенеза в следующем – высокое содержание продуктов расщепления глюкозы (ацетил-КоА) свидетельствует о том, что в клетке достаточно энергии и её можно направить на синтез глюкозы с помощью глюконеогенеза. Недостаточный запас энергии в клетке сопровождается большим содержанием АМФ и указывает на то, что энергию надо синтезировать, а глюконеогенез – замедлить, т.к. он протекает с затратой энергии. Такой способ регуляции называется реципроктной регуляцией и он заключается во взаимосвязи регуляции взаимопротивоположных путей.

17.Элементы методологии генной инженерии. С начала 1970-х гг., когда появилась первая публикация о получении in vitro рекомбинантной ДНК, возникла новая наука — генная инженерия. Ее основные направления — создание трансгенных животных и растений и разработка принципов генной терапии. Генетическая инженерия - это комплекс молекулярно-генетических или клеточных методов, которые позволяют создавать нужные (для эксперимента или производства) генетические программы избранных организмов. В том случае, когда манипуляции идут на уровне отдельных генов или на их частях, говорят о генной инженерии. В зависимости от задач можно указать на следующие уровни приложения методов биотехнологического и общего генетико-инженерного: 1) молекулярный, когда дело касается отдельных частей генов; 2) генный; 3) хромосомный; 4) уровень плазмид; 5) клеточный; 6) тканевый; 7) организменный и 8) популяционный.В задачу генетической инженерии входит решение трех основных задач: 1) конструирование функционально активных генетических структур в виде рекомбинантных ДНК, пригодных для переноса в другие клетки; 2) разработка методов введения рекомбинантных ДНК в клетку; 3) создание условий для нормальной экспрессии генов, введенных в данную клетку. Организмы, полученные в результате внедрения чужеродного генетического материала, называют трансгенными. Технологии, возникшие на основе методов молекулярной генетики, используются в самых разнообразных областях, таких как диагностика наследственных заболеваний у человека и животных, криминалистика и этнография, производство хозяйственно ценных и биологически активных веществ, получение штаммов микроорганизмов, трансгенных животных и растений с заданными свойствами, клонирование целых организмов, органов или отдельных клеток.Генетическая инженерия на клеточном, хромосомном уровнях и при помощи суммарной ДНК обеспечивает неконтролируемый во время переноса переход генов от одной клетки к другой. Методы генной инженерии отличаются тем, что они обеспечивают контролируемое внедрение индивидуальных избранных генов. Эти методы основываются на возможностях выделения отдельных генов и затем их внедрения в клетку реципиента, в первую очередь с помощью гибридных молекул — векторов.Имеется ряд способов выделения генов. Среди них основными являются: 1) ферментативный синтез генов; 2) химический синтез генов; 3) выделение генов с помощью ферментов рестрикции. 1. Ферментативный синтез гена.В пробирке происходит транскрибирование нити ДНК на молекулах иРНК от данного индивидуального гена, который выделяется из клетки. При наличии фермента обратной транскриптазы происходит транскрибирование молекул ДНК с матриц молекул иРНК. Синтезированные гены, полученные с помощью обратной транскриптазы, не имеют в своем составе регуляторных частей (промотора и др.) и не содержат модифицированных оснований, в результате чего они функционально неактивны. Поэтому желательно иметь матрицы РНК не только со структурными, но и с регуляторными частями генов в виде так называемой про-мРНК. 2. Химический синтез генов.Химический синтез гена впервые осуществил в 1970 г. Гобинд Хорана (США). В лаборатории этого ученого удалось химическим путем связать 77 дезоксирибонуклеотидов в цепочку ДНК, комплементарную к аланиновой транспортной РНК (г-РНК) пекарских дрожжей. Отрезки цепочки соединялись встык с помощью фермента лигазы. Две синтезированные нити соединялись химическими связями в спирализованную двутяжевую структуру. Такой искусственно созданный биополимер и стал геном аланиновой т-РНК, содержащейся в геноме дрожжей.Химический синтез гена технически очень труден и требует знания его нуклеотидной структуры.3. Выделение генов с помощью ферментов рестрикции.Выделение фрагментов ДНК в хромосомах, несущих гены с необходимыми свойствами, производят с помощью вырабатываемых клетками бактерий ферментов рестрикции (рестриктаз).В клетках кишечной палочки и других бактерий были обнаружены ферменты, разрезающие на куски ДНК вирусов и других фагов (там где расположены специфические последовательности нуклеотидов), и тем самым защищающие клетку от разрушения. Рестриктазыраспознают в ДНК специфичные для них участки длиной в 4-6 пар нуклеотидов и разрезают обе цепи ДНК посередине этих участков или с некоторым смещением. В первом случае образуются обрывки с ровными (тупыми) концами, во втором - стороны оборванных цепочек ДНК чуть-чуть заходят одна за другую. Такие концы называются липкими, они могут слипаться между собой в силу комплиментарности.Две совершенно не схожие между собой последовательности ДНК (например, слона и лягушки) образуют одинаковые липкие концы, если эти ДНК обработать одной и той же рестриктазой. В настоящее время известно более 500 рестриктаз, способных рубить ДНК в 120 различных последовательностях. Это дало возможность получать фрагменты ДНК, содержащие желаемые гены. При наличии выделенного гена его надо доставить в клетку, наследственность которой предстоит изменить. Основным способом такой доставки служит использование рекомбинантных молекул ДНК плазмид. Рекомбинантными, или гибридными, плазмидами называют их искусственные формы, сочетающие или гены от разных плазмид, или плазмиды, несущие гены, выделенные из хромосом прокариот или эукариот. Рекомбинантная плазмида с включенным в нее участком чужеродной ДНК становится «плазмидным вектором». Введение в клетку и последующее размножение рекомбинантной плазмиды обеспечивают клонирование приобретенного ею чужеродного фрагмента ДНК. В качестве векторов используется ряд природных плазмид, а также векторы, искусственно сконструированные с помощью рестриктаз и лигаз. Скрепить липкие концы помогает ДНК-лигаза,сшивающая фосфодиэфирные связи. Современная методология создания промышленного штамма – запрогромированная реорганизация генома микроорганизма, только ее применение может обеспечивать решение все возрастающих задач промышленной биотехнологии. Сегодня биотехнологи добились огромных успехов в технике изоляции генов, их модификации in vitro, внедрении в чужеродные, бвстро растущие микроорганизмы проявление. Техника генетической инженерии достаточно подробно описана в ряде отечественных и зарубежных обзоров. Тем не менее применение генетических манипуляций с целью конструирования промышленных штаммов сверхпродуцентов все еще имеет ряд ограничений из-за: а)недостаточного знания путей биосинтеза многих метаболитов, особенно путей регуляции активности генов соответствующих ферментов, б) недостаточной разработки методов генетического обмена и систем клонирования промышленно важных микроорганизмов. Техника генетической манипуляции (рекомбинации) такова: 1) введение в векторные молекулы обладающие собственным аппаратом репликации – плазмиды или фаги, - фрагмента гена чужеродной ДНК, в том числе ДНК высших эукариот;2) трансформация гибридной (рекомбинантной) плазмиды в клетку бактерии – хозяина (реципиента); 3) клонирование, т.е. выделение бактерий, включивших вектор; 4) размножение этих бактерий. Все это трудоемкие, прецензионные операции, но достаточно хорошо освоенные молекулярными биологами. Основная трудность конструирования штаммов-продуцентов белков человека связана часто с тем, что выход белка оказывается немного ниже ожидаемого. Ряд причин объясняет это несоответствие: токсичность некоторых белковдля микробной клетки, нестабильность тРНК и активный протеолиз белков. Последний снижают введением мутаций в гены, кодирующие синтез протеаз, или введением в состав гибридной плазмиды функционирующего гена pin (proteolys inhibition) фага Т4, кодирующего образование ингибитора протеолиза. Используя клонирование гибридных ДНК, получают терапевтические препараты – соматостатин (гормон роста), инсулин и интерферон.
