
fizicheskij_praktikum_zubkov
.pdfиспользуется в терапии, например, действие некоторых сильных слабительных основано на создании в желудочном тракте повышенной концентрации растворенного вещества и осмоса в него воды.
Клетки животных и растений содержат растворы солей и других осмотически активных веществ(для которых проницаемость биологической мембраны меньше, чем для воды).
Если клетку поместить вгипотонический раствор, то объем клетки увеличится за счет осмоса воды в клетку.
Вгипертоническом растворе объем клетки уменьшается вследствие осмоса воды из клетки.
Визотоническом растворе объем клетки не меняется, так как не происходит осмоса.
Помещая клетки в растворы различных веществ(гипертонические или гипотонические по отношению к внутриклеточной жидкости), по изменению размеров клетки можно сделать вывод о непроницаемости или проницаемости мембраны для растворенного вещества и для воды. Если наблюдается осмотический эффект, мембрана непроницаема (или плохо
проницаема) для растворенного вещества и хорошо проницаема для растворителя.
17.1.5.Осмотический гемолиз
Осмотический |
гемолиз |
эритроцитов– разрушение |
клеток |
|
эритроцитов |
при помещении их |
в гипотонический раствор |
вследствие |
|
того, что эритроциты набухают и лопаются в результате осмоса. Изучение |
||||
кинетики |
гемолиза |
используется |
в качестве диагностического теста |
|
некоторых патологий. |
|
|
|
|
17.1.6. Турбидиметрия
Турбидиметрия и нефелометрия – методы, основанные на изучении рассеяния света при прохождении его через исследуемую дисперсную среду (рис. 17.4).
191

Рис. 17.4. Рассеяние света
при прохождении через дисперсную среду
Изучение |
рассеивающей |
среды, основанное |
на |
|
исследовании |
||||
рассеянного |
света: его |
интенсивности Iр, спектра, |
поляризации и т.д |
||||||
называется |
нефелометрией |
(от |
греческого нефелос |
– |
облако). |
||||
Нефелометрия дает возможность определять концентрацию, размер, форму |
|||||||||
диспергированных частиц в дисперсных системах. |
|
|
|
||||||
Турбидиметрия |
(turbidia |
– |
мутный) |
основана |
на |
измерении |
|||
интенсивности |
прошедшего светаI |
= I0 – Ip, |
ослабленного |
вследствие |
|||||
рассеяния. |
|
|
|
|
|
|
|
|
|
Характеристикой светорассеяния в этом методе служит коэффициент |
|||||||||
рассеяния s (рис. 17.4) или оптическая плотность суспензии: |
|
|
|||||||
|
D = lg |
I0 |
= 0,43sl. |
|
(17.1) |
|
|
|
|
|
|
||||
|
|
I |
|
|
|
|
|
Коэффициент рассеяния, а окончательно, и оптическая плотность |
|
||||||
зависят от размера частиц и их формы, от длины волны света, от |
|
||||||
концентрации частиц. |
|
|
|
|
|
|
|
Коэффициент |
рассеивания |
и |
оптическая |
плотность |
прямо |
||
пропорциональны концентрации суспензии: |
|
|
|
||||
|
D = An, |
|
|
(17.2) |
|
||
где А – коэффициент, не зависящий от концентрации. |
|
|
|||||
Установлено, что с увеличением длины волныl |
коэффициент |
|
|||||
рассеяния и оптическая плотность среды уменьшаются. |
|
|
|||||
17.1.7. Пассивный и активный транспорт
Перенос массы вещества, или диффузия, является основным механизмом пассивного транспорта. Диффузия – самопроизвольный процесс проникновения вещества из области большей в область меньшей его концентрации в результате теплового хаотического движения молекул.
192

Процесс диффузии количественно описан Фиком. Первый закон Фика отражает факт, что плотность потока вещества Ф в направлении оси х пропорциональна градиенту концентрации:
|
|
|
Ф = -D |
dC |
, |
|
|
|
|
|
|
(17.3) |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
dx |
|
|
|
|
||||
где D – коэффициент |
диффузии, равный u |
|
|
/ 3 (u |
– |
средняя |
скорость |
||||||
|
l |
||||||||||||
движения |
|
|
– средняя длина их |
свободного побега). Знак |
|||||||||
молекул, l |
|||||||||||||
«минус» |
в выражении (17.3) |
означает, что |
поток |
направлен против |
|||||||||
градиента dC/dx, т.е. от большей концентрации к меньшей. |
|
||||||||||||
В |
случае стационарной |
диффузии(при |
dC/dx |
= const) |
молекул |
||||||||
вещества через тонкую мембрану(т.е. при наличии установившегося потока частиц через некоторую проницаемую перегородку, разделяющую две области раствора с различными концентрациями) традиционно для описания процесса диффузии используется уравнение:
Ф = Р(С2 – С1), |
(17.4) |
||
где C1 и С2 – концентрации вещества в растворе по обе стороны мембраны, |
|||
причем С2 > C1; P – проницаемость мембраны, которая |
связана с |
||
коэффициентом диффузии D уравнением: |
|
||
P = |
DK |
, |
(17.5) |
|
|||
|
l |
|
|
где l – толщина мембраны, К – коэффициент распределения диффундирующего вещества между мембраной и водной фазой, равный отношению концентрации вещества внутри мембраныС (вблизи ее поверхности, но с внутренней стороны мембраны) и концентрации С вещества в омывающем мембрану растворе (индексы 1 и 2 приписываются разным сторонам мембраны):
|
K = |
Cм1 |
= |
|
См 2 |
. |
|
||||
|
|
|
|
||||||||
|
|
|
С1 |
|
|
С 2 |
|
||||
Так как по определению |
|
|
|
|
|
|
|
|
|||
|
|
Ф = |
|
Dm |
, |
(17.6) |
|||||
|
|
||||||||||
где S – площадь поверхности |
|
DtS |
|
|
|
||||||
мембраны, перенос массы |
вещества в |
||||||||||
единицу времени описывается уравнением: |
|
||||||||||
|
Dm |
= PS(C |
2 |
|
- C ). |
(17.7) |
|||||
|
|
|
|||||||||
|
Dr |
|
|
|
|
1 |
|
||||
|
|
|
|
|
|
|
|
|
|||
193

Из этого уравнения следует, что |
|
|
проницаемость Р – физическая |
|
|||||||
величина, |
численно |
равная массе |
|
вещества, прошедшего в единицу |
|
||||||
времени |
через |
единичную |
|
площадку |
мембраны |
при |
разнос |
||||
концентраций вещества с обеих ее сторон, равной 1. |
|
|
|
||||||||
Следовательно, константа проницаемости характеризует скорость |
|
||||||||||
прохождения молекул вещества через мембрану. При измерении скорости |
|
||||||||||
диффузии вещества Dm/Dt в мг/с, |
|
|
|
|
|
2 |
|
|
|||
площади мембраны в м, концентрации |
|
||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
вещества в мг/м, Р измеряется в м/.сР зависит от свойств мембраны, |
|
||||||||||
размеров и формы диффундирующих частиц, а также от температуры. |
|
||||||||||
Скорость изменения концентрации вещества определяется вторым |
|
||||||||||
законом Фика: |
|
¶C |
|
¶2C |
|
|
|
|
|||
|
|
|
= |
. |
|
(17.7) |
|
||||
|
|
|
¶t |
¶x |
2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
Уравнение (17.7) описывает изменение концентрации вещества в растворе в результате диффузии в зависимости от координаты х и времени t.
Более общий случай пассивного транспорта – частиц электродиффузия ионов, при которой происходит перенос вещества и перенос заряда. Движущей силой электродиффузии служит разность электрохимических потенциалов данного вещества в двух областях, между которыми происходит диффузия ионов, или градиент электрохимического потенциала.
Электрохимический потенциал равен:
m |
= m0 + RT ln C + zFj, |
(17.8) |
где m0 – стандартный химический потенциал, характеризующий сродство иона к растворителю; R – универсальная газовая постоянная; Т – абсолютная температура; z – валентность, или заряд иона в единицах элементарного заряда; F – заряд моля одновалентных ионов(число Фарадея); j – электрический потенциал.
В целом электрохимический потенциал является мерой работы, необходимой для синтеза1 моля вещества из исходных компонентов и помещения его в данный растворитель(m0) для создания концентрации С этого вещества в растворе (RTlnC) и переноса зарядов из бесконечности в электрическое поле раствора(zFj). Изменение электрохимического потенциала ( Dm ), равное
194

æ |
C2 |
ö |
+ zF (j1 |
-j2 ), |
|
||
|
|
ç |
÷ |
(17.9) |
|||
|
|
||||||
|
|
|
|||||
Dm = (m02 - m01 ) + RT lnç C |
÷ |
||||||
è 1 |
ø |
|
|
|
|||
отражает изменение химической, осмотической и электрической энергии биосистемы (первое, второе и третье слагаемые, соответственно) при переходе из состояния 1 в состояние 2 по другую сторону мембраны.
Плотность потока энергии определяется уравнением Теорелла:
Ф = -Сu |
d |
m |
, |
(17.10) |
|
|
|||
|
dx |
|
||
где u – подвижность ионов (u характеризует скорость движения частиц под действием внешней силы), dm / dx – градиент электрохимического потенциала, С – молярная концентрация частиц в растворе (кмоль/м3). Знак «минус» указывает на то, что поток направлен в сторону убывания m.
Учитывая, что при электродиффузии ионов через мембрану не изменяется их химическое сродство к окружающей среде(растворителю),
т.е. Dm0 = m02 |
|
– m01 |
= 0, и подставляя в уравнение Теорелла |
значение |
|||||
производной |
d |
m |
/ dx, |
получим электродиффузионное уравнение |
Нернста- |
||||
Планка: |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ф = -uRT |
dC |
- CuzF |
dj |
. |
(17.11) |
|
|
|
|
dx |
|
||||
|
|
|
|
|
|
dx |
|
||
Первый член в правой части уравнения (17.11) описывает свободную диффузию (первый закон Фика, если считать, что u = D/(RT)), второй выражает миграцию ионов в электрическом поле.
17.1.8. Виды диффузии
Существует несколько возможных механизмов пассивного переноса веществ (включая ионы) через биомембраны (рис. 17.5):
• простая диффузия через липидный слойобеспечивает прохождение кислорода и углекислого газа, ряда лекарственных веществ и ядов.
• |
перенос через |
канал(пору) осуществляется |
через |
сквозной |
||
канал, |
образованный |
интегральными |
белками |
и |
|
избирательно |
пропускающий те или иные ионы. |
|
|
|
|
||
• |
облегченная диффузия – транспорт в |
комплексе |
с подвижным |
|||
переносчиком (молекула |
переносчика – ионофора захватывает |
ион, |
||||
образует растворимый в липиде комплекс и проходит через мембрану), а
195
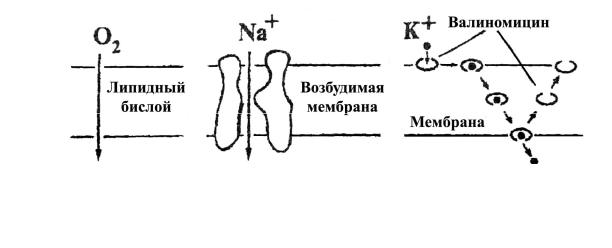
также за счет эстафетной передачи вещества от одного фиксированного в мембране переносчика к другому.
а) |
б) |
в) |
Рис. 17.5. Перенос веществ через биомембраны:
а) простая диффузия; б) перенос через канал; в) облегченная диффузия
В последнем случае(облегченная диффузия) по мере заполнения
свободных |
переносчиков |
наблюдается |
эффект |
концентрационного |
|||
насыщения скорости переноса. |
|
|
|
|
|
||
Разновидностью |
облегченной |
диффузии |
является |
обменная |
|||
диффузия, |
когда |
переносчик, |
освобождаясь |
от |
молекулы |
||
диффундирующего вещества на противоположной стороне мембраны, захватывает другую молекулу этого же вещества и возвращается обратно. Такой механизм переноса обеспечивает неизменность концентраций диффундирующего вещества по обе стороны мембраны.
Все эти виды пассивного переноса веществ описываются общим уравнением диффузии (17.11).
|
|
|
17.2. Описание установки |
|
|
|
||||
Устройство |
и |
работа электрофотоколориметра КФК-2 аналогичны |
||||||||
устройству |
и работе |
КФК-2МП |
(см. п. 14.2.1 в |
лабораторной |
работе |
|||||
«Фотоэлектрический |
|
метод |
определения |
концентрации |
растворов»). |
|||||
Отличие |
состоит |
в |
, томчто |
функции |
микропроцессорного |
блока |
||||
выполняет |
стрелочный |
индикатор1 |
(рис. 17.6). |
Градуировка |
шкалы |
|||||
стрелочного индикатора позволяет непосредственно снимать значения |
||||||||||
коэффициента |
пропускания |
и |
оптической |
плотности |
|
исследуемых |
||||
растворов. |
|
|
|
|
|
|
|
|
|
|
196

Рис. 17.6. Общий вид электрофотоколориметра КФК-2:
1 – стрелочный индикатор; 2 – переключатель светофильтров; 3 – ручка перемещения кюветодержателя; 4 – переключатель фотоприемников и чувствительности;
5 – ручки установки «100» «Грубо» и «Точно»
В |
кюветодержатель |
установлена |
комбинированная |
, кювета |
||||
разделенная |
водонепроницаемой |
перегородкой |
с |
калиброванным |
||||
отверстием, |
закрытым |
мембраной. |
Перемещением |
ручки 3 |
(рис. |
17.6) |
в |
|
световой пучок вводится одна из двух разделенных перегородкой частей |
||||||||
кювет. Кюветодержатель следует устанавливать в кюветное отделение на |
||||||||
столик так, |
чтобы |
две маленькие |
пружины |
находились |
с |
передней |
||
стороны. |
|
|
|
|
|
|
|
|
17.3.Экспериментальная часть
17.3.1.Изучение временной зависимости переноса вещества через искусственную мембрану
1.Включить в сеть фотоколориметр и дать прибору прогреться в течение 10 минут. Кюветное отделение при этом должно быть открытым!
2.Ручку «Светофильтры» установить в положение 590, при котором
в |
ход |
светового |
пучка |
вводится |
светофильтр, обеспечивающий |
197
пропускание света с λ = 600 нм, что соответствует максимуму поглощения метиленового синего.
3.Установить минимальную чувствительность колориметра. Для этого ручку «Чувствительности» установить в положение1, ручку «Установки 100 грубо» – в крайнее левое положение.
При измерении со светофильтрами590, 670 и т.д., отмеченными красным цветом, ручка «Чувствительность» может быть установлена в одно из положений 1, 2, 3, отмеченных также красным цветом.
Рабочие поверхности кювет должны перед каждым измерением тщательно протираться спирто-эфирной смесью. Нельзя касаться пальцами рабочих участков кювет (ниже уровня жидкости).
Загрязнение поверхности кювет приведет к неверным результатам.
4.Заполнить один из дозаторных шприцов дистиллированной водой, другой – 0,0005% раствором метиленового синего.
5.С помощью дозаторных шприцов одновременно заполнить отсеки комбинированной кюветы так, чтобы уровень жидкостей в них оставался одинаковым на протяжении всего процесса заполнения. Это предотвратит преждевременное просачивание жидкости через мембрану, когда залита лишь одна часть кюветы.
Установить комбинированную кюветуА-В в кюветодержатель.
Кюветодержатель |
поместить в |
кюветное |
отделение |
||
электрофотоколориметра |
так, чтобы |
две |
маленькие |
пружины |
|
кюветодержателя находились с передней стороны и отсек с раствором метиленового синего был обращен к пользователю.
6.Поместить кювету А с растворителем (дистиллированной водой) в световой пучок (ручка 4 в положении 1 (рис. 17.6)).
7.Закрыть крышку кюветного отделения.
8.Ручками «Установка 100» – «Грубо» и «Точно» установить отсчет «100» по шкале колориметра. Ручка «Чувствительность» может находиться
водном из трех положений 1, 2 или 3.
9.Затем поворотом ручки 3 (рис. 17.6) кювету А с дистиллированной водой заменить кюветой В с раствором метиленового синего.
10.Снять отсчет по шкалеD колориметра, соответствующий оптической плотности D исследуемого раствора.
11.Открыть крышку кюветного отделения.
198
12.Начать отсчет времени. Записать значение D = D (0) (при t = 0).
13.Измерения проводить в течение 1,5 часов, выполняя п. 7-12 через
2 минуты в |
первые0,5 |
часа, |
через 5 минут во вторые0,5 часа и через |
||||||||
10 минут в последние 0,5 часа. |
|
|
|
|
|
|
|||||
14. Данные заносить в табл. 17.1. |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
Таблица 17.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
N замера |
|
Времяt, мин. |
|
Оптическая |
|
Концентрация |
Относительная |
||||
|
|
|
|
плотность D(t) |
|
метиленового синего |
концентрация |
|
|||
|
|
|
|
|
|
|
|
|
СX,% |
|
|
1 |
|
0 |
|
D(0) |
|
0 |
0 |
|
|||
2 |
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
4 |
|
|
|
|
|
|
|
|
|
. |
|
. |
|
|
|
|
|
|
|
|
|
. |
|
. |
|
|
|
|
|
|
|
|
|
. |
|
. |
|
|
|
|
|
|
|
|
|
х |
|
х |
|
|
|
|
|
|
|
|
|
Замечание: перед каждым измерением стеклянными палочками осторожно |
|||||||||||
перемешивать |
жидкость в |
отсекахА и В. Не следует в последующем путать между |
|||||||||
собой палочки, так как на них могут остаться капли раствора. |
|
|
|||||||||
15. По формуле CB ( t ) = |
|
C0 |
(D( 0 ) - D( t )) определить концентрацию |
||||||||
|
|
||||||||||
|
|
|
|
|
2D( 0 ) |
|
|
|
|||
метиленового синего в растворе при каждом измерении и рассчитать относительную концентрацию Сотн = Сх/С0, где Со – концентрация метиленового синего в исходном растворе, равная 0,0005% (Со =5×10-4%).
Результаты занести втабл. 17.1. Построить график зависимости
Сотн = f(t).
Сделать вывод относительно зависимости скорости изменения
концентрации |
dCотн/dt от |
времениt, т.е. |
оценить, возрастает или |
||
уменьшается скорость диффузии частиц с течением времени, учитывая, |
|||||
что dCотн/dt |
определяется |
как |
тангенс |
угла |
наклона касательной к |
полученной кривой в любой точке. |
|
|
|
||
17.3.2. |
Определение |
константы |
проницаемости |
||
мембраны для метиленового синего |
|
|
|||
199
1. Используя результаты предыдущего задания, определить массу метиленового синего, продиффундировавшего через мембрану в течение первых 10 минут с начала измерений:
m = C1 [мг / см3 ]×V [cм3 ],
где С1 – концентрация раствора через 10 минут после начала диффузии,
3
измеренная в мг/см (учесть, что весовая концентрация 1% соответствует 10 мг вещества в1 см3 раствора, т.е. С = 1% = 10 мг/см3); V – объем раствора в отсеке А (V = 10,5 см3).
2. Вычислить константу проницаемости мембраны для метиленового синего по формуле:
|
P = |
|
m |
|
|
|
|
, |
|
||
|
tSDC |
времяt; |
|||
где m – масса метиленового синего, |
прошедшего в отсекА за |
||||
S – площадь |
мембраны S = pd2/4 (d – диаметр отверстия в перегородке |
||||
камеры, или диаметр мембраны); DС – разность концентраций растворов |
|||||
по обе стороны от мембраны(DС » Со = 0,01% = 0,1 мг/см3, так как С0 >> |
|||||
С1). |
|
|
|
|
|
17.3.3. |
Исследование |
|
осмотического |
гемолиза |
|
эритроцитов
1.Ручку «Светофильтр» установить в положение 630 (красный свет), чтобы уменьшить поглощение света красной суспензией эритроцитов и исследовать только явление рассеяния.
2.Подготовить таблицу, аналогичную табл. 17.1, обозначить ее как
табл. 17.2.
3.Налить в измерительную кювету дистиллированную во(доу нижней метки). Затем долить в эту же кювету суспензию из эритроцитов в физиологическом растворе (до верхней метки), быстро перемешать стеклянной палочкой и поместить в фотоколориметр.
4.Вначале в световой луч поместить контрольную кювету с
дистиллированной водой (положение 1 ручки 3 (рис. 17.6)), затем перевести ручку 3 в положение 2 – в световой луч вводится измерительная кювета с суспензией эритроцитов.
200
