
- •Кафедра теоретических основ материаловедения
- •Гринева с.И., Сычев м.М., Лукашова т.В.,
- •Коробко в.Н., Мякин с.В.
- •Коррозия и методы защиты
- •Содержание
- •Введение
- •1 Краткие сведения о коррозионных процессах
- •1.1 Классификация коррозионных разрушений
- •1.2 Методы оценки коррозионной стойкости
- •1.3 Методы коррозионных испытаний
- •2 Факторы, влияющие на развитие коррозии материалов
- •2.1 Внутренние факторы коррозии
- •2.1.1 Термодинамическая устойчивость металла
- •2.1.2 Положение металла в периодической системе элементов
- •2.1.3 Химический состав и структура сплавов
- •2.1.4 Шероховатость поверхности и внутренние напряжения в деталях
- •2.2 Внешние факторы коррозии
- •2.2.1 Влияние рН на скорость коррозии
- •2.2.2 Влияние кислорода на скорость коррозии
- •2.2.3 Влияние температуры на скорость коррозии
- •2.2.4 Влияние давления на скорость коррозии
- •2.2.5 Влияние скорости движения электролита на скорость коррозии
- •2.2.6 Влияние состава и концентрации нейтральных солей на скорость коррозии
- •3 Химическая коррозия металлов
- •3.1 Газовая коррозия
- •3.1.1 Образование оксидных соединений на поверхности металла
- •3.1.2 Условия образования, защитных оксидных пленок
- •3.1.3 Скорость роста пленки на металлах
- •3.1.4 Газовая коррозия стали и чугуна
- •3.1.5 Катастрофическая газовая коррозия
- •3.1.6 Водородная коррозия. Водородный износ
- •3. 1.7 Карбонильная коррозия
- •3.1.8 Коррозия, вызываемая сернистыми соединениями
- •3.1.9 Коррозия, вызываемая хлором
- •3.1.10 Защита от газовой коррозии
- •3.2 Коррозия металлов в неэлектролитах
- •4. Электрохимическая коррозия
- •4.1 Особенности строения электролитов
- •4.2 Образование двойного электрического слоя
- •4.3 Электродные потенциалы
- •4.4 Механизм электрохимической коррозии
- •4.5 Поляризация электродов
- •4.6 Деполяризация электродов
- •4.7 Коррозионная диаграмма Эванса
- •4.8 Факторы, ограничивающие электрохимическую коррозию
- •5. Пассивность металлов
- •5.1 Теория пассивности металлов
- •5.2 Кинетика анодных процессов при пассивации металлов
- •6 Атмосферная коррозия металлов
- •6.1 Факторы, вызывающие атмосферную коррозию
- •6.2 Виды и механизм атмосферной коррозии
- •6.3 Скорость атмосферной коррозии
- •7. Подземная коррозия
- •7.1 Почвенная коррозия
- •7.2 Коррозия, вызванная действием блуждающих токов
- •8. Локальная коррозия
- •8.1 Точечная (питтинговая) коррозия
- •8.2 Щелевая коррозия
- •8.3 Межкристаллитная коррозия
- •8.4 Ножевая коррозия
- •9 Методы защиты от коррозии
- •9.1 Защита металлов от коррозии обработкой коррозионной среды
- •9.1.1 Удаление агрессивных компонентов из коррозионной среды
- •9.1.2 Защита металлов от коррозии ингибиторами
- •9.1.3 Механизм защитного действия ингибиторов
- •9.1.4 Влияние некоторых факторов на эффективность действия
- •9.2 Защитные покрытия
- •9.2.1 Металлические покрытия
- •9.2.2 Защитные покрытия на органической основе
- •9.2.3 Защитные покрытия на неорганической основе
- •9.3 Электрохимическая защита
- •9.3.1 Катодная зашита
- •9.3.2 Анодная защита
- •9.3.3 Защита от коррозии, вызываемой блуждающими
- •9.4 Защита от коррозии на стадии проектирования
- •9.4.1 Выбор материалов
- •9.4.2 Рациональные геометрические формы конструкций
- •Литература
- •Коррозия и методы защиты
4.6 Деполяризация электродов
Явления, способствующие уменьшению поляризуемости электродов, называются деполяризацией. Вещества, уменьшающие поляризацию, называются деполяризаторами. Поляризация и деполяризация составляют основу кинетики электрохимической коррозии. Процессы, противодействующие анодной и катодной поляризации, называют анодной и катодной деполяризацией.
Наибольший практический интерес представляет катодная деполяризация с участием таких деполяризаторов, как водород и кислород. Водород в кислых средах находится в виде гидратированного иона водорода Н+∙Н2О. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией. Водородная деполяризация термодинамически возможна в тех случаях, когда равновесный потенциал металла отрицательнее равновесного потенциала водородного электрода измеренного в тех же условиях и сопровождается выделением водорода.
Процесс разряда ионов водорода на катоде сложен и состоит из нескольких последовательных стадий:
- диффузия и миграция гидратированных ионов водорода к катоду;
- дегидратация ионов водорода Н+∙Н2О → Н++Н2О
- вхождение ионов водорода в состав двойного слоя;
- разряд ионов водорода Н++е- → Надс;
- рекомбинация атомов водорода в молекулу Надс+ Надс= Н2;
- образование и отрыв пузырьков из молекул водорода на катоде.
Равновесие на водородном электроде выражается уравнением:
2Н+ + 2е- → Н2.
На катоде взаимодействуют ионы водорода Н+, входящие в двойной электродный слой, и молекулы газообразного водорода Н2. Образуется газовый водородный электрод Н+—Н2.
Коррозия с кислородной деполяризацией широко распространена в нейтральной среде или при небольшом сдвиге потенциала в ту или иную сторону от 7. Характерной особенностью является определяющая роль концентрационной катодной поляризации, которая лимитирует скорость коррозии в целом. Это объясняется двумя обстоятельствами: малой концентрацией кислорода (из-за низкой его растворимости в электролитах) и незначительной скоростью диффузии кислорода.
Процесс коррозии с кислородной деполяризацией протекает с поглощением кислорода и термодинамически возможен в том случае, если равновесный потенциал металла отрицательнее равновесного потенциала кислородного электрода измеренного в тех же условиях. Этот процесс протекает в две стадии:
- транспортировка кислорода к поверхности катода;
- электрохимический процесс ионизации кислорода в прикатодном слое.
Приближенное суждение о возможности коррозионных процессов с выделением водорода можно получить, сравнивая стандартные потенциалы различных металлов с потенциалом водородного электрода в одинаковых условиях. Используя уравнение Нернста, можно получить график зависимости потенциалов водородного и кислородного электродов от рН (рисунок 18).
Анализируя график, можно сделать следующие выводы:
1. Потенциал кислородного электрода положительнее потенциала водородного электрода на постоянную величину, равную 1,228 В при
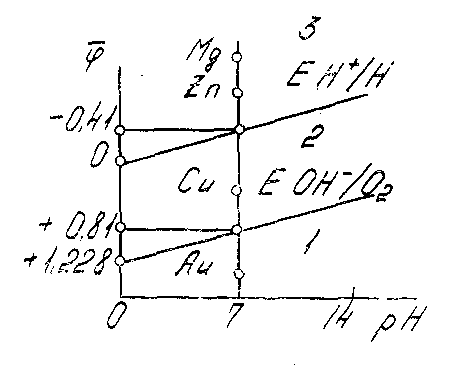
Рисунок 18 - Потенциалы водородного и кислородного
электродов в зависимости от рН
любых значениях рН. Поэтому процесс коррозии в водных растворах должен идти с преимущественным восстановлением кислорода. Это характерно для коррозии металлов в средах, имеющих контакт с воздухом.
2. Если потенциал металла положительнее потенциала кислородного электрода (область 1), то коррозия металла невозможна. Например, золото с потенциалом +1,69 В корродировать не будет.
3. Если потенциал металла положительнее потенциала водородного и отрицательнее потенциала кислородного электрода (область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода.
4. Если потенциал металла отрицательнее потенциала водородного электрода (область 3) (например, потенциал цинка равен —0,74 В), то возможна коррозия как с поглощением кислорода, так и с выделением водорода.
Таким образом, при контакте раствора электролита с атмосферой большинство металлов может корродировать с поглощением кислорода и лишь некоторые металлы — с выделением водорода. Следует отметить, что все факторы, способствующие доступу кислорода к металлу, будут увеличивать скорость коррозии. Так, например, перемешивание раствора значительно облегчает доступ кислорода к металлу и ускоряет его коррозию.
