
Министерство образования Российской Федерации
_______________________________________________________
Государственное образовательное учреждение
высшего профессионального образования
Санкт-Петербургский государственный технологический институт
(Технический университет)
_______________________________________________________________________
Кафедра теоретических основ материаловедения
С.И.Гринева
ОПРЕДЕЛЕНИЕ СКОРОСТИ КОРРОЗИИ
МЕТАЛЛОВ И СПЛАВОВ ОБЪЕМНЫМ МЕТОДОМ
Методические указания
к лабораторной работе
Санкт-Петербург
2004
УДК 620.193:620.197
Гринева С.И. Определение скорости коррозии металлов и сплавов объемным методом: Методическое указание.- СПб.: СПбГТИ(ТУ), 2004. – 11 с.
Представлена лабораторная работа по определению скорости коррозии металлов и сплавов протекающей с водородной деполяризацией.
Рассмотрены вопросы определения скорости коррозии конструкционных материалов объемным методом, а также влияние рН раствора, состава и структуры материала на скорость коррозии.
Предназначено для студентов 2-го курса изучающих курс “Химическое сопротивление металлов и защита от коррозии” и соответствует рабочей программе.
Таблица 1, рис. 1, библиогр.назв. 3
Рецензент: С.С.Орданьян, д-р техн.наук, профессор, зав.кафедрой
«Химической технологии тонкой технической керамики»
СПбГТИ(ТУ)
Утверждена на заседании учебно-методической комиссии общеинженерного отделения 29.12.2003
Рекомендовать к изданию РИСо СПбГТИ(ТУ)
Введение
Коррозией называется разрушение материалов в результате химического или электрохимического взаимодействия с окружающей средой. Коррозия приводит к безвозвратным потерям металла, выводу из строя дорогостоящих машин, аппаратов, оборудования и сооружений, к загрязнению окружающей среды и многим другим последствиям. Ущерб в результате коррозии металлов в промышленно развитых странах достигает 4-5% национального дохода. Поэтому проблемы возникновения коррозии и ее предотвращения имеют огромное значение, возрастающее по мере прогресса в различных отраслях промышленности.
Явление деполяризации
Для оценки коррозионного процесса пользуются качественными и количественными методами. Качественные методы играют вспомогательную роль, позволяя получать представление о характере и интенсивности процесса. Наиболее распространенными среди методов количественной оценки коррозии являются весовой и объемный.
Сущность объемного метода заключается в определении количества газа, выделяющегося или поглощающегося в процессе электрохимической коррозии. Электрохимическая коррозия возникает вследствие взаимодействия металлов с электролитами и представляет собой электрохимическую реакцию, состоящую из двух процессов – анодного и катодного. При анодном процессе атомы металла переходят в раствор в виде ионов. При катодном процессе остающиеся в металле избыточные электроны захватываются каким-либо деполяризатором. Оба процесса протекают, сопряжено и таким образом, что сохраняется равенство числа электронов, отдаваемых металлом и принимаемых окислителем в единицу времени. Возможность протекания этих процессов обуславливается наличием ионов металла в растворе и свободных электронов в металле.
Различают электрохимическую коррозию с анодной и катодной деполяризацией. Наибольший практический интерес представляет коррозия с катодной деполяризацией, а в качестве деполяризаторов выступают водород и кислород. В зависимости от этого различают электрохимическую коррозию с водородной деполяризацией или с кислородной деполяризацией. Термодинамическая возможность протекания коррозии с водородной деполяризацией наблюдается в том случае, если равновесный потенциал металла отрицательнее потенциала водородного электродного измеренного в тех же условиях. Водород присутствует в растворе в виде гидратированного катиона. Процесс разряда ионов водорода на катоде сложен и состоит из нескольких стадий:
-
Диффузия и миграция гидратированных ионов водорода к катоду;
-
Дегидратация ионов водорода Н+Н2О Н+ + Н2О;
-
Вхождение ионов водорода в состав двойного электрического слоя;
-
Разряд ионов водорода Н+ +
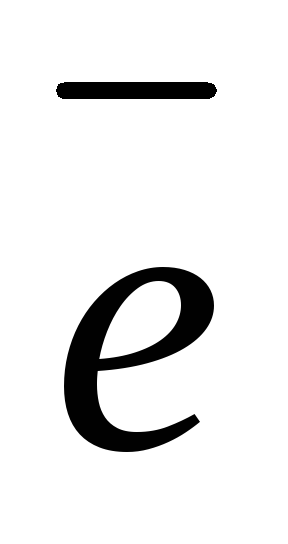
Надс;
Надс; -
Рекомбинация адсорбированных атомов водорода в молекулу Н2;
-
Образование и отрыв пузырьков из молекул водорода от поверхности
катода.
Ввиду большой подвижности ионов водорода первые три стадии не лимитируют реакцию катодного процесса. Скорость процесса определяется четвертой и пятой стадиями.
Коррозия металлов с участием кислорода называется коррозией с кислородной деполяризацией и идет с поглощением кислорода. Кислородная деполяризация возможно в тех случаях, когда равновесный потенциал металла отрицательнее потенциала кислородного электрода измеренного в тех же условиях. Катодный процесс кислородной деполяризации протекает в две стадии:
-
Транспортировка кислорода к поверхности катода;
-
Электрохимический процесс ионизации кислорода в прикатодном слое.
Кислородные молекулы из воздуха должны пересечь границу атмосфера – жидкость, затем пройти толщу жидкости почти до поверхности металла и , наконец, преодолеть слой жидкости, примыкающий к металлу, который удерживается у металла адсорбционными силами и относительно неподвижен. Факторы, увеличивающие доступ кислорода к поверхности металла (например, перемешивание раствора) будут ускорять коррозию.
Если при электрохимической коррозии в катодном процессе участвуют и водород, и кислород, то говорят о коррозии со смешанной деполяризацией. Наиболее целесообразно применение объемного метода, если процесс коррозии идет преимущественно с выделением водорода. Определение выделяющегося водорода производится с помощью так называемого водородного коррозиметра. В простейшем виде этот прибор представляет собой бюретку с газосборной воронкой в нижней части в соответствии с рисунком 1.
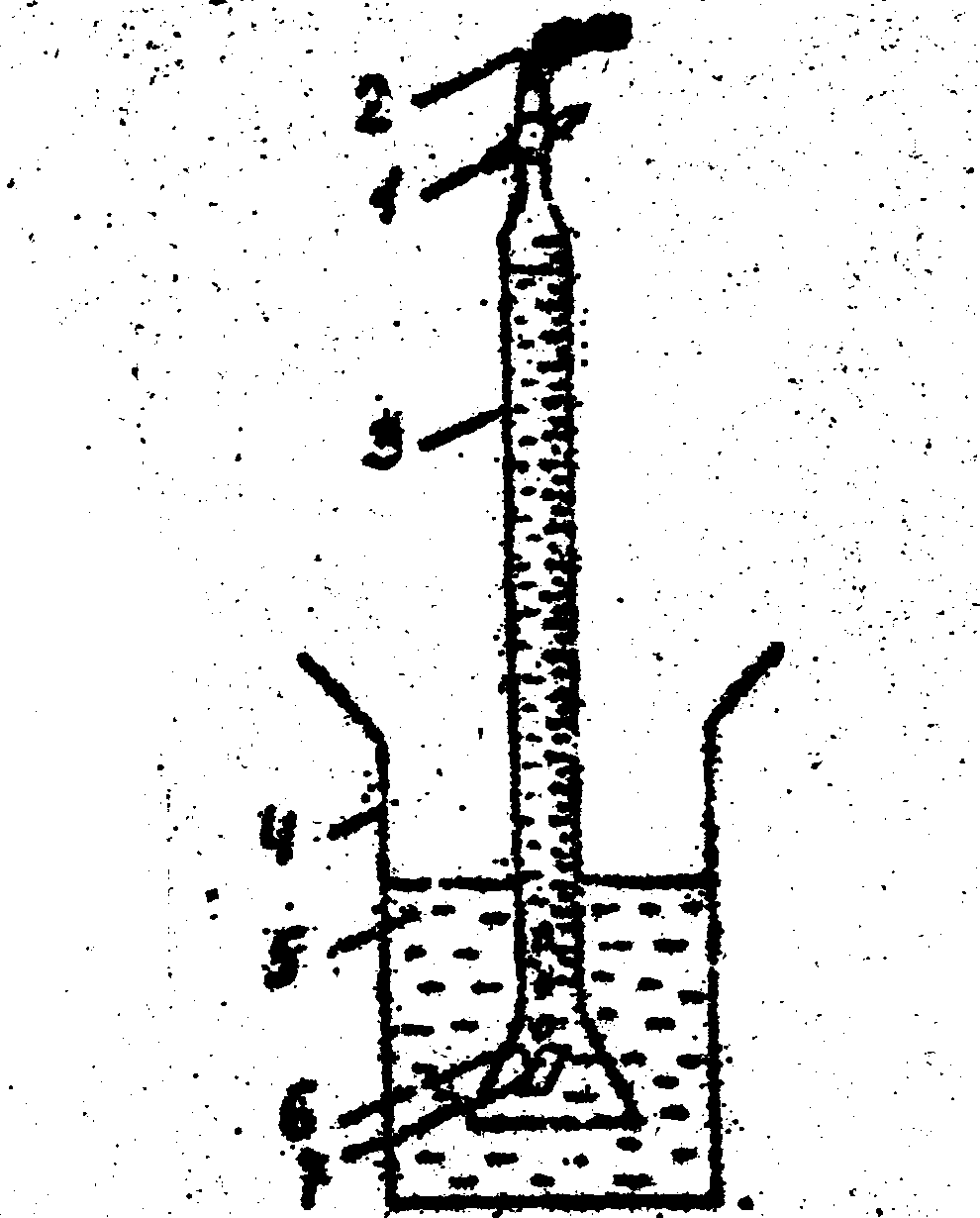
1-кран; 2-резиновая трубка; 3-бюре 4-стакан; 5-раствор; 6-крючок; 7-образец.
Рисунок 1 – Водородный коррозиметр
Под воронку, погруженную в коррозионный раствор, помещают испытываемый образец. Принцип действия прибора для определения поглощенного кислорода сводится к замеру степени разряжения в сосуде с образцом, заполненным коррозионным раствором. Во всех случаях при определении скорости коррозии по количеству поглощенного кислорода необходимо следить за тем, чтобы испытания не проводились при недостатке кислорода, и периодически обновлять атмосферу в реакционном сосуде. Обновление проводят таким образом, чтобы количество поглощенного кислорода не превышало 10% общего запаса кислорода в сосуде. Это легко определить, зная объем сосуда и объем поглощенного кислорода в процессе коррозии за данный промежуток времени. Принцип объемного метода определения скорости коррозии основан на том, что количество растворенного металла эквивалентно количеству выделившегося водорода. Однако следует учитывать ошибки при измерении вследствие изменения температуры и давления атмосферы (т.е. измеренное количество водорода привести к нормальным условиям).
m
=
![]() , г ; (1)
, г ; (1)
где
![]() - масса образца, г;
- масса образца, г;
![]() - объем выделевшегося
водорода в см3,
приведенный к нормальным
- объем выделевшегося
водорода в см3,
приведенный к нормальным
условиям по формуле:
![]() (2)
(2)
А – атомная масса металла;
n – валентность металла;
р – давление, Па;
t – температура, 0С.
На скорость протекания коррозии оказывают влияние внутренние и внешние факторы. Внутренние факторы характеризуют металл – это термодинамическая устойчивость, положение в периодической системе Менделеева, химический состав, структура, характер обработки поверхности и наличие внутренних напряжений. Металлы высокой степени чистоты имеют повышенную коррозионную стойкость. Загрязнения другими металлами или неметаллическими включениями приводят к значительному снижению коррозионной стойкости. Например,
-
Аl в нсl
относительная
скорость коррозии
99,998
1
99,9
1000
99,2
30000
С целью придания сплавам коррозионной стойкости вводят легирующие элементы, и чем выше их концентрация, тем выше устойчивость сплава к данной коррозионной среде. Все сплавы с точки зрения структурных особенностей могут быть разделены на две группы: а) многофазные – содержащие две и более структурных составляющих; б) однофазные – твердый раствор или химическое соединение. Сплавы, представляющие собой химическое соединение не применяются в качестве конструкционных материалов из-за значительной хрупкости, твердости и плохих технологических свойств. В многофазных сплавах при контакте с раствором электролита возникает множество анодных и катодных участков. Скорость коррозии их будет зависеть от весового соотношения и взаимного расположения фаз, выполняющих роль анода и катода. Если фазы распределены равномерно и доля анодной составляющей невелика, то коррозия будет сплошной и непродолжительной. При неравномерном распределении анодной фазы коррозия будет местной и длительной, причем разрушение может идти в глубь изделия, что особенно опасно. Необходимо отметить также, что чем мельче зерно, тем меньше корродирует сплав. В однофазных сплавах типа твердый раствор скорость коррозии зависит от химического состава сплава. При увеличении концентрации более коррозионностойкого компонента сплава скорость коррозии меняется скачкообразно по правилу порогов устойчивости, разработанному Тамманом. Это правило, называемое также правилом п/8 , гласит, что при легировании менее электроположительного металла более электроположительным (более благородным) скорость коррозии будет снижаться скачкообразно по мере добавления количества, кратного п/8 атомной доли более благородного металла. При этом равновесный потенциал сплава будет повышаться ступенчато, приближаясь к потенциалу чистого более благородного металла. Однако это не означает, что каждый однофазный сплав при изменении состава имеет все 8 порогов устойчивости. Их количество зависит от природы металла и степени агрессивности среды. Внешние факторы характеризуют агрессивную среду – это рН коррозионной среды, температура, давление и др. Водородный показатель среды, представляет собой логарифм концентрации ионов Н, взятый с обратным знаком рН = - lg [Н+]. При уменьшении рН раствора активность ионов водорода возрастает и, как правило, обычно возрастает скорость коррозии. Однако это имеет место только в тех случаях, когда агрессивная среда не оказывает пассивирующее действие и не приводит к образованию защитной пленки. Поэтому для различных металлов имеется соответствующее среднее характерное значение рН, при котором скорость коррозии минимальна. Например, у Аl – рН=7, у Рв – рН=8, у Sn – рН=9, у Zn рН=10. По влиянию рН среды на скорость коррозии все металлы можно подразделить на пять групп. В первую группу входят металлы скорость коррозии которых минимальна и не зависит от рН (Аg, Аu, Рt, Тi). Во вторую группу – металлы нестойкие в кислых средах, слабоустойчивые в нейтральных и устойчивые в щелочных (Сu, Мn, Fе и др.). В третью группу – металлы неустойчивые в кислых и щелочных средах (Аl, Sn, Zn и др.). В четвертую группу – металлы неустойчивые в кислых средах и устойчивые в щелочных (Ni, Со и др.). В пятую группу – металлы устойчивые в кислых средах и неустойчивые в щелочных (W, Мо и др.).
Преимущество объемного метода по сравнению с весовым состоит в том, что он позволяет наблюдать за кинетикой процесса на отдельном образце, что ускоряет и упрощает испытания. В то же время этот метод аппаратурно значительно усложняется и теряет точность, если коррозия протекает со смешанной кислородно – водородной деполяризацией.
ЛАБОРАТОРНАЯ РАБОТА. Определение скорости коррозии металлов
и сплавов объемным методом
1. Цель работы
Ознакомление с объемным методом определения скорости коррозии и приобретения опыта проведения измерений.
2. Приборы и материалы
Водородный коррозиметр,
Стеклянные стаканы,
Стеклянные крючки,
Образцы металлов и сплавов согласно заданию,
Рабочие растворы.
3. Описание работы
Опыт проводят на двух образцах. Перед началом испытания необходимо измерить размеры образцов, зачистить их наждачной бумагой и обезжирить в бензине. Затем поместить образцы в стаканы с тубусом на крючках и налить раствор согласно индивидуального задания. Объем выделяющегося водорода измеряют через каждые 10 минут в течение 50 минут. По окончании испытания образцы необходимо промыть и просушить.
4. Оформление результатов работы
Объем выделевшегося водорода приводят к нормальным условиям по формуле 2. По экспериментальным данным построить кинетические кривые изменения объемного показателя скорости коррозии во времени. Объемный показатель скорости коррозии определяется по формуле:
![]() (3)
(3)
По общему объему водорода, выделевшегося за все время проведения опыта, вычислить количество прокорродировавшего металла по формуле (1). Рассчитать глубинный показатель коррозии по формуле:
![]() , мм / год
(4)
, мм / год
(4)
где K – скорость коррозии вычисляется по формуле:
![]() ,
г / м2 . ч
(5)
,
г / м2 . ч
(5)
![]() - плотность металла,
г / см3
- плотность металла,
г / см3
Полученные данные представляются в виде таблицы 1.
Таблица – 1 Данные лабораторной работы
|
|
|
Кv, см3/см2ч |
m, г |
К, г/м2ч |
П, мм/год |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
|
В выводе дать заключение о действии коррозионной среды на материалы.
5. Контрольные вопросы
1. Влияние состава и структуры материала на скорость коррозии.
2. Влияние рН раствора на скорость коррозии.
3. Коррозия металлов с водородной деполяризацией.
4. Коррозия металлов с кислородной деполяризацией.
