
- •2.2. Угловая скорость
- •2.3. Период и частота обращения
- •2.4. Угловое ускорение
- •Вопрос 1. Импульс тела. Импульс системы тел. Закон сохранения испульса.
- •Вопрос2. Термодинамическое и статистическое определение энтропии. Второе начало термодинамики.
- •§ 2.5. Теорема о движении центра масс
- •2. Теплоемкость газовой смеси
- •2 Теплоемкости при постоянном давлении и постоянном объеме
- •2. Теплоемкость газовой смеси
- •Закон сохранения импульса
- •2 Декремент затухания. Логарифмический декремент затухания. Добротность
- •Поступательное движение Вращательное движение
- •Формула закона всемирного тяготения для материальных точек
- •Гравитационная постоянная
- •Поле тяготения. Работа сил тяготения
- •1 Поступательное движение Вращательное движение
- •1 Сила трения
- •3.10. Теплоёмкость идеального газа
1 Поступательное движение Вращательное движение
Скорость ![]() Угловая
скорость
Угловая
скорость ![]() Ускорение
Ускорение ![]() Угловое
ускорение
Угловое
ускорение ![]()
2
Адиабатическим называется
процесс, при котором отсутствует
теплообмен (δQ=0) между системой и
окружающей средой. Адиабатическим
процессами можно считать все
быстропротекающие процессы. Таковым,
например, можно считать процесс
распространения звука в среде, так как
скорость распространения звуковой
волны настолько большая по значению,
что обмен энергией между средой и волной
произойти не успевает. Адиабатические
процессы происходят в двигателях
внутреннего сгорания (сжатие и расширение
горючей смеси в цилиндрах), в холодильных
установках и т. д.
Из
первого начала термодинамики (δQ=dU+δA)
для адиабатического процесса следует,
что
![]() (1)
т.
е. внешняя работа совершается за счет
изменения внутренней энергии
системы.
Используя
формулы δA=pdV и CV=dUm/dT,
для произвольной массы газа перепишем
уравнение (1) в виде
(1)
т.
е. внешняя работа совершается за счет
изменения внутренней энергии
системы.
Используя
формулы δA=pdV и CV=dUm/dT,
для произвольной массы газа перепишем
уравнение (1) в виде
![]() (2)
применив
дифференцирование уравнение состояния
для идеального газа pV=(m/M)RT
получим
(2)
применив
дифференцирование уравнение состояния
для идеального газа pV=(m/M)RT
получим
![]() (3)
Исключим
из (2) и (3) температуру Т.
(3)
Исключим
из (2) и (3) температуру Т.
![]() Разделив
переменные и учитывая, что Сp/СV=γ
, найдем
Разделив
переменные и учитывая, что Сp/СV=γ
, найдем
![]() Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению
Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению
![]() или
или ![]() Так
как состояния 1 и 2 выбраны произвольно,
то можно записать
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать
![]() (4)
Полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
Для
перехода к переменным Т, V или p, Т исключим
из (55.4) с помощью уравнения
Менделеева-Клапейрона
(4)
Полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
Для
перехода к переменным Т, V или p, Т исключим
из (55.4) с помощью уравнения
Менделеева-Клапейрона
![]() соответственно
давление или объем:
соответственно
давление или объем:
![]() (5)
(5)
![]() (6)
Выражения
(4) — (6) представляют собой уравнения
адиабатического процесса. В них
безразмерная величина
(6)
Выражения
(4) — (6) представляют собой уравнения
адиабатического процесса. В них
безразмерная величина
![]() (7)
называется показателем
адиабаты (или коэффициентом
Пуассона).
Для одноатомных газов (Ne, He и др.),
достаточно хорошо удовлетворяющих
условию идеальности, i=3,
γ=1,67. Для двухатомных газов (Н2,
N2,
О2 и
др.) i=5,
γ=1,4. Значения γ, вычисленные по формуле
(55.7), хорошо подтверждаются экспериментом.
(7)
называется показателем
адиабаты (или коэффициентом
Пуассона).
Для одноатомных газов (Ne, He и др.),
достаточно хорошо удовлетворяющих
условию идеальности, i=3,
γ=1,67. Для двухатомных газов (Н2,
N2,
О2 и
др.) i=5,
γ=1,4. Значения γ, вычисленные по формуле
(55.7), хорошо подтверждаются экспериментом.
Билет 22
1 Момент инерции. Момент инерции - это величина равная сумме произведений всех масс на квадраты их расстояний от некоторой оси,
I= miri2.
Моменты инерций простейших тел.
1. Материальная точка I=mr2.
2. Тонкий однородный стержень I=1/12ml2, при оси проходящей через его центр масс.
3. Обруч I=mr2.
4. Диск I=1/2mr2.
5. Шар I=2/5mr2.
Момент инерции для сплошного цилиндра
dI=miri2=ρ*Vi* ri2=ρ*2*π* ri*h*dr*r2
dI=2*π*ρ*h* ri3*dr
I=2*π*ρ*h{0-R}∫ ri3dr
I=2*π*ρ*h*(R4/4)-(m*R2/2)
I=1/2*m*R2
Кинетическая энергия вращающения.
Ek=Σ(miw2Ri2)/2=w2/2*ΣmiRi2
Ek=(I*w2)/2 – для вращательного движения тела
Ek=(I*w2)/2+(m*v2)/2 – для вращательного и поступательного движения.
Момент силы. Моментом силы F относительно некоторой точки O называется векторная величина M, M=r*F*Sin ,r-радиус-вектор l=r*sin , l-плечо силы. M=F*l;
Плечо силы – это кротчайшее расстояние от точки вращения до линии вдоль которой действует сила
Момент силы относительно оси это проекция момента силы относительно любой точки оси на данную ось.
2
Среди
равновесных процессов, которые происходят
с термодинамическими системами, отдельно
рассматриваются изопроцессы, при которых
один из основных параметров состояния
остается постоянным.
Изохорный
процесс (V=const).
Диаграмма этого процесса (изохора)
в координатах р, V изображается прямой,
параллельной оси ординат (рис. 1), где
процесс 1—2 есть изохорное нагревание,
а 1—3 — изохорное охлаждение. При
изохорном процессе газ не совершает
работы над внешними телами, т. е.
![]() Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
Из
первого начала термодинамики (δQ=dU+δA)
для изохорного процесса следует, что
вся теплота, которая сообщается газу,
идет на увеличение его внутренней
энергии:
![]() т.к.
CV=dUm/dt,
т.к.
CV=dUm/dt,
![]() Тогда
для произвольной массы газа
получим
Тогда
для произвольной массы газа
получим
![]() (1)
Изобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
(1)
Изобарный
процесс (p=const).
Диаграмма этого процесса (изобара)
в координатах р, V изображается прямой,
которая параллельна оси V. При изобарном
процессе работа газа при увеличения
объема от V1 до
V2 равна
![]() (2)
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний,
то
(2)
и
равна площади заштрихованного
прямоугольника (рис. 2). Если использовать
уравнение Менделеева-Клапейрона для
выбранных нами двух состояний,
то
![]() и
и ![]() откуда
откуда
![]() Тогда
выражение (2) для работы изобарного
расширения примет вид
Тогда
выражение (2) для работы изобарного
расширения примет вид
![]() (3)
Из
этого выражения вытекает физический
смысл молярной газовой постоянной R:
если T2 —T1 =
1К, то для 1 моль газа R=A, т. е. R численно
равна работе изобарного расширения 1
моль идеального газа при нагревании
его на 1 К.
(3)
Из
этого выражения вытекает физический
смысл молярной газовой постоянной R:
если T2 —T1 =
1К, то для 1 моль газа R=A, т. е. R численно
равна работе изобарного расширения 1
моль идеального газа при нагревании
его на 1 К.
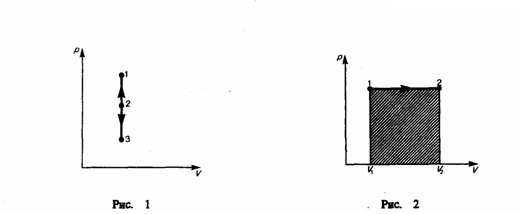
Рис.1
В
изобарном процессе при сообщении газу
массой m количества теплоты
![]() его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt)
его
внутренняя энергия возрастает на
величину (т.к. CV=dUm/dt)
![]() При
этом газ совершит работу, определяемую
выражением (3).
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
При
этом газ совершит работу, определяемую
выражением (3).
Изотермический
процесс (T=const).
Изотермический процесс описывается
законом Бойля—Мариотта:
![]() Диаграмма
этого процесса (изотерма)
в координатах р, V представляет собой
гиперболу, которая расположена на
диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:
Диаграмма
этого процесса (изотерма)
в координатах р, V представляет собой
гиперболу, которая расположена на
диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя
из формул для работы газа и уравнения
Менделеева-Клайперона найдем работу
изотермического расширения газа:
![]() Так
как при Т=const внутренняя энергия идеального
газа не изменяется:
Так
как при Т=const внутренняя энергия идеального
газа не изменяется:
![]() то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса
то
из первого начала термодинамики
(δQ=dU+δA) следует, что для изотермического
процесса
![]() т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
![]() (4)
Значит,
для того чтобы при расширении газа
температура не становилась меньше, к
газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.
(4)
Значит,
для того чтобы при расширении газа
температура не становилась меньше, к
газу в течение изотермического процесса
необходимо подводить количество теплоты,
равное внешней работе расширения.
Билет 23
