
- •2.2. Угловая скорость
- •2.3. Период и частота обращения
- •2.4. Угловое ускорение
- •Вопрос 1. Импульс тела. Импульс системы тел. Закон сохранения испульса.
- •Вопрос2. Термодинамическое и статистическое определение энтропии. Второе начало термодинамики.
- •§ 2.5. Теорема о движении центра масс
- •2. Теплоемкость газовой смеси
- •2 Теплоемкости при постоянном давлении и постоянном объеме
- •2. Теплоемкость газовой смеси
- •Закон сохранения импульса
- •2 Декремент затухания. Логарифмический декремент затухания. Добротность
- •Поступательное движение Вращательное движение
- •Формула закона всемирного тяготения для материальных точек
- •Гравитационная постоянная
- •Поле тяготения. Работа сил тяготения
- •1 Поступательное движение Вращательное движение
- •1 Сила трения
- •3.10. Теплоёмкость идеального газа
2. Теплоемкость газовой смеси
Если смесь газов задана массовыми долями, то массовая теплоемкость ее равна сумме произведений массовых долей каждого газа на его теплоемкостьi ~n Ссм= 2 Sfi- (44)Теплоемкость смеси, заданной в объемных долях,i ~n С'см= 2j riCi- (45)Для вычисления теплоемкости смеси, заданной в киломолях, следует воспользоваться уравнениемi =n VCMCCM = J] ViCiri-(46)I = 1
3. Количество теплоты, сообщаемой газу при нагревеДля расчета количества теплоты, затрачиваемой на подогрев газа, пользуются средней теплоемкостью, подсчитываемой по приближенным формулам или табличным данным (см. табл. 1).Для определения количества затраченной теплоты при нагревании 1 кг газа в интервале температур от tx до t% определяют количества теплоты qx и q2, которые необходимо израсходовать при нагреве от 0° С соответственно до tx и t2, т. е..
Билет 9.
1 Момент инерции, величина, характеризующая распределение масс в теле и являющаяся наряду с массой мерой инертности тела при непоступательном движении. В механике различают М. и. осевые и центробежные. Осевым М. и. тела относительно оси zназывается величина, определяемая равенством:
![]()
где mi — массы точек тела, hi — их расстояния от оси z, r — массовая плотность, V — объём тела. Величина Iz является мерой инертности тела при его вращении вокруг оси (см. Вращательное движение). Осевой М. и. можно также выразить через линейную величину k, называемую радиусом инерции, по формуле Iz = Mk2, где М — масса тела. Размерность М. и. — L2M; единицы измерения — кг×м2 или г×см2.
Центробежным М. и. относительно системы прямоугольных осей х, у, z, проведённых в точке О, называют величины, определяемые равенствами:
![]()
или же соответствующими объёмными интегралами. Эти величины являются характеристиками динамической неуравновешенности масс. Например, при вращении тела вокруг оси z от значений Ixz и Iyz зависят силы давления на подшипники, в которых закреплена ось.
М. и. относительно параллельных осей z и z' связаны соотношением
Iz = Iz' + М d2 (3)
где z' — ось, проходящая через центр масс тела, a d — расстояние между осями (теорема Гюйгенса).
М. и. относительно любой, проходящей через начало координат О оси Ol с направляющими косинусами a, b, g находится по формуле:
lol = Ix a2 + Iy b2 + Iz g2 — 2Ixy ab — 2Iyz bg — 2Izxga. (4)
Зная шесть величин Ix, Iy, Iz, Ixy, Iyх, Izx, можно последовательно, используя формулы (4) и (3), вычислить всю совокупность М. и. тела относительно любых осей. Эти шесть величин определяют т. н. тензор инерции тела. Через каждую точку тела можно провести 3 такие взаимно-перпендикулярные оси, называемые главными осями инерции, для которых Ixy = Iyz = Izx = 0. Тогда М. и. тела относительно любой оси можно определить, зная главные оси инерции и М. и. относительно этих осей.
М. и. тел сложной конфигурации обычно определяют экспериментально. Понятием о М. и. широко пользуются при решении многих задач механики и техники.
2 Теплоемкости при постоянном давлении и постоянном объеме
При
сообщении телу некоторого количества
теплоты изменяется его температура (за
исключением агрегатных превращений и
вообще изотермических процессов).
Характеристиками такого изменения
являются различные теплоемкости:
теплоемкость тела ![]() ,
удельная теплоемкость вещества c,
молярная теплоемкость C.
,
удельная теплоемкость вещества c,
молярная теплоемкость C.
Понятия теплоемкости тела и удельной теплоемкости рассмотрены тут.
Молярная теплоемкость C — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
![]()
Единицей молярной теплоемкости в СИ является джоуль на моль-Кельвин (Дж/моль·К).
Удельная теплоемкость связана с молярной соотношением
C = cM.
В
отличие от такой, например, характеристики
вещества, как его молекулярная масса
Mr удельная теплоемкость вещества не
является неизменным параметром. Удельная
теплоемкость может резко изменяться
при переходе вещества из одного
агрегатного состояния в другое. Так,
вода в газообразном состоянии имеет
удельную теплоемкость ![]() а
в жидком
а
в жидком ![]() .
.
Теплоемкость
зависит и от условий, при которых
происходит передача теплоты телу.
Последнее особенно относится к газам.
Например, при изотермическом расширении
газа ему передается некоторое количество
теплоты ![]() .
Следовательно, удельная теплоемкость
газа при изотермическом процессе
.
Следовательно, удельная теплоемкость
газа при изотермическом процессе
![]()
При
адиабатном сжатии (расширении) газ не
получает теплоты и не передает ее
окружающим телам (Q = 0), а температура
газа изменяется ![]() .
Следовательно, удельная теплоемкость
газа при адиабатном процессе
.
Следовательно, удельная теплоемкость
газа при адиабатном процессе
![]()
Наибольший
интерес представляет теплоемкость для
случаев, когда нагревание происходит
при постоянном объеме или при постоянном
давлении. В первом случае теплоемкость
называется теплоемкостью при постоянном
объеме или изохорной теплоемкостью ![]() ,
во втором — теплоемкостью при постоянном
давлении или изобарной теплоемкостью
,
во втором — теплоемкостью при постоянном
давлении или изобарной теплоемкостью ![]() .
.
Если
объем не изменяется ![]() ,
то работа, совершенная газом, так же
равна нулю (А = 0). Согласно первому закону
термодинамики
,
то работа, совершенная газом, так же
равна нулю (А = 0). Согласно первому закону
термодинамики
![]()
Откуда
![]()
Следовательно, теплоемкость при постоянном объеме равна изменению внутренней энергии газа при изменении температуры на 1 К.
Если газ идеальный, то в формуле (2)
![]()
Тогда молярная теплоемкость при постоянном объеме
![]()
— изменение внутренней энергии 1 моль газа. Из этих равенств теплоемкость газа при постоянном объеме —
![]()
молярная теплоемкость газа при постоянном объеме —
![]()
Если газ нагревается при постоянном давлении, то согласно первому закону термодинамики
![]()
где
![]()
Тогда теплоемкость газа при постоянном давлении
![]()
Молярная теплоемкость при постоянном давлении:
![]()
Таким образом, теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме. Их отношение равно
![]()
где ![]() —
показатель адиабаты (коэффициент
Пуассона).
—
показатель адиабаты (коэффициент
Пуассона).
Из-за малости величины коэффициента объемного расширения твердых и жидких тел работой, совершаемой ими при нагревании при постоянном давлении, можно пренебречь и считать, что теплоемкости при постоянном объеме и постоянном давлении практически совпадают. Поэтому теплоемкость твердых и жидких тел при заданной температуре может считаться вполне определенной величиной.
Билет 10
1 Теоре́ма Ште́йнера: момент инерции тела I относительно произвольной оси равен сумме момента инерции этого тела Ic относительно оси, проходящей через центр масс тела параллельно рассматриваемой оси, и произведения массы тела m на квадрат расстояния d между осями:
![]()
где
![]() —
масса
тела, и
—
масса
тела, и
R — расстояние между осями.
2 Вну́тренняя эне́ргия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Следовательно, внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
Внутренняя энергия тела - энергия движения и взаимодействия частиц, из которых состоит тело.
Или:
Внутренняя энергия тела - это суммарная кинетическая энергия движения молекул тела и потенциальная энергия их взаимодействия.
Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности значений в этих состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
где
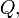 — теплота,
измеренная в Джоулях
— теплота,
измеренная в Джоулях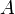 — работа,
измеренная в Джоулях
— работа,
измеренная в Джоулях
Для квазистатических процессов выполняется следующее соотношение:
![]()
где
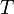 — температура,
измеренная в кельвинах
— температура,
измеренная в кельвинах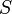 — энтропия,
измеренная в джоулях/кельвин
— энтропия,
измеренная в джоулях/кельвин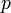 — давление,
измеренное в паскалях
— давление,
измеренное в паскалях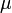 — химический
потенциал
— химический
потенциал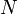 —
количество
частиц в системе
—
количество
частиц в системе
1. Общие сведения Количество теплоты, которое необходимо для нагревания на 1° единицы количества газа, называется теплоемкостью и обозначается буквой с. В технических расчетах теплоемкость измеряют в килоджоулях. При использовании старой системы единиц теплоемкость выражают в килокалориях (ГОСТ 8550-61) *.В зависимости от того, в каких единицах измеряют количество газа различают: мольную теплоемкость \хс в кдж/(кмолъ х X град); массовую теплоемкость с в кдж/(кг-град); объемную теплоемкость с в кдж/(м3град).При определении объемной теплоемкости необходимо указывать к каким значениям температуры и давления она относится. Принято определять объемную теплоемкость при нормальных физических условиях.Теплоемкость газов, подчиняющихся законам идеального газа, зависит только от температуры.Различают среднюю и истинную теплоемкость газов. Истинная теплоемкость представляет собой отношение бесконечно малого количества подведенной теплоты Дд при увеличении температуры на бесконечно малую величину At: Средняя теплоемкость определяет среднее количество подведенной теплоты при нагревании единицы количества газа на 1° в интервале температур от tx до t%: где q - количество теплоты, подведенной к единице массы газа при его нагревании от температуры tt до температуры t%.В зависимости от характера протекания процесса, при котором происходит подвод или отвод теплоты, величина теплоемкости газа будет различной.Если газ подогревается в сосуде постоянного объема (V =» = const), то теплота расходуется только на повышение его температуры.Если газ находится в цилиндре с подвижным поршнем, то при подводе теплоты давление газа остается постоянным (р = = const). При этом, подогреваясь, газ расширяется и производит работу против внешних сил при одновременном увеличении его температуры. Для того чтобы разность между конечной и начальной температурами во время нагрева газа в процессе р = const была бы такой же, как и в случае нагрева при V = = const, количество затрачиваемой теплоты должно быть больше на величину, равную совершенной газом работы в процессе р = = const. Из этого следует, что теплоемкость газа при постоянном давлении ср будет больше теплоемкости при постоянном объеме.Второй член в уравнениях характеризует количество теплоты, затрадиваемой на работу газа в процессе р = = const при изменении температуры на 1°.При проведении приближенных расчетов можно принимать, что теплоемкость рабодего тела постоянна и не зависит от температуры. В этом слудае знадения мольных теплоемкостей при постоянном объеме можно принять для одно-, двух- и многоатомных газов соответственно равными 12,6; 20,9 и 29,3 кдж/(кмоль-град) или 3; 5 и 7 ккал/(кмоль-град).
