
- •I. Водород. Кислород
- •I.1. Водород
- •I.2. Кислород
- •II. Элементы VII а группы периодической
- •II.1. Хлор. Способы получения
- •II.2. Йод. Получение йода
- •1. Изобразите фазовые диаграммы хлора, брома и йода.
- •III. Элементы VI а группы. Сера
- •8.1. Окислительные свойства h2so4.
- •8.2. Водоотнимающее действие h2so4.
- •IV. Элементы V а группы. Азот. Фосфор
- •IV.1. Азот
- •IV.2. Фосфор
- •V. Элементы группы iva. Углерод. Кремний
- •V.1. Углерод
- •V.2. Кремний
- •VI. Элементы группы III а. Бор
II.2. Йод. Получение йода
Йод - кристаллическое вещество черно-фиолетового цвета. Пары йода вызывают раздражение дыхательных путей и слизистой оболочки. При отравлении парами йода следует вдыхать пары 2%-ного водного раствора аммиака.
Опыт 1. Получение йода из йодида калия действием концентрированной серной кислоты. Отвесить по 0,5 г йодида калия и оксида марганца (IV), пересыпать в тигель и перемешать стеклянной палочкой. Поставить тигель со смесью на фарфоровый треугольник, налить 3-4 капли концентрированной серной кислоты и закрыть тигель маленькой колбой, наполненной холодной водой. Колбу закрепить в лапке штатива. Тигель слабо нагреть в течение нескольких минут. Полученный йод собрать в бюкс и взвесить. Вычислить выход в процентах. Полученное вещество сдать лаборанту.
Опыт 2. Получение йода из йодида калия действием хлора. Налить, в пробирку 5 мл насыщенного раствора йодида калия. Пропустить через раствор ток хлора. Полученное вещество отфильтровать на гладком фильтре и высушить на воздухе. Чем будет загрязнен полученный йод? Как можно его очистить?
СВОЙСТВА ЙОДА
Опыт 1. Взаимодействие йода с алюминием. В маленькую фарфоровую чашку поместить несколько кристаллов полученного сухого йода и порошка алюминия и осторожно перемешать (опыт проводить в вытяжном шкафу!). В приготовленную смесь внести каплю воды при помощи длинной пипетки или палочки. Какую роль играет вода в данном опыте?
Опыт 2. Растворимость йода в воде и органических растворителях:
2.1. Налить в две пробирки воду и опустить в них по одному кристаллу йода, полученного в предыдущих опытах. Содержимое пробирок сильно взболтать. Какова растворимость йода в воде? Какие молекулы и ионы содержатся в йодной воде? Написать уравнение реакции взаимодействия йода с водой.
Оставить одну пробирку для сравнения, во вторую пробирку прилить раствор йодида калия и сильно взболтать. Образованием какого вещества объясняется увеличение растворимости йода?
2.2. К 2-3 мл йодной воды прилить 1 н раствор щелочи до исчезновения окраски раствора. Полученный раствор подкислить серной кислотой.
2.3. Налить в ряд пробирок по 2-3 мл йодной воды и добавить в них по 2-3 капли органических растворителей (бензол, хлороформ, бензин, сероуглерод, четыреххлористый углерод). Содержимое пробирок взболтать и отметить окраску органического растворителя.
ПОЛУЧЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ
ГАЛОГЕНОВ
СОЕДИНЕНИЯ ГАЛОГЕНОВ С ВОДОРОДОМ
Опыт 1. Взаимодействие хлорида натрия, бромида натрия и йодида калия с концентрированной серной кислотой. Три пробирки поместить в штатив. В одну из них положить кристаллы хлорида натрия, в другую – бромида натрия и в третью – йодида калия. В каждую из пробирок прилить несколько капель концентрированной серной кислоты (кислоту брать пипеткой!). Что наблюдается? Чем загрязнены бромистый и йодистый водород, полученные этим способом? Какой из галогеноводородов является наиболее сильным восстановителем? Какие галогеноводороды можно получать действием концентрированной серной кислотой на соответствующий галогенид?
Опыт 2. Взаимодействие бромида натрия и йодида калия с концентрированной ортофосфорной кислотой. В одну из пробирок поместить небольшое количество бромида натрия, в другую – йодида калия. В обе пробирки добавить 60%-ный раствор ортофосфорной кислоты. Какие газы выделяются из пробирок?
Опыт 3. Получение хлорида водорода. (Опыт проводить в вытяжном шкафу!) Собрать прибор (рис. 4.а), заменив промывалки на U-образную трубку. В реакционную колбу поместить 10-15 г хлорида натрия, в U-образную трубку положить безводный хлорид кальция. Через воронку прилить в колбу 20-25 мл 70%-ного раствора серной кислоты, конец трубки от воронки должен быть погружен в жидкость. Наполнить сухую толстостенную склянку емкостью 25-50 мл выделяющимся хлоридом водорода. Как определить конец наполнения? Для чего в U-образную трубку поместили безводный хлорид кальция?
Опыт 4. Растворение хлорида водорода в воде (опыт «фонтан»). Закрыть склянку с хлоридом водорода пробкой с капилляром, обращенным внутрь. Перевернуть склянку с газом вверх дном, погрузить ее горло в ванну с водой (рис. 4.б). Объяснить происходящее явление.


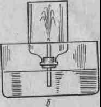
Рис.4. Прибор для получения хлористого водорода
Какова растворимость хлорида водорода в воде? Каков состав азеотропной смеси хлористоводородной кислоты с водой? Что называется азеотропной смесью жидкостей и чем она отличается от чистых жидкостей? Почему при получении хлорида водорода берут сухой хлорид натрия и концентрированную серную кислоту? Как получают хлористоводородную кислоту в промышленности? Какова процентная концентрация продажной хлористоводородной кислоты?
Опыт 5. Испытать действие бромистоводородной кислоты на металлы (магний или цинк) и на карбонат кальция.
Опыт 6. К 1 мл раствора бромистоводородной кислоты добавить 1-2 капли раствора нитрата серебра.
Опыт 7. Раствор йодистоводородной кислоты испытать на лакмус. Изучить его отношение к металлам цинку и магнию.
Опыт 8. Налить в три пробирки раствор йодистоводородной кислоты и добавить в первую пробирку растворы ацетата натрия и ацетата свинца, во вторую пробирку – нитрата серебра (1-2 капли), в третью положить небольшой кусочек мрамора. Написать уравнения реакций для всех процессов, протекавших в данном опыте.
Опыт 9. Все работы с газообразным фторидом водорода, а также с плавиковой кислотой следует проводить в вытяжном шкафу! При наливании фтористоводородной кислоты необходимо надевать резиновые перчатки, очки или маску. Следить за тем, чтобы капли фтористоводородной кислоты не попали на кожу. Пораженное место следует тщательно промыть водой и положить на него вату, смоченную 10 %-ным раствором хлорида кальция.
Испытать действие плавиковой кислоты на лакмус и цинк.
Опыт 10. К 1 мл раствора фтористоводородной кислоты прилить раствор хлорида кальция. Что наблюдается
Фториды каких металлов растворимы в воде? Чем объясняется низкая степень диссоциации фтористоводородной кислоты? Каково процентное содержание фтористого водорода в его азеотропной смеси с водой и в продажной плавиковой кислоте?
Опыт 11. Травление стекла фтористоводородной кислотой. Покрыть стеклянную пластинку слоем парафина; для этого ее следует опустить в расплавленный в фарфоровой чашке парафин и тотчас же вынуть. Концом перочинного ножа сделать на парафинированной поверхности надпись таким образом, чтобы открыть поверхность стекла. По краям надписи сделать из парафина небольшой барьер. Налить 10%-ный раствор фтористоводородной кислоты на парафинированную пластинку и оставить ее под тягой. Через 1-2 часа смыть раствор с пластинки и снять парафин. Что произошло со стеклом?
Как изменяются полярность, изобарно-изотермический потенциал и энергия связи в молекулах галогеноводородов? Как изменяются восстановительные свойства и сила галогеноводородных кислот?
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
Опыт 1. Получение белильной извести. (Опыт проводить под тягой!). К 2 г чистой гашеной извести (гидроксида кальция) добавить 10-15 мл воды и хорошо перемешать. Полученную смесь поместить в маленький стакан, охлаждаемый льдом (почему необходимо охлаждение?), и пропускать хлор, очищенный от хлорида водорода (как это сделать?), в течение 10-20 мин.
Опыт 2. Часть полученного препарата обработать 10 мл воды и отфильтровать нерастворившиеся вещества. Взять небольшое количество полученного раствора и испытать действие его на индиго и окрашенную ткань.
Может ли угольная кислота вытеснить хлорноватистую кислоту из раствора ее соли? Сравнить величины констант диссоциации угольной и хлорноватистой кислот.
Опыт 3. К части полученного раствора белильной извести прилить раствор 1 н. серной кислоты до кислой реакции и осторожно понюхать. Что происходит с белильной известью при нагревании концентрированного раствора?
Как изменяется сила кислот в ряду: хлорноватистая – бромноватистая – йодноватистая кислота? Какие ионы находятся в растворах этих кислот? Как изменяются в указанном ряду устойчивость и окислительное действие кислот? Объяснить наблюдаемые закономерности.
Опыт 4. Приготовить раствор йодноватой кислоты и разлить его в две пробирки. В одну пробирку прилить раствор йодида калия. Какое вещество при этом выделяется? В другую пробирку прилить раствор сульфата железа (II). Что наблюдается? На какие свойства йодноватой кислоты указывают проведенные опыты? Написать формулы йодных кислот. Какие известны кислородные соединения йода?
СРАВНЕНИЕ ОКИСЛИТЕЛЬНЫХ СВОЙСТВ
ГАЛОГЕНОВ
Опыт 1. Налить в две пробирки по 1 мл раствора бромной и йодной воды, разбавить 2-3 мл воды, ввести по нескольку капель органического растворителя (четыреххлористого углерода, хлороформа, бензола и т.д.) и сильно взболтать. Приливая по каплям в обе пробирки хлорную воду и энергично взбалтывая, следить за изменением окраски слоя органического растворителя.
Опыт 2. Налить в пробирку по капле раствора йодида и бромида калия и 3-5 капель органического растворителя. Прибавляя по каплям хлорную воду и сильно взбалтывая, следить за изменением окраски слоя растворителя.
Опыт 3. Приготовить немного раствора бромноватой кислоты. Для этого 2-3 капли насыщенного раствора бромата калия смешать с 1-2 мл разбавленного раствора серной кислоты. Бросить в раствор маленький кристаллик йода, несколько раз перемешать содержимое пробирки, декантировать раствор и прилить к нему несколько капель органического растворителя. Что наблюдается? Будет ли бром вытеснять йод из йодноватой кислоты?
Вопросы и задания
