
- •I. Водород. Кислород
- •I.1. Водород
- •I.2. Кислород
- •II. Элементы VII а группы периодической
- •II.1. Хлор. Способы получения
- •II.2. Йод. Получение йода
- •1. Изобразите фазовые диаграммы хлора, брома и йода.
- •III. Элементы VI а группы. Сера
- •8.1. Окислительные свойства h2so4.
- •8.2. Водоотнимающее действие h2so4.
- •IV. Элементы V а группы. Азот. Фосфор
- •IV.1. Азот
- •IV.2. Фосфор
- •V. Элементы группы iva. Углерод. Кремний
- •V.1. Углерод
- •V.2. Кремний
- •VI. Элементы группы III а. Бор
I.2. Кислород
Электронная конфигурация внешнего электронного уровня атома кислорода 2s22p4. Для кислорода наиболее характерны степени окисления:(0), (-1), (-2).
Газообразный молекулярный кислород проявляет большую химическую активность. Кислород поддерживает горение и образует оксиды с большинством элементов. По электроотрицательности он стоит на втором месте после фтора, поэтому в реакциях с другими веществами (кроме фтора) ведет себя как окислитель. Со многими веществами кислород взаимодействует при обычной температуре, а при повышенной, или в присутствии катализатора – с большинством химических соединений.
Степень окисления кислорода -1 реализуется в пероксиде водорода Н2О2.
Перекись водорода представляет собой бледно-голубую, сиропообразную жидкость, tк=150ºС. Плотность 1,45 г/см3, температура плавления -0,89°C. Это непрочное соединение. Оно разлагается с взрывом на воду и кислород, при этом выделяется большое количество теплоты. Чистый пероксид водорода стабилен и может храниться неограниченно долго. Однако в присутствии почти любых примесей он диспропорционирует в термодинамически более стабильные соединения со степенью окисления кислорода (0) и - (2):
H2O2 = H2O + ½O2.
Диспропорционирование ускоряется в присутствии катализатора, например MnO2. Пероксид водорода реагирует с другими веществами как окислитель и как восстановитель.
Восстановитель:
H2O2 – 2ē = O2 + 2H+ при pH ≤ 7
H2O2 + 2OH- – 2 ē = O2 + 2H2O при pH > 7
Окислитель:
H2O2 + 2H+ + 2ē = 2H2O при pH < 7
H2O2 + 2ē = 2OH- при pH≥7
ПОЛУЧЕНИЕ КИСЛОРОДА
Работа с газометром. Для собирания и хранения газов применяют стеклянные или металлические газометры (рис.2). Умеренно-растворимые в воде газы, в том числе и кислород, собирают и хранят в них над водой. Стеклянный газометр состоит из двух частей (рис. 2,б) воронки 1, снабженной краном 2, и толстенной склянки 3, имеющей отверстие для выхода газа 4 и сливное отверстие 5 внизу для воды.
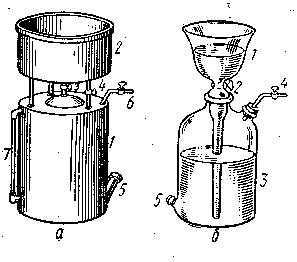
Рис. 2. Газометры: а – металлический, б – стеклянный
Заполнение газометра водой. Снять воронку 1 и заполнить водой склянку 3. Перевернуть воронку 1 трубкой вверх, закрыть кран 2, заполнить водой трубку воронки, снова перевернуть воронку трубкой вниз, закрыв отверстие ее большим пальцем. Быстро погрузить воронку в склянку 3, наполненную до верха водой. Если в газометре остались пузырьки воздуха, то их следует удалить через кран 2, пользуясь металлической проволочкой или лёгким покачиванием газометра. Поставить заполненный водой газометр на край стола около водопроводной раковины. Закрыв все краны газометра, открыть нижнее его отверстие 5. Выливается ли вода из газометра?
Заполнение газометра кислородом. Измерить объем газометра. Написать уравнение разложения перманганата калия. Рассчитать, сколько граммов соли следует взять, чтобы выделившейся при этом кислород заполнил газометр на 2/з части. Взвесить нужное количество перманганата калия, перенести его в стеклянную реторту, снабженную резиновой трубкой, и укрепить реторту в штативе. Нагреть реторту с перманганатом калия и, подождав, пока вытеснится воздух из реторты и газоотводной трубки, ввести газоотводную трубку в сливное отверстие газометра. Вытекающая вода должна сливаться в раковину. Заполнив газометр кислородом (на 2/з), вынуть газоотводную трубку и закрыть отверстие пробкой. Следить за тем, чтобы воронка 1 была наполнена водой. После того как газ в газометре охладится до комнатной температуры, открыть на короткое время кран 2 (для чего?). Газометр может быть наполнен и из баллона с кислородом. В каких условиях может быть получен кислород из перекиси бария и бертолетовой соли? Напишите уравнения реакций.
Получение тока кислорода из газометра.
Чтобы наполнить сосуд кислородом, необходимо налить в него до краев воду, закрыть пластинкой, смазанной тонким слоем вазелина, перевернуть и погрузить сосуд в ванну с водой. Опустить газоотводную трубку в ванну и, открыв краны 2 и 4, отрегулировать скорость подачи кислорода; она должна быть такой, чтобы можно было легко считать пузырьки газа. Подвести газоотводную трубку под отверстие сосуда, заполненного водой. Когда сосуд будет почти наполнен кислородом, закрыть его под водой стеклянной пластинкой и вынуть из воды. Для чего нужно оставить в сосуде небольшое количество воды? Какие примеси содержит собранный кислород? Под каким давлением находится газ в газометре?
СВОЙСТВА КИСЛОРОДА
Опыт 1. Приготовить 2 железные ложечки для сжигания. В одну поместить кусочек серы величиной с горошину в другую немного фосфора. По очереди нагреть их в пламени горелки (под тягой!), затем внести расплавы в сосуды, наполненные кислородом из газометра, и неплотно прикрыть сосуды крышками. Обратить внимание на цвет и размер пламени. После окончания реакций добавить в сосуды по 2 мл воды и растворить продукты реакций. Полученные растворы перелить в пробирки, добавить по 1 капле универсального индикатора и определить рН.
Опыт 2. Положить в ложечку для сжигания небольшой кусочек древесного угля, накалить и внести в банку с кислородом. Как изменяется интенсивность горения угля в кислороде?
Опыт 3. Свернуть спиралью отрезок стальной проволоки и прикрепить его к концу ложечки для сжигания. Присоединить к проволоке кусочек корковой пробки. Поджечь пробку и быстро внести проволоку в банку с кислородом. Что происходит?
Вопросы и задания
1. Напишите уравнения реакций горения серы и фосфора и рассчитайте их энтальпии.
2. Почему фосфор и серу нагревают перед тем, как внести в колбы, заполненные кислородом?
3. Напишите уравнения реакций взаимодействия продуктов горения серы и фосфора с водой. Укажите рН полученных растворов.
4. Какой вывод о свойствах кислорода можно сделать на основании проведенных опытов? Как влияет на интенсивность горения веществ замена воздуха кислородом? Чем это объясняется?
5. Почему у кислорода низкие температуры плавления и кипения?
6. Какое строение имеет молекула озона?
Задачи
1. Сколько граммов хлората калия, содержащего 4% посторонних примесей, следует взять для получения 25 л кислорода при 37оС и 101,3 кПа? Ответ: 83,6 г.
2. Какова масса 1 л кислорода, озонированного на 5% (0оС и 101,3 кПа)? Вычислите содержание озона в процентах по массе. Сколько молекул озона содержит 1 мл газа? Ответ: 1,46 г; 7,32%; 1,34 1018.
ПЕРЕКИСЬ ВОДОРОДА
ПОЛУЧЕНИЕ И СВОЙСТВА ПЕРЕКИСИ ВОДОРОДА
Опыт 1. В колбу емкостью 50 мл налить 20 мл 5%-ного раствора серной кислоты и охладить ее до 0°. Взбалтывая содержимое колбы в течение 5-10 мин, всыпать в нее небольшими порциями около 1 г перекиси бария. Полученный раствор перекиси водорода отфильтровать от осадка. Изучить свойства перекиси водорода.
Опыт 2. Диспропорционирование перекиси водорода. В пробирку с раствором перекиси водорода внести двуокись марганца. Какой газ выделяется? Какую роль играет двуокись марганца?
Опыт 3. Окислительные свойства.
3.1. К раствору перекиси водорода прилить несколько капель раствора йодида калия. Разбавить раствор водой и внести в него 1-2 капли раствора крахмала. Что происходит?
3.2. Получить осадок сульфида свинца взаимодействием растворов нитрата свинца и сульфида натрия. Небольшое количество осадка, промытого водой путем декантации, обработать раствором перекиси водорода. Почему изменился цвет осадка?
Опыт 4. Восстановительные свойства. К раствору перманганата калия, подкисленному серной кислотой прилить раствор перекиси водорода. Что наблюдается? Написать уравнения реакций в молекулярной и электронно-ионной формах.
Вопросы и задания
1. Изобразите геометрическую конфигурацию молекулы пероксида водорода. Почему молекула Н2О2 полярна? Составьте электронную формулу Н2О2, укажите степени окисления элементов и валентность атома кислорода.
2. Какие частицы присутствуют в водном растворе пероксида водорода? Укажите их названия и геометрическое строение.
3. Составьте уравнения полуреакций, иллюстрирующие окислительныеи восстановительные свойства пероксида водорода в кислотной и щелочной среде. В какой среде пероксид водорода является более сильным: а) окислителем, б) восстановителем? Какие свойства в целом преобладают у Н2О2? При ответе используйте справочные данные.
Задачи
1. Из подкисленного раствора КI раствором Н2О2 массой 0,8 г выделили 0,3 г йода. Вычислите массовую долю Н2О2 в растворе. Ответ: 5%.
2. Сколько граммов 3,4%-ного раствора Н2О2 требуется для окисления 100 мл молярного раствора FeSO4 в присутствии H2SO4? Ответ: 50 г.
3. Для полного обесцвечивания 20 мл 0,02 М раствора KMnO4 в сернокислой среде потребовался равный объем раствора Н2О2. Какова молярность последнего? Какой объем кислорода (0оС и 101,3 кПа) выделился при этом? Ответ: 0,05 М; 22,4 мл.
