
- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Рецензент:
- •А) изготовление простого фильтра;
- •Лабораторная работа № 18 Тема: методы очистки и выделения органических соединений. Перекристаллизация
- •18.1 Теоретическая часть
- •18.2 Экспериментальная часть
- •Лабораторная работа № 19 Тема: методы очистки и выделения органических соединений. Сублимация
- •19.1 Теоретическая часть
- •19.2. Экспериментальная часть
- •Лабораторная работа № 20 Тема: методы очистки и выделения органических соединений. Перегонка
- •20.1 Теоретическая часть
- •20.2. Экспериментальная часть
- •20.3. Отчет о работах №18-20
- •20.4. Контрольные вопросы
- •Лабораторная работа № 21 Тема: качественный элементный анализ органических соединений
- •21.1 Теоретическая часть
- •21.2 Экспериментальная часть
- •21.2.1 Обнаружение углерода пробой на обугливание (тяга !).
- •21.2.2 Обнаружение углерода и водорода окислением вещества оксидом меди (II).
- •21.2.3 Проба Бейльштейна на галогены.
- •21.2.4 Обнаружение галогенов действием натрия на спиртовой раствор органического вещества.
- •21.3 Отчет о работе
- •22.1.2 Химические свойства
- •22.2 Экспериментальная часть
- •22.2.3 Бромирование предельных углеводородов
- •22.3. Отчет о работе
- •22.4. Контрольные вопросы
- •22.5. Индивидуальное задание
- •23.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •23.2 Экспериментальная часть
- •23.2.1 Получение этилена и его горение
- •23.2.2 Присоединение к этилену брома
- •23.2.3 Отношение этилена к окислителям
- •23.2.4 Бромирование непредельных углеводородов
- •23.3 Отчет о работе
- •23.4. Контрольные вопросы
- •Лабораторная работа № 24 Тема: алкины
- •24.1 Теоретическая часть
- •24.1.1 Методы получения
- •24.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •24.2 Экспериментальная часть
- •24.3 Отчет о работе
- •24.4. Контрольные вопросы
- •24.5. Индивидуальное задание
- •1. Получение бензола из ацетилена:
- •3. Из ароматических соединений:
- •4. Гомологи бензола получают из галогенпроизводных реакцией Вюрца-Фиттига:
- •25.1.2 Химические свойства
- •25.2 Экспериментальная часть
- •25.2.1 Окисление ароматических углеводородов
- •25.2.2 Бромирование ароматических углеводородов
- •25. 2.3. Алкилирование бензола.
- •25.3 Отчет о работе
- •25.4. Контрольные вопросы
- •Лабораторная работа №26 Тема: спирты и фенолы
- •26.1Теоретическая часть
- •26.1.1 Методы получения спиртов
- •26.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •26.1.3 Методы получения фенолов
- •26.1.4 Химические свойства
- •26.2 Экспериментальная часть
- •26.2.1 Обнаружение воды в спирте и обезвоживание спирта
- •26.2.2 Свойства изоамилового спирта
- •26.2.3 Отношение спиртов к индикаторам
- •26.2.4 Окисление этилового спирта окисью меди
- •26.2.5 Растворение фенола в воде
- •26.2.6 Получение фенолята натрия
- •26.2.7 Получение трибромфенола
- •26.3. Отчет о работе
- •26.4. Контрольные вопросы
- •Лабораторная работа №27 Тема: альдегиды и кетоны
- •27.1 Теоретическая часть
- •27.1.1 Методы получения
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •27.1.2 Химические свойства альдегидов и кетонов
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •27.2 Экспериментальная часть
- •27.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •27.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •27.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •27.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •27.3. Отчет о работе
- •27.4. Контрольные вопросы
- •27.5. Индивидуальное задание лабораторная работа №28 Тема: карбоновые кислоты
- •28.1 Теоретическая часть
- •28.1.3 Химические свойства
- •28.2 Экспериментальная часть
- •28.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •28.2.2 Получение и свойства муравьиной кислоты
- •28.2.3 Получение и свойства уксусной кислоты
- •28.2.4.Реакции олеиновой и сорбиновой кислот с бромной водой
- •28.2.5.Окисление олеиновой кислоты перманганатом калия
- •28.3. Отчет о работе
- •28.4. Контрольные вопросы
- •28.5. Индивидуальное задание
- •29.2 Экспериментальная часть
- •29.2.1. Гидролиз мыла
- •29.2.2. Выделение высших жирных кислот из мыла
- •29.2.3. Образование нерастворимых солей высших жирных кислот
- •29.2.4. Взаимодействие растительного масла с водным раствором перманганата калия (реакция Вагнера)
- •29.2.5. Омыление жира спиртовым раствором гидроксида натрия
- •29.2.6. Определение кислотного числа, числа омыления и эфирного числа (выполняется в порядке нирс)
- •29.3.Отчет о работе
- •29.4.Вопросы для контроля знаний
- •29.5. Индивидуальное задание
- •30.1.2. Свойства и реакционная способность
- •30.1.3.Применение
- •30.3. Экспериментальная часть
- •30.4. Контрольные вопросы
- •30.5. Индивидуальное задание лабораторная работа №31 Тема:качественные реакции на функциональные группы
- •31.1. Теоретическая часть
- •Простые эфиры – легколетучие жидкости (низшие) с характерным запахом. Качественной реакцией на простые эфиры является реакция с иодистоводородной кислотой:
- •31.2.Экспериментальная часть
- •31.2.1. Содержание задания
- •31.2.2.Ход анализа органических соединений
- •1. Предварительные испытания
- •31.2.3.Проведение некоторых качественныхреакций
- •31.3.Типовые экспериментальные задачи
- •Лабораторная работа №32 Тема:идентификация полимерных материалов
- •32.1.Теоретическая часть
- •32.2.Экспериментальная часть
- •31.3.Отчет о работе
- •Содержание
- •Лукашов Сергей Викторович
30.5. Индивидуальное задание лабораторная работа №31 Тема:качественные реакции на функциональные группы
Цель работы: теоретическое и практическое освоение основных приемов и методов качественного функционального анализа
Задания:1) определить принадлежность выданного вещества к определенному классу органических соединений.
2) решить экспериментальные задачи
3) оформить отчет о работе
31.1. Теоретическая часть
Принадлежность вещества к тому или иному классу соединений устанавливают с помощью качественного функционального анализа, т.е. путем проведения характерных качественных реакций
Качественные реакции на углеводороды
В качественном функциональном анализе самой сложной задачей является обнаружение вида углеводородов. Эта задача решается посредством сравнения различного отношения к серной кислоте. Предельные и ароматические углеводороды не растворимы в серной кислоте, в то время как непредельные - растворимы.
Непредельные углеводороды обесцвечивают растворы Br2 в СCl4 на холоду, а полиалкилбензолы не обесцвечивают.
Отличие этиленовых углеводородов от ацетиленовых состоит в способности последних образовывать ацетилениды:
R-C≡CH + Cu(NH3)2Cl ® R-C≡CCu + NH4Cl + NH3
или с реактивом Несслера: 2R-C≡CH + K2HgJ4 ® (R-C≡C)2Hg + 4KJ + 2H2O
Идентификация ароматических углеводородов проводится при помощи пробы с безводным AlCl3, с которым арены дают окраску:
При взаимодействии бензола с хлороформом в присутствии AlCI3 происходит образование трифенилметана, хлористого трифенилметана, а также его комплексной соли, которая имеет окраску:
CHCI3
C6H6 ¾® (C6H5)3 CCI + (C6H5)3 CH +(C6H5)2CH2 + HCI
(C6H5)3 CCI + AlCI3 ® [(C6H5)3 C]+AlCI4-
Эта реакция является качественной на ароматические углеводороды.
.Качественные реакции на спирты
1. Самой чувствительной реакцией является ксантогеновая проба, в соответствии с которой вещество смешивают с СS2, прибавляют NaOH и CuSO4. В присутствие спиртовой группы образуется ксантогенат меди, имеющий коричневую окраску, в отсутствие спирта – синий цвет. Химизм процесса:
ROH + NaOH + CS2 ® ROC(S) – SK + H2O
4ROC(S) – SK + 2CuSO4 ® 2(ROC(S) –S)2 Cu + (ROC(S)S)2 + 2Na2SO4
2.Взаимодействие с металлическим натрием.
2ROH + 2Na ® 2RONa + H2
3. Взаимодействие спиртов с хлорангидридами кислот. По выделению белого облачка HCI судят о присутствии спирта.
ROH + CH3COCI ® CH3COOR + HCI
Первичные, вторичные и третичные спирты различают с помощью пробы Лукаса (ZnCI2 + HCI). Быстрее всего реагируют третичные спирты, наиболее медленно – первичные (необходимо нагревание), вторичные занимают промежуточное положение. Кроме того, первичные спирты при окислении дают альдегиды, которые можно открыть реакцией “серебряного зеркала“, вторичные окисляются до кетонов, не вступающих в такую реакцию.
Атомность спиртов устанавливают по внешним признакам:
- одноатомные спирты представляют собой легкоподвижные жидкости, растворимые в воде (низшие спирты);
- двух- и трехатомные спирты – вязкие, сладковатые на вкус жидкости. С увеличением числа ОН-групп растворимость увеличивается.
Качественной реакцией на многоатомные спирты является реакция с гидроксидом меди в щелочной среде:
В процессе реакции происходит растворение синего осадка гидроксида меди(II) с образованием комплексного глицерата меди сине-фиолетового цвета.
Фенолы легко распознают с помощью хлорного железа. Одноатомные фенолы дают с FeCI3 фиолетовую окраску за счет образования комплексного фенолята железа Fe(OC6H5)3
Если в фенольном кольце не будет заместителей второго рода, то окраска будет слабой или или вообще исчезнет. Окраска усиливается при наличии в кольце карбонильной и карбоксильной групп.
Многоатомные фенолы дают цветные реакции c хлорным железом и с другими реагентами. Так, пирогаллол в спиртовом растворе в присутствии следов иода окрашивается в пурпурно-красный цвет. При взаимодействии фенолов с оксиальдегидами образуются ярко-окрашенные фумароны. Симметричные фенолы дают цветную реакцию при действии на сосновую лучину, смоченную HCI.
Для открытия фенола используют его способность реагировать с бромом в обычных условиях с образованием 2,4,6-трибромфенола, выпадающего в виде белого осадка:
С6Н5ОН + 3Br2 ® C6H2Br3OH + 3HBr
Качественные реакции карбонильных соединений основаны на способности альдегидов окисляться аммиачным раствором гидроксида серебра (реактив Толленса):
RCOH + 2Ag(NH3)2 OH ® RCOOH + 2Ag + 4NH3 + H2O
Металлическое серебро выделяется тонким слоем на стенках пробирки, поэтому реакция носит название реакции ”серебряного зеркала”. Специфической реакцией альдегидной группы является также ее способность восстанавливать Феллингову жидкость – реакция “медного зеркала”:
RCOH + 2Cu(OH)2 ® RCOOH + Cu2O + 2H2O
На стенках пробирки образуется красный налет оксида меди(I). Эти две реакции позволяют отличить альдегиды от кетонов (кетоны не окисляются этими окислителями).
Характерной реакцией на альдегидную группу является реакция с 2,4-динитрофенилгидразином с образованием желтого осадка 2,4-динитрофенилгидразона:
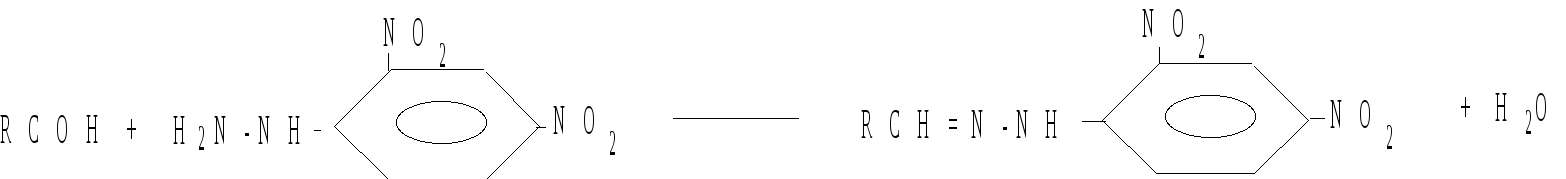
Качественной реакцией на ацетон является реакция с нитропруссидом натрия – окрашивание смеси в красный цвет.
Карбоновые кислоты в водном растворе диссоциируют с образованием карбоксилат-аниона и протона:
RCOOH « RCOO- + H+
Протон гидроксила в карбоксильной группе отщепляется легче, чем в спиртах (влияние полярной карбонильной группы). Образование карбоксилат-аниона с делокализованным зарядом:
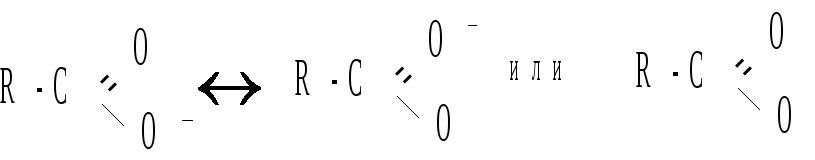
также является причиной увеличения кислотности карбоновых кислот по сравнению со спиртами. На легкость отщепления протона влияет также радикал, связанный с карбоксильной группой.
Карбоновые кислоты дают характерное окрашивание с индикаторами (лакмус, метилоранж окрашиваются в красный цвет), проводят электрический ток (т.е. являются электролитами) и проявляют кислотные свойства, сходные со свойствами минеральных кислот, но это более слабые кислоты. Однако, угольная кислота слабее карбоновых и может быть вытеснена из ее солей:
2СН3СООН + Na2CO3 ® 2CH3COONa + CO2 + H2O
Выделение углекислого газа при действии карбоновых кислот на карбонаты металлов является качественной реакцией на карбоновые кислоты.
Некоторые карбоновые кислоты характеризуются специфическими свойствами, на чем и основаны качественные реакции. Так, муравьиная кислота дает реакцию серебряного зеркала, дикарбоновые кислоты в зависимости от строения дают специфические продукты при нагревании. Оксикислоты можно распознать по двойственной функции, как и фенолокислоты. Оксикислоты в зависимости от различного расположения окси- и карбоксильной групп по-разному ведут себя при нагревании.
