
- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Рецензент:
- •А) изготовление простого фильтра;
- •Лабораторная работа № 18 Тема: методы очистки и выделения органических соединений. Перекристаллизация
- •18.1 Теоретическая часть
- •18.2 Экспериментальная часть
- •Лабораторная работа № 19 Тема: методы очистки и выделения органических соединений. Сублимация
- •19.1 Теоретическая часть
- •19.2. Экспериментальная часть
- •Лабораторная работа № 20 Тема: методы очистки и выделения органических соединений. Перегонка
- •20.1 Теоретическая часть
- •20.2. Экспериментальная часть
- •20.3. Отчет о работах №18-20
- •20.4. Контрольные вопросы
- •Лабораторная работа № 21 Тема: качественный элементный анализ органических соединений
- •21.1 Теоретическая часть
- •21.2 Экспериментальная часть
- •21.2.1 Обнаружение углерода пробой на обугливание (тяга !).
- •21.2.2 Обнаружение углерода и водорода окислением вещества оксидом меди (II).
- •21.2.3 Проба Бейльштейна на галогены.
- •21.2.4 Обнаружение галогенов действием натрия на спиртовой раствор органического вещества.
- •21.3 Отчет о работе
- •22.1.2 Химические свойства
- •22.2 Экспериментальная часть
- •22.2.3 Бромирование предельных углеводородов
- •22.3. Отчет о работе
- •22.4. Контрольные вопросы
- •22.5. Индивидуальное задание
- •23.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •23.2 Экспериментальная часть
- •23.2.1 Получение этилена и его горение
- •23.2.2 Присоединение к этилену брома
- •23.2.3 Отношение этилена к окислителям
- •23.2.4 Бромирование непредельных углеводородов
- •23.3 Отчет о работе
- •23.4. Контрольные вопросы
- •Лабораторная работа № 24 Тема: алкины
- •24.1 Теоретическая часть
- •24.1.1 Методы получения
- •24.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •24.2 Экспериментальная часть
- •24.3 Отчет о работе
- •24.4. Контрольные вопросы
- •24.5. Индивидуальное задание
- •1. Получение бензола из ацетилена:
- •3. Из ароматических соединений:
- •4. Гомологи бензола получают из галогенпроизводных реакцией Вюрца-Фиттига:
- •25.1.2 Химические свойства
- •25.2 Экспериментальная часть
- •25.2.1 Окисление ароматических углеводородов
- •25.2.2 Бромирование ароматических углеводородов
- •25. 2.3. Алкилирование бензола.
- •25.3 Отчет о работе
- •25.4. Контрольные вопросы
- •Лабораторная работа №26 Тема: спирты и фенолы
- •26.1Теоретическая часть
- •26.1.1 Методы получения спиртов
- •26.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •26.1.3 Методы получения фенолов
- •26.1.4 Химические свойства
- •26.2 Экспериментальная часть
- •26.2.1 Обнаружение воды в спирте и обезвоживание спирта
- •26.2.2 Свойства изоамилового спирта
- •26.2.3 Отношение спиртов к индикаторам
- •26.2.4 Окисление этилового спирта окисью меди
- •26.2.5 Растворение фенола в воде
- •26.2.6 Получение фенолята натрия
- •26.2.7 Получение трибромфенола
- •26.3. Отчет о работе
- •26.4. Контрольные вопросы
- •Лабораторная работа №27 Тема: альдегиды и кетоны
- •27.1 Теоретическая часть
- •27.1.1 Методы получения
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •27.1.2 Химические свойства альдегидов и кетонов
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •27.2 Экспериментальная часть
- •27.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •27.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •27.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •27.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •27.3. Отчет о работе
- •27.4. Контрольные вопросы
- •27.5. Индивидуальное задание лабораторная работа №28 Тема: карбоновые кислоты
- •28.1 Теоретическая часть
- •28.1.3 Химические свойства
- •28.2 Экспериментальная часть
- •28.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •28.2.2 Получение и свойства муравьиной кислоты
- •28.2.3 Получение и свойства уксусной кислоты
- •28.2.4.Реакции олеиновой и сорбиновой кислот с бромной водой
- •28.2.5.Окисление олеиновой кислоты перманганатом калия
- •28.3. Отчет о работе
- •28.4. Контрольные вопросы
- •28.5. Индивидуальное задание
- •29.2 Экспериментальная часть
- •29.2.1. Гидролиз мыла
- •29.2.2. Выделение высших жирных кислот из мыла
- •29.2.3. Образование нерастворимых солей высших жирных кислот
- •29.2.4. Взаимодействие растительного масла с водным раствором перманганата калия (реакция Вагнера)
- •29.2.5. Омыление жира спиртовым раствором гидроксида натрия
- •29.2.6. Определение кислотного числа, числа омыления и эфирного числа (выполняется в порядке нирс)
- •29.3.Отчет о работе
- •29.4.Вопросы для контроля знаний
- •29.5. Индивидуальное задание
- •30.1.2. Свойства и реакционная способность
- •30.1.3.Применение
- •30.3. Экспериментальная часть
- •30.4. Контрольные вопросы
- •30.5. Индивидуальное задание лабораторная работа №31 Тема:качественные реакции на функциональные группы
- •31.1. Теоретическая часть
- •Простые эфиры – легколетучие жидкости (низшие) с характерным запахом. Качественной реакцией на простые эфиры является реакция с иодистоводородной кислотой:
- •31.2.Экспериментальная часть
- •31.2.1. Содержание задания
- •31.2.2.Ход анализа органических соединений
- •1. Предварительные испытания
- •31.2.3.Проведение некоторых качественныхреакций
- •31.3.Типовые экспериментальные задачи
- •Лабораторная работа №32 Тема:идентификация полимерных материалов
- •32.1.Теоретическая часть
- •32.2.Экспериментальная часть
- •31.3.Отчет о работе
- •Содержание
- •Лукашов Сергей Викторович
23.2 Экспериментальная часть
Оборудование и реактивы: этиловый спирт, 96%-ный; серная кислота (d = 1,84 г/см3); этилен; бромная вода, насыщенный раствор; марганцевокислый калий, 0,1 н. раствор; жидкие алкены (керосин); раствор брома в органическом растворителе; аммиак, 25%-ный раствор; лакмусовая бумага синяя; углекислый натрий, 1 н. раствор; азотная кислота (d = 1,4 г/см3). песок, газоотводная трубка; стеклянная палочка.
23.2.1 Получение этилена и его горение
В сухую пробирку помещают несколько крупинок песка, 2 капли этилового спирта и 4 капли концентрированной серной кислоты. Закрывают пробирку пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени горелки. Выделяющийся газ поджигают у конца газоотводной трубки – он горит светящимся пламенем.
Химизм процесса:
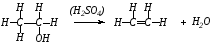
Выделяющийся этилен горит светящимся пламенем:
C2H4
+ ЗO2
 2СO2
+ 2Н2О
2СO2
+ 2Н2О
Концентрированная серная кислота является окислителем. При нагревании смеси спирта с концентрированной серной кислотой образуется, кроме этилена и следов диэтилового эфира (СзН5)2О, ряд продуктов окисления органических соединений, например СО2, уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом восстанавливается углеродом до сернистого ангидрида:
2H2SO4
+ С
 СО2
+ 2SO2
+ 2H2O
СО2
+ 2SO2
+ 2H2O
Сернистый ангидрид также может обесцвечивать растворы брома и марганцевокислого калия подобно этилену. Поэтому образующийся этилен промывают раствором щелочи для очистки от SO2. Если реакцию вести в присутствии песка, сульфата алюминия (катализаторы, ускоряющие дегидратацию спирта), почернения смеси не происходит, следовательно, сернистый ангидрид не образуется.
Дегидратация спиртов является общим способом получения непредельных углеводородов.
23.2.2 Присоединение к этилену брома
Не прекращая нагревания пробирки со смесью спирта и серной кислоты (см. опыт 6.2.1), опускают конец газоотводной трубки в пробирку с 5 каплями бромной воды. Бромная вода быстро обесцвечивается вследствие присоединения атомов брома по месту двойной связи.
Химизм процесса:
СН2=СН2
+ Вr2
 СН2-СН2
СН2-СН2
│ │
Br Br
1,2-дибромэтан
Для алкенов характерны реакции присоединения по месту двойной связи.
Реакция обесцвечивания водного раствора брома служит качественной реакцией на двойную связь.
23.2.3 Отношение этилена к окислителям
Не прекращая нагревания пробирки со смесью спирта и серной кислоты (см. опыт 23.2.1), опускают конец газоотводной трубки в пробирку с 1 каплей раствора марганцевокислого калия и 4 каплями воды. Раствор марганцевокислого калия быстро обесцвечивается. При этом алкен окисляется в двухатомный спирт. Химизм процесса:
3CH2=CH2
+ 2KMnO4
+
4H2O
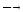 3CH2
– CH2+
2KOH + 2MnO2
3CH2
– CH2+
2KOH + 2MnO2
│ │
OH OH
этиленгликоль
Эта реакция является качественной реакцией на двойную связь.
