- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Рецензент:
- •А) изготовление простого фильтра;
- •Лабораторная работа № 18 Тема: методы очистки и выделения органических соединений. Перекристаллизация
- •18.1 Теоретическая часть
- •18.2 Экспериментальная часть
- •Лабораторная работа № 19 Тема: методы очистки и выделения органических соединений. Сублимация
- •19.1 Теоретическая часть
- •19.2. Экспериментальная часть
- •Лабораторная работа № 20 Тема: методы очистки и выделения органических соединений. Перегонка
- •20.1 Теоретическая часть
- •20.2. Экспериментальная часть
- •20.3. Отчет о работах №18-20
- •20.4. Контрольные вопросы
- •Лабораторная работа № 21 Тема: качественный элементный анализ органических соединений
- •21.1 Теоретическая часть
- •21.2 Экспериментальная часть
- •21.2.1 Обнаружение углерода пробой на обугливание (тяга !).
- •21.2.2 Обнаружение углерода и водорода окислением вещества оксидом меди (II).
- •21.2.3 Проба Бейльштейна на галогены.
- •21.2.4 Обнаружение галогенов действием натрия на спиртовой раствор органического вещества.
- •21.3 Отчет о работе
- •22.1.2 Химические свойства
- •22.2 Экспериментальная часть
- •22.2.3 Бромирование предельных углеводородов
- •22.3. Отчет о работе
- •22.4. Контрольные вопросы
- •22.5. Индивидуальное задание
- •23.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •23.2 Экспериментальная часть
- •23.2.1 Получение этилена и его горение
- •23.2.2 Присоединение к этилену брома
- •23.2.3 Отношение этилена к окислителям
- •23.2.4 Бромирование непредельных углеводородов
- •23.3 Отчет о работе
- •23.4. Контрольные вопросы
- •Лабораторная работа № 24 Тема: алкины
- •24.1 Теоретическая часть
- •24.1.1 Методы получения
- •24.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •24.2 Экспериментальная часть
- •24.3 Отчет о работе
- •24.4. Контрольные вопросы
- •24.5. Индивидуальное задание
- •1. Получение бензола из ацетилена:
- •3. Из ароматических соединений:
- •4. Гомологи бензола получают из галогенпроизводных реакцией Вюрца-Фиттига:
- •25.1.2 Химические свойства
- •25.2 Экспериментальная часть
- •25.2.1 Окисление ароматических углеводородов
- •25.2.2 Бромирование ароматических углеводородов
- •25. 2.3. Алкилирование бензола.
- •25.3 Отчет о работе
- •25.4. Контрольные вопросы
- •Лабораторная работа №26 Тема: спирты и фенолы
- •26.1Теоретическая часть
- •26.1.1 Методы получения спиртов
- •26.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •26.1.3 Методы получения фенолов
- •26.1.4 Химические свойства
- •26.2 Экспериментальная часть
- •26.2.1 Обнаружение воды в спирте и обезвоживание спирта
- •26.2.2 Свойства изоамилового спирта
- •26.2.3 Отношение спиртов к индикаторам
- •26.2.4 Окисление этилового спирта окисью меди
- •26.2.5 Растворение фенола в воде
- •26.2.6 Получение фенолята натрия
- •26.2.7 Получение трибромфенола
- •26.3. Отчет о работе
- •26.4. Контрольные вопросы
- •Лабораторная работа №27 Тема: альдегиды и кетоны
- •27.1 Теоретическая часть
- •27.1.1 Методы получения
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •27.1.2 Химические свойства альдегидов и кетонов
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •27.2 Экспериментальная часть
- •27.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •27.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •27.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •27.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •27.3. Отчет о работе
- •27.4. Контрольные вопросы
- •27.5. Индивидуальное задание лабораторная работа №28 Тема: карбоновые кислоты
- •28.1 Теоретическая часть
- •28.1.3 Химические свойства
- •28.2 Экспериментальная часть
- •28.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •28.2.2 Получение и свойства муравьиной кислоты
- •28.2.3 Получение и свойства уксусной кислоты
- •28.2.4.Реакции олеиновой и сорбиновой кислот с бромной водой
- •28.2.5.Окисление олеиновой кислоты перманганатом калия
- •28.3. Отчет о работе
- •28.4. Контрольные вопросы
- •28.5. Индивидуальное задание
- •29.2 Экспериментальная часть
- •29.2.1. Гидролиз мыла
- •29.2.2. Выделение высших жирных кислот из мыла
- •29.2.3. Образование нерастворимых солей высших жирных кислот
- •29.2.4. Взаимодействие растительного масла с водным раствором перманганата калия (реакция Вагнера)
- •29.2.5. Омыление жира спиртовым раствором гидроксида натрия
- •29.2.6. Определение кислотного числа, числа омыления и эфирного числа (выполняется в порядке нирс)
- •29.3.Отчет о работе
- •29.4.Вопросы для контроля знаний
- •29.5. Индивидуальное задание
- •30.1.2. Свойства и реакционная способность
- •30.1.3.Применение
- •30.3. Экспериментальная часть
- •30.4. Контрольные вопросы
- •30.5. Индивидуальное задание лабораторная работа №31 Тема:качественные реакции на функциональные группы
- •31.1. Теоретическая часть
- •Простые эфиры – легколетучие жидкости (низшие) с характерным запахом. Качественной реакцией на простые эфиры является реакция с иодистоводородной кислотой:
- •31.2.Экспериментальная часть
- •31.2.1. Содержание задания
- •31.2.2.Ход анализа органических соединений
- •1. Предварительные испытания
- •31.2.3.Проведение некоторых качественныхреакций
- •31.3.Типовые экспериментальные задачи
- •Лабораторная работа №32 Тема:идентификация полимерных материалов
- •32.1.Теоретическая часть
- •32.2.Экспериментальная часть
- •31.3.Отчет о работе
- •Содержание
- •Лукашов Сергей Викторович
22.3. Отчет о работе
Таблица 3 – Химические свойства алканов
|
№п/п |
Название опыта |
Условия проведения, наблюдения, уравнение реакции |
Выводы |
|
|
|
|
|
22.4. Контрольные вопросы
Почему алканы называют насыщенными углеводородами?
Чем обусловлено тетраэдрическое строение молекулы метана?
Почему для алканов не характерна геометрическая изомерия?
Как объяснить химическую неактивность в обычных условиях метана?
Почему в реакциях нитрования не применяется концентрированная азотная кислота?
Почему для получения фторпроизводных метана не применяются реакции прямого фторирования, аналогичные хлорированию?
Почему предельные углеводороды не обесцвечивают водных растворов перманганата калия и бромной воды? Можно ли на основе этого сказать, что алканы не окисляются?
Почему для получения ацетилена метан вводят в реакционную сферу кратковременно?
Чем объясняется факт отсутствия у алканов склонности к реакциям присоединения?
Как на основании физических и химических свойств доказать, что бутан и изобутан – изомеры?
Почему этан, несмотря на его большую, чем у воды молекулярную массу является газом, а вода – жидкостью?
Чем объясняется устойчивость смеси метана с хлором в темноте и бурная реакция на свету? Может ли в темноте существовать смесь метана с фтором?
Почему смесь паров йода и метана не взрывается даже на свету?
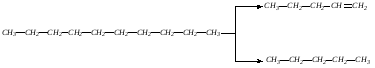
Предложите способ разделения смеси метана с пропаном. Какие свойства при этом учитываются?
Почему горение этана на воздухе не сопровождается выделением копоти, а горение ацетилена в этих же условиях копоть образует? Что такое копоть?
Почему реакция Вюрца со смесью углеводородов не всегда предпочтительна для получения какого-то конкретного углеводорода? Какая реакция предпочтительнее?
Для всех ли алканов существует структурная и оптическая изомерия? Ответ обоснуйте.
Почему реакцию с серной кислотой проводят при умеренном, а не сильном нагревании?
Почему для реакций сульфохлорирования необходим свет?
Почему в реакциях сульфохлорирования замещение труднее протекает у третичного атома углерода, чем у вторичного, а при хлорировании – наоборот?
Почему в реакции нитрования пропана получается большое количество побочных продуктов? Какими свойствами азотной кислоты это обусловлено?
Почему реакция йодирования алканов не протекает до конца?
Если алканы не имеют запаха, почему пахнет бытовой газ?
22.5. Индивидуальное задание
ЛАБОРАТОРНАЯ РАБОТА № 23
Тема: АЛКЕНЫ
Цель работы: изучить методы получения и химические свойства алкенов.
Задания: 1) усвоить основные теоретические понятия
2) провести опыты, представленные в экспериментальной части
3) оформить отчет о работе
4) выполнить индивидуальное задание
23.1 Теоретическая часть
23.1.1 Методы получения
1. При действии спиртовых растворов щелочей на галогенпроизводные отщепляется галогеноводород и образуется двойная связь:
СН3-СН2-CH2Br СН3-СН2=CH2
+ NaBr
+ H2O
СН3-СН2=CH2
+ NaBr
+ H2O
Если в
 -положениик
атому углерода, связанному с галогеном,
находятся третичный, вторичный и
первичный атомы водорода, то преимущественно
отщепляется третичный атом водорода,
в меньшей степени вторичный и тем более
первичный (правило Зайцева).
-положениик
атому углерода, связанному с галогеном,
находятся третичный, вторичный и
первичный атомы водорода, то преимущественно
отщепляется третичный атом водорода,
в меньшей степени вторичный и тем более
первичный (правило Зайцева).
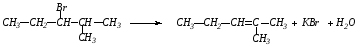
KOH (спирт)
2. Действием на спирты водоотнимающих средств:
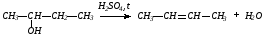
При действии Zn или Мg на дигалогенпроизводные с двумя атомами галогена у соседних атомов углерода:

4. Гидрированием ацетиленовых углеводородов над катализаторами:
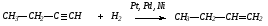
5. Алкены в виде сложных смесей получаются при крекинге нефти