
Рабочая тетрадь по химии для педиатрического факультета
.pdf
__________________________________________________________________
__________________________________________________________________
Демонстрационные интерактивные лабораторные работы использованию хроматографических методов в медико-
биологических исследованиях
Используя цифровой ресурс: «Единая коллекция цифровых образовательных ресурсов» - http://school-collection.edu.ru, необходимо войти в раздел «Химия» и выбрать все классы. Далее выбираем раздел «Инновационные учебные материалы» → ресурс «Биохимия» → «Интерактивные модели по биохимии».
Просмотрите работу «Очистка препарата интерферона
методом ионообменной хроматографии на катионообменнике»;
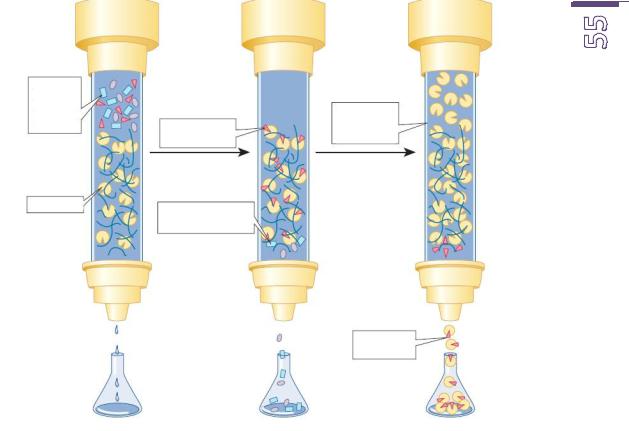
Просмотрев анимированную лабораторную работу, отметьте на схеме и опишите этапы ионообменной хроматографии:
1.
__________________________________________________________________
__________________________________________________________________

2.
__________________________________________________________________
__________________________________________________________________
3.
__________________________________________________________________
__________________________________________________________________
4.
__________________________________________________________________
__________________________________________________________________
Ответьте на следующие вопросы:
1.Какие физико-химические особенности лежат в основе ионообменной хроматографии?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
2.Что такое катионит и анионит?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
_________________________________________________________________
3.Почему интерферон осаждался на катионите? Почему раствор ацетата аммония в низкой и высокой концентрациях по-разному взаимодействовал с интерфероном и катионитом?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
_________________________________________________________________
3.Где ещё используется метод ионообменной хроматографии в медицине и биологии?
__________________________________________________________________
__________________________________________________________________

__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
_________________________________________________________________
Просмотрите работу «Проведение ветеринарной экспертизы
на наличие допинга (кофеина) в моче лошадей, участвующих в скачках, методом тонкослойной адсорбционной хроматографии»;
Просмотрев анимированную лабораторную работу, ответьте на следующие вопросы:
1. Какой принцип лежит в основе экспресс-метода тонкослойной хроматографии?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
_________________________________________________________________
2. Как используется тонкослойная хроматография в медикобиологических исследованиях?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
_________________________________________________________________
Просмотрите работу «Разделение белков сыворотки крови методом гель-проникающей хроматографии с целью частичной очистки иммуноглобулина G».
Просмотрев анимированную лабораторную работу, отметьте на схеме какие вещества и как распределяются в геле:

Ответьте на следующие вопросы:
1. Какие физико-химические принципы лежат в основе метода гель-проникающей (или молекулярно-ситовой) хроматографии?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
_________________________________________________________________
2. Чем метод молекулярно-ситовой хроматографии отличается от аффинной (биоспецифической) хроматографии?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
_________________________________________________________________
Для аффинной хроматографии отметьте на схеме какие вещества и как участвуют в данном методе разделения ВМС, и опишите основные этапы данного процесса:
Этапы аффинной хроматографии:
1.
__________________________________________________________________
_________________________________________________________________
2.
__________________________________________________________________
_________________________________________________________________
3.
__________________________________________________________________
__________________________________________________________________
3. Как используется молекулярно-ситовая хроматография в медико-биологических исследованиях?
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Дата выполнения л/работы _________
Оценка и подпись преподавателя: _____________

Лабораторная работа № 8. «Коллоидные растворы и их свойства и получение. Устойчивость и коагуляция золей»
Цель занятия: Научиться получать коллоидные растворы дисперсионным и конденсационным методами. Выявить необходимые условия для получения коллоидных систем. Научиться определять порог коагуляции и коагулирующую способность золей. Сопоставить результаты опытов с правилом валентности - значности (правило Шульца – Гарди), выявить особенности взаимной коагуляции золей и коллоидной защиты лиофильных золей.
Задачи:
1.Приготовить золи методами конденсации и диспергирования;
2.Определить знак заряда мицелл золя капилляризацией на
бумаге;
3.Определить порог коагуляции для золя гидроокиси железа;
4.Научится находить коагулирующий ион и рассчитывать его коагулирующую способность и порог коагуляции;
5.Выявить особенности взаимной коагуляции и коллоидной защиты растворами биополимеров.
Исходный уровень:
1.Растворы. Классификация растворов;
2.Теория электролитической диссоциации;
3.Гидролиз солей;
4.Механизм и термодинамика процесса растворения.
Реактивы и оборудование:
FeCl3, K4[Fe(CN)6], H2C2O4, CuSO4, FeО(OH), канифоль (спиртовой рас-р), метиленовая синь, фуксин основной, фуксин кислый, эозин, флуориесцин, KCl, K2SO4, K3[Fe(CN)6], мерные пробирки, колбы, фильтровальная бумага, спиртовки.
1. Получение коллоидных систем различными методами.
Опыт 1. Получение золя берлинской лазури методом диспергирования (пептизации).
Дисперсионные (диспергационные) методы - основаны на измельчении (диспергировании) грубых частиц и распределении их в объеме дисперсионной среды.
Метод пептизации – переход в коллоидный раствор осадков, образующихся при коагуляции. Пептизация может происходить в результате промывания осадка или под действием специальных

веществ – пептизаторов. Пептизация происходит за счет удаления из осадка коагулирующих ионов или в результате адсорбции пептизатора коллоидными частицами осадка.
Ход работы: В пробирку вносят 5 мл 2% раствора FeCl3 и приливают 1 мл насыщенного раствора К4[Fe(CN)6]. Протекает следующая реакция:
3К4[Fe(CN)6] +4FeCl3 (изб.) = KFe[Fe(CN)6]↓ + 12 KCl
Осадок фильтруют через бумажный фильтр. После полной фильтрации суспензии к осадку на фильтре добавляют раствор щавелевой кислоты (С = 0,05 моль/л), которая выступает пептизатором.
Наблюдают изменение цвета фильтрата от жёлто-зелёного до синего.
При оформлении работы составьте уравнение реакции получения берлинской лазури, уравнение диссоциации пептизатора - щавелевой кислоты (Н2С2О4), напишите формулу мицеллы золя берлинской лазури, укажите его окраску.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Опыт 2. Получение золя гексацианоферрата(II) меди методом конденсации (реакция двойного обмена).
Конденсационные методы основаны на образовании новой фазы в условиях пересыщенного состояния веществ; при этом система из гомогенной превращается в гетерогенную. При использовании данных методов происходит объединение молекул или ионов в истинных растворах с образованием более крупных мицелл золя.
Ход работы: В стакан отмеряют цилиндром 10 мл 0,1% раствора K4[Fe(CN)6] и добавляют пипеткой 1 мл 1% раствора CuSO4. Получают золь, окрашенный в коричнево-красный цвет.
При оформлении работы составить уравнение реакции получения гексацианоферрата(II) меди, указать окраску золя и составить формулу мицеллы:
а) при избытке CuSO4
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
б) при избытке K4[Fe(CN)6].

__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Опыт 3. Получение золя гидроксида железа (III) методом конденсации (реакция гидролиза).
Ход работы: В пробирку вносят 1 мл хлорида железа (III) – Fe(OH)3 и доводят объем в пробирке до 10 мл, далее раствор и кипятят на пламени спиртовки, пока раствор не приобретет красно-бурый цвет. Гидролиз хлорида железа (III) протекает по схеме:
FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl
Потенциалопределяющим ионом является катион FeO+, который образуется вследствие взаимодействия нерастворимого гидроксида железа (III) (Ks(Fe(OH)3) = 2,03∙10-8 г/100 мл) с хлороводородной кислотой:
Fe(OH)3 + 3HCl ↔ Fe(OH)2Cl + H2O ↔ FeOCl + 2H2O
При оформлении работы составьте формулу мицеллы золя, пользуясь уравнениями протекающих реакций гидролиза FeCl3,.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Опыт 4. Получение золя берлинской лазури.
Ход работы: К 5 мл 0,01 Н раствора гексацианоферрата (II) калия K4[Fe(CN)6], добавьте 2-3 капли 2 %-ного раствора хлорида железа (III). Протекает следующая реакция:
3К4[Fe(CN)6](изб.) +4FeCl3 = KFe[Fe(CN)6]) + 12 KCl
Выпадает ли осадок? Почему?
Напишите формулу мицеллы, укажите потенциалопределяющий ион, определите заряд гранулы мицеллы.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Опыт 5. Получение золя канифоли методом конденсации (метод замены растворителя).
Ход работы: В мерную пробирку отмеряют 10 мл дистиллированной воды и приливают 2-3 капли 1%-го спиртового

раствора канифоли и наблюдают образование опалесцирующего коллоидного раствора.
Дайте определение понятию опалесценция. Пронаблюдайте дихроизм. Дайте определение понятию дихроизм.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Опыт 6. Определение знака заряда частиц методом капилляризации.
На фильтровальную бумагу нанесите стеклянной палочкой (или капилляром) коллоидные растворы:
а) гексацианоферрата меди (II) из опыта № 2; б) берлинской лазури, полученной в опыте № 4;
в) гидроокиси железа (III), полученной в опыте № 5; Растворы индикаторов и красящих веществ:
г) метиленовая синь; д) фуксин основной; е) фуксин кислый; ж) эозин; з) флуориесцин.
После распределения капли на фильтровальной бумаге можно увидеть следующее:
Если золь заряжен положительно или обладает основными свойствами, то окрашивание проявляется в центре, а по краям появляется неокрашенная зона;
Если золь заряжен отрицательно или проявляет кислотные
свойства, то пятно окрашивается равномерно, и неокрашенного края нет.
Такое распределение связано с тем, что отрицательно заряженная по отношению к воде бумага адсорбирует положительные частицы и не адсорбирует отрицательные.
По характеру получившихся в опыте пятен распределите заряды их коллоидных частиц:
Золь |
Заряд |
Золь |
Заряд |
|
гранул |
|
гранул |
|
мицелл |
|
мицелл |
Берлинская лазурь |
|
Фуксин основной |
|
Гексацианоферрат меди (II) |
|
Фуксин кислый |
|
Гидроокись железа (III) |
|
Эозин |
|
Метиленовая синь |
|
Флуориесцин |
|

Коагуляция коллоидных растворов и защита от коагуляции Основные теоретические положения
Под устойчивостью коллоидных растворов понимают постоянство во времени таких свойств, как дисперсность, межмолекулярное взаимодействие, распределение частиц по объему дисперсной фазы. Различают кинетическую седиментационную устойчивость (КСУ) и агрегативную устойчивость (АУ).
КСУ характеризует способность дисперсной системы сохранять равномерное распределение частиц по всему объему дисперсной среды.
С повышением температуры она уменьшается вследствие понижения вязкости среды.
АУ – это устойчивость коллоидных растворов по отношению к
межмолекулярным силам притяжения. АУ препятствует слипанию
(агрегированию) коллоидных частиц. Агрегативная устойчивость обусловлена главным образом наличием вблизи поверхности гранул ионной атмосферы из гидратированных противоионов. При сближении коллоидных частиц одинаково заряженные ионные атмосферы перекрываются, и в области перекрывания возникают силы отталкивания, называемые расклинивающим давлением. К факторам агрегативной устойчивости относится также наличие заряда у самих коллоидных частиц – гранул. Нарушение любого из факторов устойчивости приводит к коагуляции коллоидных растворов – процессу объединения или агрегации частиц, при котором дисперсная фаза значительно снижает свою поверхностную энергию, становясь более устойчивой.
Коагуляцию могут вызвать разнообразные причины: действие тепла и холода, механические воздействия, действие излучений, прибавление избытка электролита.
При введении поэтапно в коллоидный раствор электролитов происходят следующие процессы:
а) конкурирующее воздействие ионов вводимого электролита по отношению к молекулам растворителя и противоионам диффузного слоя, приводящее к разрушению сольватных оболочек вокруг коллоидных частиц, сжатию диффузного слоя и уменьшению расклинивающего давления;
б) адсорбция ионов электролита, противоположных по знаку заряда коллоидных частиц, на поверхности гранул. Это приводит к снижению заряда коллоидной частицы (уменьшению ξ-потенциала) и дальнейшему уменьшению диффузного слоя;
в) при больших концентрациях электролита - коагулянта возможна ионообменная адсорбция, в результате которой противоионы адсорбционного слоя обмениваются на ионы добавленного
