
Рабочая тетрадь по химии для педиатрического факультета
.pdf
Лабораторная работа № 6 Потенциометрическое определение рН растворов с
использованием стеклянного электрода
Цель: используя высокоомный вольтметр «Иономер» или УЛК «Химия» определить потенциометрическим методом рН различных растворов.
Значение темы: протекание всех биохимических процессов в организме происходит в условиях гомеостаза, одной из характеристик которого является протолитическое равновесие. Современные инструментальные методы исследования позволяют с высокой точностью определить рН многих биожидкостей и использовать эти данные для диагностики различных состояний, наиболее опасным из которых является ацидоз.
Оборудование и реактивы:
Высокоомный вольтметр «Иономер» или учебно-лабораторный комплекс «Химия»; Пробирки, штатив, химические стаканы; биологическая жидкость – моча, с различными значениями рН.
Ход работы:
1.В три химических стакана отмерьте и внесите по 40 мл мочи под номерами 1, 2 и 3.
2.Подготовьте вольтметр «Иономер» или УЛК «Химия» к работе, см. правила
работы прибора.
3. Промойте дистиллированной водой электроды прибора и погрузите их в
стакан с первой пробой. Полученное значение ЭДС запишите в таблицу:
№ пробы |
V пробы, мл |
ЭДС, В |
рН среды |
Результат |
|
|
|
|
исследования |
1. |
|
|
|
|
2. |
|
|
|
|
3. |
|
|
|
|
Повторите измерение ЭДС для второй и третьей проб, при этом каждый раз промывая электроды дистиллированной водой.

Рассчитайте рН каждой пробы мочи по формуле (ЕХСЭ = 237 мВ
при 20 С (С(KCl) = 1 М); ЕХСЭ = 238 мВ при 25 С (С(KCl) = 1 М)):
рН = ЕХСЭ − ЭДС
2 ∙ 10−4 ∙ Т
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
4.Выключите прибор из сети, промойте электроды дистиллированной водой, опустите их в стаканчик с дистиллированной водой.
5.Внесите полученные результаты в таблицу 1 и отметьте в результатах исследования норму или патологию. Значение рН мочи в норме равно 5,8, но может колебаться в пределах от 4,8 до
7,5.
6.Дайте определение следующим понятиям и приведите причины возникновения:
Респираторный ацидоз:
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
Метаболический ацидоз:
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
Респираторный алкалоз:
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
Метаболический алкалоз:
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________

7.Запишите схему строения хлорсеребряного электрода (см. рис.) и опишите принцип его работы:
_____________________________________________________________
_____________________________________________________________
________________________
________________________
________________________
________________________
________________________
________________________
________________________
________________________
________________________
________________________
________________________
______________________
От чего зависит потенциал ХСЭ?
________________________
________________________
________________________
________________________
________________________
________________________
________________________
________________________
____________________________________________________
Запишите схему строения стеклянного электрода и опишите принцип его работы:
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
8.Представьте преподавателю отчет по лабораторной работе.
Дата выполнения л/работы _________
Оценка и подпись преподавателя: _____________

Лабораторная работа № 7 «Адсорбция уксусной кислоты активированным углем. Хроматография»
Цель: Построить изотерму адсорбции уксусной кислоты активированным углем, используя статический метод.
Задачи:
1.Установить начальную концентрацию растворов уксусной кислоты.
2.Провести адсорбцию уксусной кислоты углем статическим методом.
3.Установить количество адсорбированной кислоты.
4.Построить изотермы адсорбции Ленгмюра и Фрейндлиха.
Реактивы: растворы уксусной кислоты с различной молярной концентрацией
эквивалента (нормальностью): N1, N2, N3, N4; 0,1 Н р-р NаОН, активированный уголь.
Ход работы:
1.Для того чтобы установить начальную концентрацию растворов уксусной кислоты, отмерьте 5 мл 1-ого раствора уксусной кислоты (N1), добавьте 5 капель фенолфталеина и титруйте 0,1 Н раствором гидроксида натрия до появления слабо розовой окраски. Вычислите концентрацию раствора по формуле:
|
|
|
|
∙ |
|
= |
|
||
0 |
к−ты |
|
к−ты |
|
|
|
|
||
С0 (кис-ты N1):
__________________________________________________________________
__________________________________________________________________
С0 (кис-ты N2):
__________________________________________________________________
__________________________________________________________________
С0 (кис-ты N3):
__________________________________________________________________
__________________________________________________________________
С0 (кис-ты N4):
__________________________________________________________________
__________________________________________________________________
Установите начальную концентрацию 2, 3 и 4-ого растворов. Результаты занесите в таблицу.
2.В чистые пронумерованные стаканчики внесите по 0,5 г активированного угля. Отмерьте 10 мл 1-ого раствора уксусной

кислоты и прилейте в стаканчик № 1. Проделайте ту же операцию с другими растворами. Взболтайте суспензию и поставьте стоять на 20 минут для установления адсорбционного равновесия, перемешивайте суспензию каждые 5-10 минут.
3.Возьмите четыре пробирки (или колбы) вставьте в них воронки, вложив предварительно фильтр (фильтр вкладывать сухим). По истечении 20 минут, начните фильтрование проб.
4.Возьмите 5 мл первого фильтрата и перенесите его в колбу для титрования, добавьте 5-6 капель фенолфталеина и титруйте 0,1 Н раствором гидроксида натрия до появления слабо розовой окраски. Вычислите концентрацию кислоты в фильтрате (С) и изменение концентрации (∆С) по формулам:
к−ты = ∙ , ∆ = 0 −
к−ты
С (кис-ты N1):
__________________________________________________________________
__________________________________________________________________
С (кис-ты N2):
__________________________________________________________________
__________________________________________________________________
С (кис-ты N3):
__________________________________________________________________
__________________________________________________________________
С (кис-ты N4):
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Занесите результаты расчетов в таблицу:
№п/п |
С0 |
С |
∆С |
Г= |
х |
|
lgС0 |
lg |
х |
|
m |
m |
|
||||||||
|
|
|
|
|
|
|
|
|
||
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
5.Вычислите для каждой пробы адсорбцию по формуле, результаты вычислений занесите в таблицу:

Г = ∆ ∙ ,
где V – объем кислоты, взятой для опыта (см. ход работы п. 2), m – масса активированного угля. В уравнении Лэнгмюра адсорбцию
принято обозначать – Г, в уравнении Фрейндлиха: mх .
В условиях нашего опыта эти величины одинаковы (Г = mх ).
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
На миллиметровой бумаге постройте график зависимости адсорбции (Г) от начальной концентрации кислоты (С0) – изотерма адсорбции Ленгмюра.
6. Вычислите для каждой пробы lg mх и lgС0.

__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
7.На миллиметровой бумаге постройте график зависимости логарифма адсорбции (lg mх ) от логарифма начальной концентрации кислоты (lgС0) – изотерма адсорбции Фрейндлиха.
Для этого после нанесения экспериментально полученных точек проведите прямую линию, соединяющую наибольшее число точек. По графику вычислите константы: Кф и 1/n.
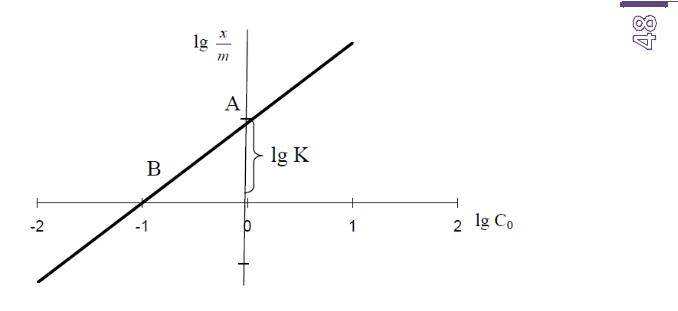
Отрезок АО, отсекаемый прямой по оси ординат, равен lgK. Вычислив antilg найдите значение К. Численно константа Фрейндлиха равна количеству вещества, адсорбированного 1 граммом адсорбента при равновесной концентрации, равной единице. Величина этой константы меняется в широких пределах (примерно от 2 до 25). Величина константы 1/n равна тангенсу угла, образованного прямой с положительным направлением оси абсцисс. Её можно рассчитать:
1/n = АО / ВО.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Величина константы 1/n колеблется в пределах 0,2 – 0,7.
8.Сделайте вывод.
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
________________________________________________________________
Количественное определение ионов натрия в растворе методом ионообменной хроматографии
Цель: Рассмотреть особенности различных хроматографических методов исследования веществ, необходимых в лабораторноклинической практике.

Основные характеристики ионообменной хроматографии:
Ионообменная хроматография (ИОХ) является одним из вариантов жидкостно-жидкостной хроматографии, механизмом разделения, в
котором является химическая реакция ионного обмена. Неподвижной фазой (НФ) в ИОХ является жидкость в порах или капиллярных каналах набухшего специфического сорбента, называемого ионообменником или ионитом
Ионит – это сорбент, состоящий из высокомолекулярной основы с пространственной решетчатой структурой и закрепленными на ней ионогенными функциональными группами. При контакте с водой или растворами происходит набухание структуры, а функциональные группы обмениваются своими подвижными ионами с ионами раствора. Ионный обмен является химической реакцией, протекающей в гетерогенной системе: твердый (набухший) ионит – раствор. Поэтому механизм сорбции на ионитах называют хемосорбцией.
Реактивы и оборудование:
1.Хроматографическая колонка с катионитом КУ-2-8.
2.Колбы мерные вместимостью 250, 100 мл.
3.Бюретка для титрования.
4.Дистиллированная вода.
5.HCl, раствор с концентрацией 1 Н
6.Раствор метилового оранжевого.
7.Раствор нитрата натрия NaNO3.
8.Раствор NaOH с концентрацией 0,1 Н.
Ход работы:
1.В хроматографическую колонку, заполненную катионитом, наливают дистиллированную воду до метки и открывают кран. Устанавливают скорость протекания воды (60-80 капель/мин), постоянно поддерживая уровень жидкости в колонке.
2.Пропускают через колонку 10 мл 1 Н соляной кислоты.
3.Промывают колонку дистиллированной водой, до исчезновения реакции на ионы Н+ с метиловым оранжевым.
4.После этого пропускают через колонку 10 мл исследуемого раствора нитрата натрия, отбирая фильтрат в колбу.
5.Промывают катионит дистиллированной водой, собирая фильтрат в ту же колбу и доводят объем полученного раствора до 100 мл.
6.Проводят титрование полученного фильтрата раствором гидроксида натрия с концентрацией о,1 Н и индикатором

метиловым оранжевым. Точка эквивалентности определяется при переходе окраски из розовой в желто-оранжевую.
7. Расчет количества нитрата натрия производят по формуле:
3 = ∙ ∙ Э 3
1000
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Хроматография на бумаге. Разделение ионов Cu2+ и Fe3+
1.В два химических стакана наливают раствор, содержащий ионы Cu2+ и Fe3+ (первый стакан) и дистиллированную воду (второй стакан). Высота раствора в каждом стакане не должна превышать 1 см.
2.Для хроматографического разделения ионов, которые находятся в анализируемом растворе, используют хроматографическую бумагу. Для этого полоску бумаги опускают в исследуемый раствор (1 стакан) на глубину в 1 см (следите, что бы бумага не касалась стенок стакана).
3.Далее полоску хроматографической бумаги переносят в стакан с дистиллированной водой и оставляют до тех пор, пока вода, с разделяемыми ионами не поднимется на ⅔ высоты полоски. Раствор должен подниматься самопроизвольно, под действием капиллярных сил.
4.После этого полоску вынимают и смачивают раствором гексацианоферрата(II) калия, для проявления пятен разделяемых ионов. Обозначаются две зоны (пятна) окрашенные в разные цвета.
5.В отчете должны быть:
Схема бумажной хроматографии;
Уравнения реакций, между ионами Cu2+ и Fe3+ и проявителем;
Вывод, о подвижности и скорости разделения ионов.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Схема хроматограммы после проявления ионов Fe3+ и Сu2+
