
Донецкий национальный университет
ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
ОТЧЕТ
о прохождении вычислительной практики
Выполнил:
Студент 1 курса
Группы 1-А
Юрченко Роман Олегович
Руководитель практики:
Доцент кафедры физической
Химии ДонНУ
К.Х.Н., доцент Туровский Н.А.
Донецк
2015
Содержание
ТЕКСТОВЫЙ ПРОЦЕССОР MS Office World
ТАБЛИЧНЫЙ ПРОЦЕССОР MICROSOFT EXCEL
РЕДАКТОР ПРЕЗЕНТАЦИЙ MICROSOFT POWERPOINT
РЕДАКТОР ХИМИЧЕСКИХ ФОРМУЛ CHEMSKETCH
РЕДАКТОР ХИМИЧЕСКИХ ФОРМУЛ HYPERCHEM
Введение
Я, студент химического факультета группы 1А, Юрченко Роман Олегович, прошёл вычислительную практику ДонНУ с 08.06.2015 до 27.06.2015 в 408 аудитории под руководством Туровского Н.А. Главной целью вычислительной практики являются: подготовка студентов к использованию информационных технологий в практической деятельности; совершенствование теоретического материала и практических навыков дисциплин предметного блока; получение студентами навыков работы в операционной системе Windows и ее стандартных программах; Microsoft Word, Exel, PowerPoint, графическим редактором химических формул ChemSketch, HyperChem. Практические навыки студентов с работой программ получались путем выполнения индивидуальных заданий
Текстовый процессор microsoft word
В современном мире существует уже много версий MS Word, наиболее популярными среди них считаются версии 2003, 2007, 2010 и 2013 года выпуска. Современный текстовый процессор Microsoft Word предназначен для просмотра, создания, печати и модификации текстовых документов. Он предусматривает выполнение многих операций, как над текстовой, так и над графической или табличной информацией. Благодаря MS Word стало возможно быстро, а также с высоким качеством подготовить любой документ, причем от сложного до простого.
Word 2010 дает возможность осуществлять все традиционные операции над текстом (без исключений), которые предусмотрены в компьютерной современной технологии. С его помощью можно:
модифицировать набор неформатированной цифровой и алфавитной информации;
форматировать символы, применяя множество шрифтов разных размеров и начертаний;
форматировать страницы (сюда также входят сноски, колонтитулы);
форматировать документ в целом (составлять оглавление, причем автоматическое, а также разные указатели);
подбирать синонимы, проверять правописание, использовать автоматический перенос слов.
В этой программе реализованы возможности новых технологий связывания, внедрения объектов, благодаря которым можно в документ включать таблицы, текстовые фрагменты и иллюстрации.
Это одна из первых общедоступных программ, с помощью которой можно выполнять операции верстки, которые порой необходимы издательским профессиональным системам, а также с ее помощью можно подготавливать полноценные оригинал-макеты для их последующего тиражирования в типографии.
Данная программа является уникальной коллекцией технологических оригинальных решений, благодаря которым нудная и кропотливая работа по отделке и редактированию текста превращается в увлекательное, а порой и успокаивающее занятие. В число таких решений входит система готовых стилей оформления и решений, изящные приемы по модификации и созданию таблиц, функции автозамены и автотекста, а также копирование формата, макроязык, пользовательские панели инструментов и многое другое.

Рабочее окно
Задание 1.
Пат. 76915 UA,МПК А61К 31/198 (2006.01) А61Р 11/06 (2006.01). Спосіб лікування хворих на тяжку персистувальну бронхіальну астму із застосуванням ацетил цистеїну [Текст] / Фещенко Ю.І., Яшина Л.О., Ігнатьєва В.І., Ільїнська І.Ф., Матвієнко Ю.О., Москаленко С.М., Сідун Г.В. ; заявник Інститут фтизіатрії і пульмонології ім..Ф.Г. Яновського Академії медичних наук України.-№ а200503501 ; заявл. 14.04.2005 ; опубл. 15.09.2006, Бюл. № 9.
Theoretical Study of the Microsolvation of the Bromide Anion in Water, Methanol, and Acetonitrile : Ion-Solvent vs Solvent-Solvent [Текст] / R. Ayala, J.M. Martinez, R.R. Pappalardo [et al.] // J. Phys.Chem. A. -2000.-Vol. 104, Iss.12.-P.2799-2807.
ХІМІЧНІ РЕКОРДИ:
Найрасповсюдженіший елемент літосфери Землі – Оксиген (46,60 % по масі);
Найдорожчий елемент – Каліфорній (10 дол. За 0,001 мг);
Найбільша кількість ізотопів у Xe і Cs (по 36);
Найвища температура полум’я – при згорянні динітрилу тетравуглецю – 5261 К;
Найбільший атом – атом Цезію (№ 55 у Періодичній системі,радіус 2,72 Å);
Температура плавлення сплаву з 20 % HfC та 80 % TaC складає 4400 °С;
Найважчий із газоподібних речовин – радон (10,05 г/л при 0 °С).
@ $ % & * № » ? ~ “ > } € § ≠ ± ¾ √ ↔ ∂ ‰ ƴ
Задание 2.
Каталитические
системы на основе меди с
трет-бутилгидропероксидом были
использованы для одностадийного
окисления 2,3,6-триметилфенола (ТМФ) до
триметил-1, 4-бензохинона с высоким
выходом. Гомогенные процессы с
участием катализируют
окисление с 80% выходом в
катализируют
окисление с 80% выходом в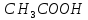 .
Твёрдый катализатор, Сu-MCM-41,
впоследствии изучали для получения
продуктов с выходом 88%. Он подвергается
вторичной переработке без потери
активности, не выщелачивается.
.
Твёрдый катализатор, Сu-MCM-41,
впоследствии изучали для получения
продуктов с выходом 88%. Он подвергается
вторичной переработке без потери
активности, не выщелачивается.
В соответствии с количеством и местом присоединения метильных групп различают α-токоферол, β-токоферол, γ-токоферол, δ-токоферол,
Задание 3.
Исследование реакций распада R(OH)OOH и R(OH)OOR(OH) в присутствии Et₄N⁺Br⁻ в условиях псевдопервого порядка по пероксидному соединению показало,что зависимость эффективной константы скорости реакции (kₑf,c⁻¹) от концентрации аммониевой соли имеет нелинейный характер.Экспериментальные факты указывают на наличие стадии комплексообразования между реактантами.Определены термодинамические параметры комплексообразования для R(OH)OOH и R(OH)OOR(OH),которые соответственно равны ∆rHcom=-20±1 кДж/моль, ∆rScom=-30±4 кДж/(моль*К)
Степень ионизоции (α, %), о зночит, и ростворимость лекорств во многом зовисит от рН среды. Это ноблюдоли, нопример, когдо исследоволи свойство сильного ядо стрихнино. В эксперименте лобороторным животным вливоли в желудок по 5 мг этого вещество в состове ростворов с розным уровнем рН. При рН 8,0 степень диссоциоции молекул стрихнино состовляло 54 %, и животные погиболи через 24 мин, если роствор имел рН 5,0 (α = 0,1 %), они жили дво с половиной чосо, о в очень кислом ростворе с рН 3,0 стрихнин почти не диссоциировол (α = 0,001 %), и подопытные остоволись живы.
Задание 4.
The present thesis deals with catalytic decomposition of the hydroperoxides in the presence of the tetraalkylammonium bromides. Aralkyl hydroperoxides (dimethylbenzylmethyl Ph-CH2-C(CH3)2-OOH, 1, 1-dimethyl-3-phenylpropyl Ph-(CH2)2-C(CH3)2-OOH, 1,1-dimethyl-3-phenylbutyl Ph-CH(CH3)-CH2-C(CH3)2-OOH, 1,1,3-trimethyl-3-(p-methylphenyl)butyl (p-CH3-Ph-C(CH3)2-CH2- C(CH3)2-OOH), p-carboxy-i-propylbenzene p-HOC(O)-Ph- C(CH3)2-OOH) and l-hydroxycyclohexyl hydroperoxide (C6H10(OH)OOH) have been considered.Alk4NBr have shown to be the catalyst in the reaction of aralkyl hydroperoxides and l-hydroxycyclohexyl hydroperoxide decomposition in acetonitril. Activation energies of the hydroperoxides thermolysis and catalytic decomposition have shown to be change simbiatically.
Chemically activated hydroperoxides decomposition in the presence of Alk4NBr has been shown on the base of kinetic and NMR-spectroscopy data to be proceed through the complexation stage. Decomposition of the complex-bonded hydroperoxides proceeds with lower activation barrier as compared with reaction of their thermal decomposition. Rate of the hydriperoxide – Et4NBr complex decomposition increases in the following hydroperoxide row: Ph-CH2- C(CH3)2-OOH < Ph-(CH2)2-C(CH3)2-OOH< Ph- CH(CH3)-CH2-C(CH3)2-OOH< p-CH3-Ph-C(CH3)2-CH2- C(CH3)2-OOH< p-HOC(O)-Ph- C(CH3)2-OOH<< C6H10(OH)OOH. Values of enthalpy and entropy of the complex formation have been determined.
The tetraalkylammonium cation structure effect upon the catalytic reactivity of the tetraalkylammonium bromides has been shown on the base of obtained kinetic parameters of the reaction. The rate constant values of complex-bonded peroxide decomposition obtained for the investigated salts increase in the following cation order:
Hex4N+<Bu4N+<Pr4N+<Et4N+.
1-hydroxycyclohexyl hydroperoxide in the presence of tetraethylammonium bromide has shown to be the effective low-temperature (308-340 K) initiator for the radical chain processes. The potential energy surface of the peroxide bond hemolytic decomposition has been obtained. The linear correlation for the experimental activation parameters and calculated activation enthalpies has been observed. Quantum-chemical modeling of the peroxide bond hemolysis in the framework of semi empirical AM1/CI method allows estimating the experimental activation parameters of the hydroperoxide decomposition.
Задание 5.
Theory
General view to determine the binding constants
Comprehensive and interpretation of basic equations for host-guest complexation
The binding constant is used as a criterion for the evaluation of the host-guest complexation process. Thermodynamic parameters (enthalpy, entropy) and Gibbs free energy are more suitable criteria. In the case where Equations and hold good, thermodynamic parameters are related to each other as described in Figure 3 and Equation, the Vant’s Hoff equation. Theoretically, the determination of binding constants at different temperatures offers these thermodynamic parameters from the slope and intercept of the line in Figure 3. The important point in the quantitative analysis of host-guest complexation is how to determine the binding constant with high reliability.
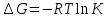
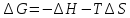
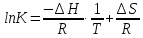
Our analysis to determine the binding constant is based on a simple binding equilibrium model. The binding constant, equilibrium constant, and stability constant are synonymous with each other. The activity coefficients are generally unknown and the stability constant K, based on the concentrations, is usually employed. Judging from this situation, the question of the activity coefficients if the solutes is disregarded here in order to simplify the discussion, Nevertheless, is should be remembered that this point is not always insignificant. The basic equations for host-guest complexation are the following four Equations.
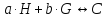
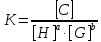

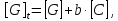
Where H is host; G, guest; C, complex; Ha ∙ Gb; a, b, stoichiometry: shown in Equation; [H]t, total concentration of host molecule at initial state; [G]t, total concentration of guest molecular at initial stage; [H], [G], [C], concentration of host, guest, and complex respectively at final stage, namely, at equilibrium.
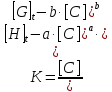
Parameters are classified into three as follows. Constants: K, a, b (a and b are integers larger than or equal to 1). Variables which can be set up as experimental condition: [H]t, [G]t. Variables dependent on each equilibrium: [H], [G], [C].
Experimental guideline from the theory
From Equation and the classification of its parameters is elucidated the guideline of the experiment. When [C] is obtained under equilibrium in which a and b are known, K is derived directly according to Equation from the experimental condition [H]t, and [G]t. Consequently, in order to determine the binding constants, the following four tasks have to be carried out.
Determination of stoichiometry, namely, a and b
Evaluation of [C]
Setting up the concentration conditions [H]t and [G]t
Data-treatment
The following sections deal with the principle and also the practical issues necessary for an understanding and completion of the above four tasks in this order.
Experiment (practical measurement)
Determination of stoichiometry
Continuous variation methods
There are different methods of determining the stoichiometry, e.g., Continuous Variation Methods, Slope Ratio Method, Mole Ratio Method, etc. Because the Continuous Variation Method is the most popular among these, this method is adopted here to determine the stoichiometry.
In order to determine the stoichiometry by the Continuous Variation Method, the following four points have to be considered and carried out.
Keeping the sum of [H]t and [G]t constant (α)
Changing [H]t from 0 to α
Measuring [C]
Data treatment (Job’s plot)
The stoichiometry (a/(a+b)) is obtained from the x-coordinate at the maximum in Job’s curve, where the y-axis is [C] and the x-axis is.
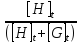
For the comprehensive of the theoretical background of the Continuous Method, the required Equation are (4)-(7) and (9)-(11).
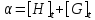
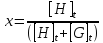
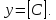
[H]t and [G]t will be substituted by the function of x and α from Equations (9) and (10).

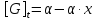
Задание 6.
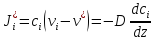
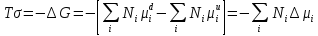
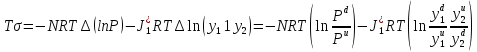
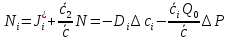
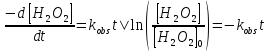
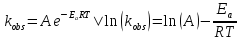
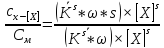
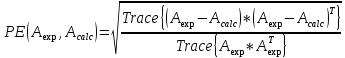
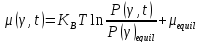
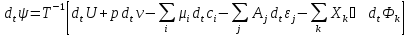
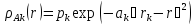
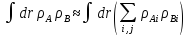
ТАБЛИЧНЫЙ ПРОЦЕССОР MICROSOFT EXCEL
Внешний вид рабочего окна
Microsoft Excel (также иногда называется Microsoft Office Excel[1]) — программа для работы с электронными таблицами, созданная корпорацией Microsoft для Microsoft Windows, Windows NT и Mac OS. Она предоставляет возможности экономико-статистических расчетов, графические инструменты и, за исключением Excel 2008 под Mac OS X, язык макропрограммирования VBA (Visual Basic for Application). Microsoft Excel входит в состав Microsoft Office и на сегодняшний день Excel является одним из наиболее популярных приложений в мире.
Особенность электронных таблиц заключается в возможности применения формул для описания связи между значениями различных ячеек. Расчёт по заданным формулам выполняется автоматически. Изменение содержимого какой-либо ячейки приводит к пересчёту значений всех ячеек, которые с ней связаны формульными отношениями и, тем самым, к обновлению всей таблицы в соответствии с изменившимися данными.
Основные возможности электронных таблиц:
1. Проведение однотипных сложных расчётов над большими наборами данных;
2. Автоматизация итоговых вычислений;
3. Решение задач путём подбора значений параметров;
4. Обработка (статистический анализ) результатов экспериментов;
5. Проведение поиска оптимальных значений параметров (решение оптимизационных задач);
6. Подготовка табличных документов;
7. Построение диаграмм (в том числе и сводных) по имеющимся данным;
8. Создание и анализ баз данных (списков).
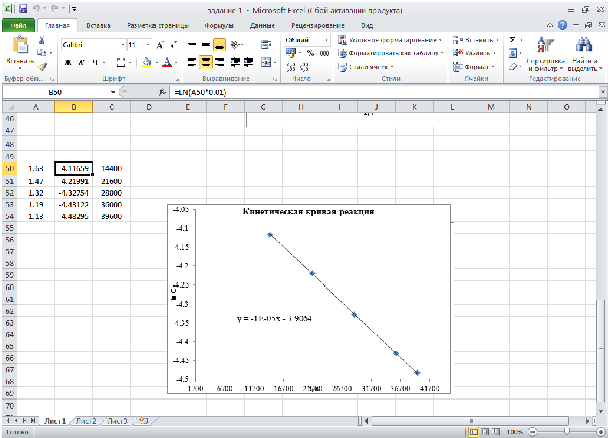
Примеры вычислений и визуализации данных Microsoft Excel
Расчёт параметров уравнение Аррениуса
Задание 1.
Для
реакции термического распада дифторэтана
с образованием фторэтилена и выделением
HF,
при различных температурах определены
значения константы скорости этой
реакции. Исходя из уравнения Аррениуса
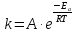 найти значенияln
A
и Еа.
найти значенияln
A
и Еа.
