
22
Всвязи с биологической функцией полисахариды делятся на резервные
иструктурные. Большинство резервных полисахаридов (крахмал, гликоген, инулин) являются важнейшими компонентами пищевых продуктов, выполняя в организме человека функцию источника углерода и энергии. Структурные полисахариды (целлюлоза, гемицеллюлоза) в клеточных стенках растений образуют протяжные цепи, которые в свою очередь, укладываются в прочные волокна или пластины и служат своего рода каркасом в живом организме.
4.1Гомополисахариды
Крахмал Крахмал – главный резервный полисахарид растений, запасается во
многих семенах, клубнях, корневищах и используется только тогда, когда эти органы прорастают. В клубнях картофеля его содержится около 20%, кукурузе – 55-60%, ржи – около 70%.
Крахмал является одним из важнейших продуктов фотосинтеза, образующийся в зеленых листьях растений в виде так называемых первичных зерен. Затем он расщепляется на моносахариды или их фосфорнокислые эфиры и переносится в другие части растений, например, клубни картофеля или зерна злаков. Здесь вновь происходит отложение крахмала в виде зерен, форма и размер которых характерны для данного вида растений.
Крахмал подобно белкам обладает гидрофильными свойствами, однако в холодной воде крахмальные зерна лишь набухают, но не растворяются. Если взвесь крахмальных зерен в воде постепенно нагревать, то они будут набухать все сильнее и при определенной температуре крахмал образует вязкий коллоидный раствор, называемый крахмальный клейстер.
Температура клейстеризации крахмала для разных растений неодинакова и находится в пределах 55-75°С.
Характерным свойством крахмала является его способность окрашиваться йодом в темно-синий цвет.
Крахмал не является химически индивидуальным веществом. На 9698% он состоит из полисахаридов. В нем найдены в небольшом количестве белки, высокомолекулярные жирные кислоты, минеральные кислоты (фосфорная и кремниевая), которые адсорбированы на крахмальных зернах.
Полисахаридная фракция крахмала состоит из двух компонентов: амилозы и амилопектина.
Амилоза легко растворима в теплой воде и дает нестойкие растворы со сравнительно низкой вязкостью. Длительное хранение раствора амилозы на холоде приводит к выпадению ее в осадок. Этот процесс носит название ретроградации амилозы. Этим, отчасти, можно объяснить процесс черствения хлеба при его хранении.

23
Молекула амилозы имеет линейную структуру, представляет собой длинную цепочку из остатков α-D-глюкопиранозы, соединенных α(1→4)- гликозидными связями:
|
он |
|
сн2 |
он |
|
сн2 |
он |
|
сн2 |
он |
сн2 |
|
|
|
|
|
|
||||
о н |
|
|
|
|
|
|
||||
н н |
|
н н |
о н |
|
н н |
о н |
н |
н |
о |
|
1 |
|
|
|
|
н, он |
|||||
он |
|
он |
|
|
он |
|
|
он |
||
|
о |
|
|
|
|
|
||||
н |
он |
н |
он |
о |
н |
он |
о |
н |
он |
|
|
|
n |
Дисахаридный фрагмент амилозы - мальтоза
АМИЛОЗА
Количество остатков глюкозы в каждой цепи колеблется от 100 до нескольких тысяч. По данным рентгеноструктурного анализа пространственная конформация цепной макромолекулы амилозы имеет форму спирали.
Конформация макромолекулы амилозы
Такая форма обусловлена тем, что остатки α-Д-глюкозы в составе амилозы имеют конформацию лодки, которая способствует спирализации полигликозидной цепи.. На каждый виток спирали приходится 6 остатков глюкопиранозы. Во внутренний канал спирали могут входить соответствующие по размеру молекулы, например, молекулы йода образуют комплексы, называемые соединениями включения, комплекс амилозы с йодом имеет синий цвет. Это используется в аналитических целях для открытия как крахмала, так и йода.
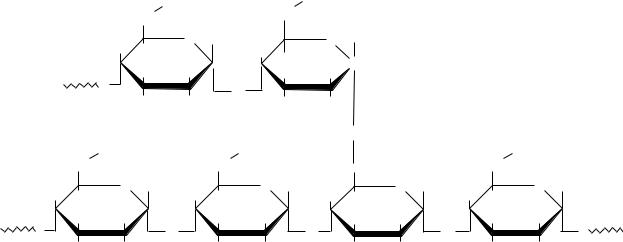
Амилопектин в отличие от амилозы имеет сильно разветвленную структуру. В его молекулу входит до 50.000 α-D-глюкопиранозных остатков. Наряду с α(1→4) связями в амилопектине имеются также α-(1→6) гликозидные связи, представляющие собой точки ветвления. Между точками ветвления располагается 20-25 глюкопиранозных остатков. Гликозидные α–(1→6) связи составляют около 5% от общего количества связей, содержащихся в молекуле амилопектина.
Методом рентгеноструктурного анализа показано, что структура амилопектина напоминает гроздь винограда.
|
|
|
|
|
|
|
24 |
|
|
|
|
|
|
|
|
|
он |
|
|
он |
|
|
|
|
|
|
|
|
сн2 |
|
|
сн2 |
|
|
|
|
|
|
|
|
|
|
н |
|
|
н |
|
|
|
||
|
|
н |
н |
о |
н |
н |
о |
|
|
|
||
|
|
|
1 |
|
1 |
|
|
|
||||
|
|
|
он |
|
|
|
|
|
|
|||
|
|
о |
|
|
он |
н |
|
|
|
|||
|
|
н |
он |
о |
|
н |
он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
он |
|
|
он |
|
|
|
6 |
|
|
он |
|
сн2 |
о |
н |
|
сн2 |
о н |
|
сн2 |
о н |
сн2 |
о н |
|
|
н н |
н |
н |
н |
н |
н н |
||||||
|
|
|
|
|
|
|
||||||
о |
он |
|
|
о |
он |
|
о |
|
он |
о |
он |
о |
|
|
|
|
|
|
|
|
|||||
|
н |
он |
|
|
н |
он |
|
|
н |
он |
н |
он |
Фрагмент молекулы амилопектина
Амилопектин с йодом дает красно-фиолетовое окрашивание.
Как в амилозе, так и в амилопектине, имеется только один восстанавливающий конец, при том его доля невелика, поэтому крахмал относят к нередуцирующим полисахаридам.
В крахмале большинства растений на долю амилопектина приходится 70-90%, остальные 10-30% составляет амилоза. Однако содержание этих компонентов может изменяться в зависимости от сорта растения, типа ткани, из которой он извлечен. Соотношение амилоза / амилопектин изменяется также во время созревания зерна. Крахмал некоторых культур может быть представлен только одним видом полисахарида, так, у яблок это амилоза, у восковидной кукурузы только амилопектин.
Гликоген Гликоген – животный крахмал. Он содержится практически во всех
органах и тканях животных и человека, наибольшее количество его обнаружено в печени и мышцах. Гликоген встречается и в растениях. Так, в кукурузе помимо обычного крахмала находится фитогликоген. Встречается гликоген в грибах и дрожжах. Контроль дрожжей на присутствие гликогена является важным показателем в бродильной технологии, по которому судят о физиологической активности дрожжей. По строению гликоген близок к амилопектину, характеризуется более разветвленной структурой, чем амилопектин. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-(1→4)-гликозидными связями, а в точках
ветвления имеются α-(1→6) гликозидные связи. Линейные отрезки в молекуле гликогена включают 11-18 остатков, а точки ветвления у него встречаются через каждые 8-10 остатков.
Под действием йода гликоген окрашивается в красно-коричневый цвет.
Ферментативный гидролиз крахмала и гликогена
Ферментативный гидролиз крахмала и гликогена осуществляется с помощью ферментов класса гидролаз, подкласса карбогидраз, называемых ами-
25
лазами: α-амилазы, β-амилазы и глюкоамилазы. Различаются они по свойствам, распространению в природе и способу действия на крахмал. Наиболее активные амилазы содержатся в слюне и соке поджелудочной железы животных и человека, в плесневых грибах, проросшем зерне. Обычно препараты амилазы получают из высушенного проросшего зерна (солод).
Амилазы гидролизуют как неизмененные крахмальные зерна, так и крахмальный клейстер. Атакуемость крахмала амилазами увеличивается с уменьшением размеров крахмальных зерен, т.е. с увеличением их относительной поверхности. Она резко возрастает при механическом нарушении стуктуры крахмальных зерен. Действие амилаз усиливается на клейстеризованный крахмал. Поэтому в целом ряде отраслей пищевой промышленности, например, спиртовой, осахаривание крахмала солодом производится лишь после заваривания муки или измельченного картофеля.
α-амилаза – фермент, гидролизующий α-(1→4)-гликозидные связи внутри молекулы амилозы или амилопектина без определенного порядка. В результате образуются продукты неполного гидролиза крахмала – α-декстри- ны – полисахариды разной молекулярной массы.
В соотвествии со свойствами различают следующие виды декстринов:
1.амилодекстрины – окрашиваются раствором йода в фиолетово-си- ний цвет;
2.эритродекстрины, окрашиваются йодом в красно-бурый цвет;
3.ахродекстрины – окрашиваются йодом в слабо-желтый цвет;
4.мальтодекстрины – не дают окрашивания с йодом.
α-амилазу называют декстринирующим ферментом. Она не расщепляет α-(1→6) гликозидные связи.
При действием α-амилазы на амилозу можно получить при полном гидролизе около 85% мальтозы и 15% глюкозы, при действии на амилопектин – около 70% мальтозы, 10% изомальтозы (молекулы глюкозы связаны α- (1→6) гликозидной связью) и 20% глюкозы.
Схематически действие α-амилазы на крахмал можно представить: а)амилоза:
|
α -амилаза |
|
|
α -амилаза |
|
|
O |
O |
O |
O |
O |
O |
НОН |
|
|
|
|
|
|
|
о |
о |
о |
о |
о |
|
о |
НОН декстрины |
НОН мальтоза + глюкоза |
|
|
|
|
|
б) амилопектин
26
|
|
мальтоза |
НОН |
НОН |
+ |
|
|
глюкоза |
|
|
+ |
|
|
изомальтоза |
декстрины
β-амилаза – фермент, который катализирует гидролиз крахмала и гликогена по α(1→4) гликозидной связи с нередуцирующих концов молекул.
Она не расщепляет α(1→6) связи. В отличие от α-амилазы, β-амилаза действует упорядоченно и, начиная с нередуцирующего конца, отщепляет по молекуле мальтозы.
Амилозу β-амилаза расщепляет нацело, превращая ее на 100% в мальтозу.
Если субстратом для действия β-амилазы служит амилопектин, то она расщепляет его на мальтозу и продукт неполного гидролиза, получивший название β-амилодекстрин, на оставшихся ответвлениях которого находятся α(1→6) гликозидные связи. Предельный декстрин гидролизуется β-амилазой только в том случае, если в реакционную смесь добавить α-амилазу. При совместном действии α- и β-амилаз на крахмал около 95% его превращается в мальтозу. Схема гидролиза крахмала под действием β-амилазы выглядит следующим образом:
|
|
|
|
β -амилаза |
|
|
β -амилаза |
|
β -амилаза |
|
H |
O |
|
O |
|
O |
|
O |
O |
O |
НОН |
|
|
|
|
|
|
|
|
|
||
OH |
|
о |
|
о |
|
о |
о |
о |
о |
|
|
|
|
|
Амилоза |
|
|
|
|
|
|
|
н |
сн2он |
о н |
н |
сн2он |
о |
он |
|
|
|
|
н |
н |
|
|
|
|||||
|
он он |
н |
о |
он |
н |
н |
|
|
|
|
|
|
н |
он |
|
н |
он |
|
|
|
|

27
НОН мальтоза +
нередуцирующий |
редуцирующий |
β -амилодекстрин |
|
конец |
|
||
конец |
|
|
|
|
амилопектин |
|
|
α- и β-амилазы различаются по своему отношению к реакции среды: α- амилаза гораздо более чувствительна к подкислению. Отличаются эти ферменты также по термостабильности и температурному оптимуму: α-амилаза более устойчива к действию повышенных температур, ее температурный оптимум ( 70°С) лежит несколько выше, чем оптимум β-амилазы (50 60°С).
Амилазы имеют большое значение в хлебопекарной, пивоваренной, спиртовой промышленности. Брожение теста и накопление в нем СО2, разрыхляющего его и придающего хлебу равномерную пористость и хороший объем, зависят от присутствия в тесте сбраживаемых дрожжами сахаров. В свою очередь, содержание сахара в тесте зависит не только от количества сахара, находящегося в муке, но также от скорости накопления мальтозы при действии амилазы на крахмал. С другой стороны, слишком энергичное действие α-амилазы, имеющейся в большом количестве в муке из проросшего пшеничного или ржаного зерна, вызывает избыточное накопление в тесте декстринов, придающих мякишу хлеба плохую эластичность, заминаемость, недостаточную пористость и неприятный вкус.
Поскольку α-амилаза весьма чувствительна к повышению кислотности и резко понижает при этом свою активность, то тесто надо замешивать на так называемых жидких дрожжах или молочнокислых заквасках. Это обеспечивает накопление в тесте повышенного количества молочной кислоты, угнетающей α-амилазу и нежелательное образование декстринов.
Напротив, в пивоваренной промышленности конечные декстрины необходимы в сусле, поскольку в дальнейшем создают полноту вкуса пива, в определенной степени обусловливают его пеностойкость.
Глюкоамилаза – фермент, действующий с нередуцирующих концов амилозы и амилопектина, отщепляет молекулу глюкозы. Глюкоамилаза расщепляет не только α-1,4-, но и α-1,6-гликозидные связи. Амилоза и амилопектин полностью превращаются в глюкозу.
|
O |
O |
O |
O |
|
сн2он |
о |
|
|
н |
НОН |
н н |
н |
||||||
|
|
|
|
|
|||||
о |
о |
|
о |
|
он он |
н он |
|||
он |
|
|
|||||||
|
|
|
|
|
|
|
|
||
|
|
амилоза |
|
|
|
н |
он |
|
|
|
|
|
|
|
|
глюкоза |
|
||

28
НОН мальтоза +
нередуцирующий |
редуцирующий |
β -амилодекстрин |
конец |
конец |
|
амилопектин |
||
|
Глюкоамилаза встречается у микромицетов рода Aspergillus, Rhizopus, из которых производятся промышленные препараты глюкоамилазы. Применяется глюкоамилаза в крахмалопаточной промышленности для получения глюкозы и глюкозной патоки.
Вмолекуле амилопектина расщепление α(1→6)-связей катализирует амилопектин-1,6-глюкозидаза, которая действует на точки ветвления.
Врезультате совместного действия этих ферментов происходит полныйгидролиз крахмала до глюкозы.
Целлюлоза Целлюлоза (клетчатка) – структурный полисахарид, является основ-
ным компонентом клеточных стенок растений.
Целлюлоза придает растительной ткани механическую прочность и эластичность, выполняя роль опорного материала растений. В природе целлюлоза не встречается в чистом виде. Волокна хлопка содержат 96-98% целлюлозы, в различных видах древесины содержание ее составляет 40-60%. Волокна льна и конопли состоят преимущественно из клетчатки. Важнейшими спутниками целлюлозы являются лигнин, гемицеллюлозы, пектиновые вещества, смолы и жиры.
Структурной единицей целлюлозы является β-D-глюкопираноза, звенья
которой связаны β-(1→4)-гликозидными связями. Это подтверждается тем, что при частичном гидролизе клетчатки образуется дисахарид целлобиоза,
имеющий тоже β-(1→4)-гликозидную связь.
Строение клетчатки можно выразить следующей формулой:
|
|
|
сн2 |
он |
н |
|
|
сн2 |
он |
|
н |
но |
|
|
но |
|
|
||||
он он |
н |
н |
|
о |
о |
н |
|
|
о |
|
н |
он |
н |
н |
|||||||
н 1 |
|
|
н |
н, он |
||||||
|
|
он |
|
|
|
|
он |
|||
|
о |
о |
н |
|
о |
|
|
|||
сн2 |
|
сн2 |
о n |
н |
он |
|||||
|
|
н |
он |
он |
||||||
он |
|
|
|
|
|
|
|
|
Фрагмент целлюлозы
β-Д-глюкопираноза в составе клетчатки находится в креслообразной конформации. Это исключает возможность спирализации полиглюкозидной цепи, поэтому молекула целлюлозы сохраняет строго линейное строение.
29
Врастительных клеточных стенках молекулы целлюлозы связаны друг
сдругом бок о бок, образуя структурные единицы, получившие названия ми-
крофибрилл.
Каждая микрофибрилла состоит из пучка молекул целлюлозы, расположенных по ее длине параллельно друг другу.
Рентгеноструктурные исследования показали, что в полимерной цепи остатки молекул глюкозы повернуты относительно друг друга на 180°С, что делает возможным образование водородных связей между ОН-группой при атоме С-3 одного глюкозного остатка и кислородом пиранозного кольца следующего остатка глюкозы. Это препятствует вращению расположенных рядом остатков глюкозы вокруг соединяющей их гликозидной связи. В результате образуется жесткая линейная и пространственная структуры.
Целлюлоза не растворяется в воде, но в ней набухает. Она не усваивается организмом человека, т.к. в организме не вырабатывается фермент, способный расщеплять β-гликозидную связь. Однако она является необходимым для нормального питания балластным веществом, выполняющим энтеросорбентную функцию. Целлюлоза усваивается травоядными животными, в желудочно-кишечном тракте которых находится специфическая микрофлора, вырабатывающая фермент целлюлазу.
Схему гидролиза целлюлозы можно представить:
|
|
|
|
сн он |
|
|
|
|
|
|
сн2он |
|
|
|
|
|
сн2он |
|
|
|
|
||||
|
целлюлаза |
н |
|
|
2 |
о |
|
|
н |
|
|
о |
н целлюлазаНОН |
н |
|
о |
|
он |
|||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
(С6Н10О5)n + nН2О |
H |
|
о |
н |
|
|
|
н |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
он |
н |
|
|
|
|
он |
н |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
он |
он |
н н |
|
|
|
|
он |
|
|
н |
||||||||||||
целлюлоза |
|
|
|
|
|
|
он |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
н |
он |
|
|
|
н |
он |
|
|
|
н |
он |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
целлобиоза |
|
|
|
|
|
β -D-глюкоза |
|||||||||
Кислотный гидролиз целлюлозы при температуре 170°С приводит к образованию глюкозы, которая используется для получения кормовых дрожжей, этилового спирта. В промышленности из целлюлозы получают хлопчатобумажные ткани, бумагу и целый ряд химических продуктов: вискозу, целлоффан, кинопленку, ацетатный шелк и др.
4.2 Гетерополисахариды
Пектиновые вещества Пектиновые вещества – это соединения, состоящие главным образом,
из метоксилированной полигалактуроновой кислоты. Остатки галактуроновой кислоты соединены α-1,4 гликозидной связью. Вместе с целлюлозой, гемицеллюлозой и лигнином пектиновые вещества образуют клеточные стенки растений, являясь цементирующим материалом этих стенок, объединяют клетки в единое целое в том или ином органе растений.

30
соосн3 |
|
|
|
соон |
|
|
|
|
|
|
соосн3о |
H |
|
|
соосн3 |
|
||||||||||
|
|
о |
н |
|
|
|
о |
H |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
||
н |
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
он |
н |
|
|
о н |
он |
н |
|
о |
|
|
он |
н |
|
о |
|
|
он |
н |
о |
||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|||
н |
он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
н |
он |
|
|
|
н |
он |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
н |
он |
|
|||||||||||||||
|
|
|
|
метоксилированная полигалактуроновая кислота |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Различают три основные группы пектиновых веществ: протопектины, пектиновая кислота, пектаты, пектин.
Для всех нерастворимых пектиновых веществ существует общее название – протопектин. Основным структурным компонентом протопектина служит галактуроновая кислота, из которой состоит главная цепь, в состав боковых цепей входят арабиноза, галактоза и рамноза. Часть кислотных групп галактуроновой кислоты этерифицирована метиловым спиртом.
В общем виде структуру протопектина можно представить схематиче-
ски:
Арабан метоксилированная Галактан полигалактуроновая
кислота
Протопектин легко расщепляется ферментом протопектиназой, переходя в растворимую форму – пектин.
Пектином называют водорастворимое вещество, свободное от целлюлозы и гемицеллюлоз и состоящее из частично или полностью метоксилированных остатков полигалактуроновой кислоты (фрагмент структуры см. выше).
Пектин содержит 100-200 остатков Д-галактуроновой кислоты. Определить степень метоксилирования затруднительно, так как эфирные связи при экстракции разрываются.
При созревании и хранении плодов происходит переход нерастворимых форм пектина в растворимые. С этим явлением связано размягчение плодов.
Пектиновая кислота – это цепь, состоящая из остатков Д-галактуро- новой кислоты. Соли пектиновых кислот (чаще всего Са или Mg) называют пектатами. Большинство пектиновых кислот содержит от 5 до 100 этих остатков.
соон о н |
соон о |
H |
соон о |
H |
соон |
о |
|
он |
о н он |
|
|
|
|
|
|
|
о |
он |
о |
он |
о |
||
н |
|
|
|
|
н |
|
|
|
Пектиновая кислота |
|
|
|
|||
|
Са |
|
|
|
|||
|
|
|
|
|
|
|
|
соо |
|
соо |
|
|
|
|
|
о |
|
|
о |
|
|
|
|
|
о |
|
|
|
|
|
|
|
пектат |
|
|
|
|
|
|
Пектиновые вещества содержатся в большом количестве в ягодах, пло-
31
дах, клубнях. Важное свойство пектиновых веществ – способность их к желированию, т.е. свойство образовывать прочные студни в присутствии большого количества сахара (65-70%). Частичный гидролиз метиловых эфиров приводит к снижению желирующей способности. Пектиновая кислота не способна образовывать желе в присутствии сахара. Поэтому при промышленном получении пектиновых веществ процесс выделения пектина необходимо вести так, чтобы избежать гидролиза метоксильных групп, вызывающего снижение желирующей способности.
На желирующей способности пектиновых веществ основано использование их в качестве студнеобразующего компонента в кондитерской промышленности для производства конфитюров, мармелада, пастилы, желе, джемов, а так же в консервной промышленности, хлебопечении.
Пектиновые вещества играют в пищевой промышленности и отрицательную роль. В свеклосахарном производстве пектиновая кислота и пектин из свекловичной стружки переходят в диффузионный сок, в котором при его дальнейшей очистке с помощью известкового молока образуются пектаты кальция, в результате чего резко возрастает вязкость очищенного сока, что затрудняет его фильтрацию.
Пектиновые вещества расщепляются под действием ряда ферментов: протопектиназы, пектинэстеразы, полигалактоуроназы.
Схематически ферментативный гидролиз протопектина можно представить так:
Протопектин
протопектиназа
Растворимый пектин |
Арабан, Галактан, рамноза |
|
(метоксилированная |
||
|
||
полигалактуроновая |
|
|
кислота) |
|
Ферментативный гидролиз пектина может протекать с участием двух ферментов: пектинэстеразы и полигалактуроназы.
|
|
|
|
пектинэстераза |
|
|
О |
|
|
о |
ООН |
С |
|
с |
С |
||
O CH3 |
|
O CH3 |
O |
||
|
O |
|
|
O |
|
о он |
о |
он |
|
O OH |
О |
|
|
||||
|
он |
|
|
он |
OH |
|
|
|
|
Полигалактуроназа |
|
Полигалактуроназа |
|
действует |
|
||
|
не действует |
|
|
|
|
Метоксилированная полигалактуроновая кислота
32
Пектинэстеразы удаляют метильные группы, гидролизуя сложноэфирные связи находящиеся рядом со свободными карбоксильными группами, т.е. идет реакция:
пектин + n Н2О → n метанол + пектин (менее этерифицированный)
Таким образом, пектиновые вещества ответственны за содержание токсичного вещества метанола во фруктовых соках, плодово-ягодных винах
Полигалактуроназа катализирует расщепление α-(1-4)-гликозидной связи, образованной неэтерифицированной галактуроновой кислотой..
Препараты, содержащие ферменты, гидролизующие пектиновые вещества, получают обычно из различных плесневых грибов. Эти препараты применяются в пищевой промышленности для осветления фруктовых соков и повышения их выхода, а также для осветления плодовых и виноградных вин, в которых обычно содержится большое количество растворимого пектина, затрудняющего фильтрование и являющегося причиной недостаточной прозрачности вин.
Гемицеллюлозы Гемицеллюлозы – это сложная смесь полисахаридов, не растворяю-
щихся в воде, но растворимых в щелочных растворах. Гемицеллюлозы всегда сопутствуют целлюлозе, в больших количествах содержатся в соломе, семенах, отрубях, кукурузных початках, древесине. В комплексе с целлюлозой выполняют структурную функцию.
Гемицеллюлозы могут быть подразделены на гексозаны (маннаны, галактаны) и пентозаны (арабаны, ксиланы). Продуктами гидролиза у различных гемицеллюлоз являются манноза, галактоза, арабиноза, ксилоза.
Гемицеллюлозы пшеничных отрубей – это высокоразвитые ксиланы, состоящие в основном из Д-ксилозы, L-арабинозы и глюкуроновой кислоты.
Из гемицеллюлоз промышленное применение нашли галактоманнаны, построенные из маннозы, образующей главную цепь, и галактозы, образующей короткие боковые цепи. Галактоманнаны обладают большой способностью связывать воду, поэтому они улучшают качество замеса, участвуют в формировании структуры теста, в частности, в формировании клейковины, тормозят черствение хлеба. Растворы галактоманнанов даже при концентрации 1% обладают высокой вязкостью, что объясняется вытянутой формой макромолекул и их склонностью образовывать в растворах крупные ассоциаты. Это свойство позволяет использовать их в качестве загустителей, стабилизаторов дисперсных систем, гелеобразователей.
Галактоманнаны получают из семян бобовых культур.
Их используют при производстве различных пищевых продуктов, супов, соусов, мороженого, кремов, желе, напитков.
Фирма «Юнипектин» (Швейцария) использует галактоманнаны в 40 наименованиях пищевых продуктов.
33
Камеди и слизи
К полисахаридам близки камеди и слизи. В их состав входят сахара – арабиноза, ксилоза, галактоза, рамноза, а также глюкуроновая и галактуроновая кислоты.
Камеди образуют при набухании в воде вязкие гели или клейкие растворы, слизи при контакте с водой образуют слизистые массы. Камеди образуются в ответ на повреждения тканей растения в виде плотных блестящих натеков (вишневый, сливовый клей). Слизи содержатся в покровных тканях семян льна и зерновки ржи. Кроме защитной функции камеди и слизи могут повышать засухоустойчивость растения, способствуя удержанию влаги.
Слизи имеют большое значение при переработке зерна ржи. Они повышают вязкость ржи при размоле, поэтому оно вымалывается труднее, чем пшеница и энергозатраты на размол у него выше. Слизи влияют на структур- но-механические свойства в тесте, а, следовательно, и на качество хлеба.
Мукополисахариды
Мукополисахариды получили свое название потому, что ряд веществ этого класса имеют слизистую консистенцию (от лат. mucus – слизь). Для мукополисахаридов характерно наличие их в молекулах значительного количества остатков аминосахаров и уроновых кислот. Это полисахариды соединительной ткани. Мукополисахариды обычно связаны с белками. Важнейшими представителями этой группы полисахаридов являются гиалуроновая кислота, хондроитин-серные кислоты и гепарин.
Гиалуроновая кислота построена из дисахаридных остатков, соединенных β-1,4-гликозидными связями. Дисахаридный фрагмент состоит из
остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, связанных β- 1,3-гликозидной связью:
соон |
|
|
|
сн2 |
он |
|
соон |
|
|
|
|
он |
|
|
|
н |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
н |
о |
|
|
о |
н |
|
о |
|
н |
сн2 |
о |
|
|
|
|
н |
|
|
|
||||||||
он |
н |
1 |
о |
н 1 о 4 нон |
н |
|
|
н |
|
||||
|
|
о |
н |
о |
|||||||||
о |
|
н |
он 3 |
н |
|
|
|
н |
он |
3 |
|
||
н |
он |
|
н |
|
|
н |
|||||||
|
н |
NHCOCH3 |
|
он |
|
||||||||
|
|
|
|
|
|
|
н |
NHCOCH3 |
|||||
|
β -1,3-связь |
|
β -1,4-связь |
|
|
|
|||||||
|
|
|
β -1,3-связь |
|
|
||||||||
Фрагмент гиалуроновой кислоты
Гиалуроновая кислота имеет высокую молекулярную массу порядка 106, растворы ее обладают высокой вязкостью. Высокая вязкость гиалуроновой кислоты отчасти вызвана ее полианионным характером при физиологических значениях рН, которые способствуют гидратированию цепей и образованию между ними водородных связей. Вследствие высокой вязкости она понижает проницаемость тканевых оболочек и препятствует проникновению в ткани болезнетворных микроорганизмов. Особенно высоко ее содержание в коже, стекловидном теле глаза, сухожилиях. Гиалуроновой кислоте присущи не только структурные функции. Пронизывая ткани в качестве межклеточного вещества гиалуроновая кислота регулирует поступление в клетки тех соеди-
34
нений, которые или нужны для жизнедеятельности клетки или являются ее продуктом.
Хондроитинсульфат – непременная составляющая часть хряща, костной ткани, сухожилий, сердечных клапанов. Хондроитинсульфат прочно связан с белком коллагеном.
Хондроитинсульфаты состоят из дисахаридных остатков N-ацетилиро- ванного хондрозина, соединенных β-1,4-гликозидными связями. В состав хондрозина входят D-глюкуроновая кислота и D-галактозамин, связанные между собой β-1,3-гликозидной связью.
|
|
|
|
|
|
он |
|
н |
соон |
|
|
|
сн2 |
|
|
|
о |
|
|
он |
о |
|
|
4 |
н |
н |
|
о |
н |
н 1 |
он |
он |
|
|
|||||
он |
|
|
н |
|
н 3 |
2 |
|
|
н |
он |
|
|
н |
NHCOCH3 |
|
|
|
|
β -1,3-связь |
|
|
||
N-ацетилхондрозин
Как свидетельствует само название, эти полисахариды являются эфирами серной кислоты (сульфатами). Сульфатная группа образует эфирную связь с гидрокисльной группой N-ацетил-D-галактозамина, находящейся либо в 4-м, либо в 6-м положении. Соответственно различают хондроитин-4- сульфат и хондроитин-6-сульфат.
Наличие дополнительных SO3-группировок сообщает еще больший полианионный характер хондроитинам.
|
|
соон |
|
|
|
|
сн2 |
он |
|
|
|
|
|
|
он |
|
|
н |
|
|
|
|
|
|
соон |
|
|
|
|
|
|||
|
о |
|
|
HO3SO |
о |
н |
о |
HO3SO |
сн2 |
|
|
|||||
|
|
|
1 |
н |
н |
о |
|
|||||||||
|
|
он |
н |
|
о |
н 1 о 4 |
|
|
о |
н |
|
|||||
о |
|
|
|
|
он |
н |
|
н |
о |
|||||||
|
|
|
|
|
н |
он 3 |
|
н |
|
|
н |
он |
3 |
|
||
|
|
н |
он |
|
|
|
|
н |
||||||||
|
|
|
|
н |
NHCOCH3 |
н |
он |
|
|
|
NHCOCH3 |
|||||
|
|
|
|
|
|
|
|
|
н |
|||||||
|
|
|
|
β -1,3-связь |
|
|
β -1,4-связь |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
β -1,3-связь |
|
|
||||||
Хондроитин-4-сульфат
Гепарин – гетерополисахарид, широко распространенный в тканях животного организма и особенно в значительных количествах содержащийся в печени, сердце, мышцах и легких. Ничтожные количества гепарина задерживают свертывание крови, т.е. он является сильным природным антикоагулянтом. Благодаря этому гепарин получил практическое применение в медицине.
Гепарин состоит из повторяющихся дисахаридных единиц, в состав которых входят остатки D-глюкозамина и двух уроновых кислот – D-глюкуро- новой и L-идуроновой (преобладает). Внутри дисахаридного фрагмента осу-
35
ществляется α-1,4-связь, если фрагмент оканчивается L-идуроновой кислотой, и β-1,4-связь, если D-глюкуроновой кислотой.
Аминогруппа у большинства глюкозаминных остатков сульфатирована, а у некоторых из них – ацетилирована.
|
сн2оsо3н |
|
|
н |
|
|
н |
сн2oso3н |
|
соон |
|
сн2oso3н |
|
н |
|
|
|||
|
н |
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
||||
н |
н |
о |
н |
соон |
о |
о |
|
н |
о н |
н |
н |
о |
н |
о н |
|
н |
о |
|
|
н |
1 |
|
|
|
н |
о |
н |
|
ноос |
|
|||||||||
|
он |
|
|
|
|
он |
|
н |
о |
||||||||||
о |
|
|
|
он |
|
|
|
он |
|
|
он |
|
|
||||||
|
|
о |
|
|
н |
|
|
|
о |
|
|
н |
|
о |
он |
н |
|||
|
|
|
|
|
|
|
|
|
н |
|
|
||||||||
|
н |
|
|
|
н |
oso3н |
|
|
н |
NHSO3H |
|
он |
н |
NHSO |
H |
н |
oso |
н |
|
|
NHSO H |
|
|
|
|
|
|
||||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
3 |
|
Фрагмент молекулы гепарина
4.3Пищевые волокна
Основным источником углеводов в пище человека являются продукты растениеводства. С биохимической точки зрения все углеводы пищи можно подразделить на усвояемые организмом и неусвояемые.
Усвояемые углеводы являются основным источником химической энергии в организме, т.е. при их диссимиляции выделяется энергия, необходимая для различных метаболических процессов.
Неусвояемые углеводы не перевариваются в желудочно-кишечном тракте, не всасываются в кишечнике, а если и всасываются, то не вступают в метаболические процессы в организме. К неусвояемым углеводам относятся полисахариды: целлюлоза, гемицеллюлозы, пектиновые вещества; олигосахариды: рафиноза, а также некоторые простые сахара. Пищеварительные секреты слюнной железы, желудка и кишечника не выделяют ферментов, способных расщеплять эти углеводы. Неусвояемые полисахариды образуют группу балластных веществ, называемых пищевыми волокнами. В технологии пищевых продуктов стремятся от них избавиться с целью получения более «рафинированной» пищи. Однако, присутствие их в пищевых продуктах необходимо. Доказано, что недостаток в рационе пищевых волокон является причиной многих желудочно-кишечных заболеваний, атеросклероза и диабета, поскольку они играют существенную роль в поддержании нормальной регуляции питания и метаболизма ряда веществ способствуют лучшему функционированию кишечника. Пищевые волокна, набухая в кишечнике, приобретают способность сорбировать и удалять из организма вредные вещества (токсины), катионы тяжелых металлов, радионуклиды, т.е. выполняют энтеросорбентную функцию. Кроме того, пищевые волокна нормализуют обмен холестерина, способствуют нормальному развитию полезной кишечной микрофлоры.
Плоды и овощи - морковь, капуста, свекла – содержат относительно большое количество пищевых волокон – до 1,5%.
Не обладая высокой энергетической ценностью, большинство овощей из-за обилия в них клетчатки способствуют раннему и довольно стойкому
36
чувству насыщения. Это свойство пищевых волокон трудно переоценить в комплексе мер профилактики и терапии ожирения.
Все это позволило отнести пищевые волокна к одному из резервов здорового долголетия. В суточном рационе взрослого человека должно содержаться 25-30 г пищевых волокон.
Наиболее полезны – пектины, лигнин, целлюлоза и гемицеллюлоза пшеничных отрубей, затем идут волокна капусты, затем – морковь.
5 Обмен углеводов
5.1Общие представления об обмене веществ и энергии
Обмен веществ и энергии составляет сущность жизнедеятельности любого организма. Обмен веществ представляет собой непрерывный, самосовершающийся и саморегулируемый круговорот веществ, протекающий в процессе существования живой материи и сопровождающийся ее постоянным самообновлением. Иными словами обмен веществ есть диалектическое единство противоположных процессов: ассимиляции (синтеза) и диссимиляции (распада), т.е. единство противоположных процессов питания и выделения, усвоения и разрушения, синтеза и распада.
Обмен веществ невозможен без сопутствующего ему обмена энергии. Каждое органическое соединение, входящее в состав живой материи, обладает определенным запасом потенциальной энергии, за счет которой может быть совершена работа. Эту энергию называют свободной энергией. Уровни свободной энергии индивидуальных исходных веществ и продуктов реакции, как правило, различны, вследствие чего в процессе преобразования веществ происходит перераспределение свободной энергии между компонентами реакционной смеси, т.е. протекает обмен энергией между веществами. Главными материальными носителями свободной энергии в органических веществах являются химические связи между атомами, поэтому при преобразовании химических связей в молекуле уровень свободной энергии соединения изменяется. Нормальными считаются связи, при возникновении или распаде которой уровень свободной энергии составляет около 12,5 кДж/моль. Однако, при новообразовании и распаде некоторых связей уровень свободной энергии в молекулах ряда органических веществ изменяется в гораздо большей степени и составляет 25-50 кДж/моль и более. Такие соединения называются макроэргическими, а связи, при образовании которых наступают столь крупные изменения в энергетическом балансе вещества – макроэргическими связями. В отличие от обычных они обозначаются значком ( ). В качестве примеров можно привести АТФ, глицерол-3-фосфат, коэнзим А, креатин-фосфат и др.
Макроэргические вещества выполняют функцию и доноров, и акцепторов энергии в обмене веществ, они служат как аккумуляторами, так и проводниками энергии в биохимических процессах. Кроме того, им свойственна роль трансформаторов энергии, так как они способны преобразовывать стационарную форму энергии химической связи в мобильную, т.е. в энергию
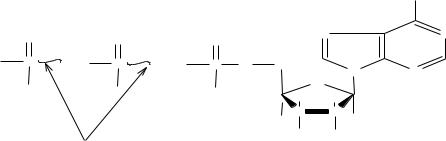
37
возбужденного состояния молекулы. Наиболее важным макроэргическим со- единением в организме является аденозинтрифосфорная кислота – АТФ:
|
|
|
|
|
|
NH2 |
O |
|
O |
O |
N |
|
N |
HO Р |
О |
Р |
О Р O |
СН2 |
N |
N |
|
||||||
HO |
|
HO |
HO |
O |
|
|
|
H |
H |
|
|||
|
|
|
|
|
||
|
|
|
|
H C |
C H |
|
|
|
|
|
OH |
OH |
|
макроэргические связи
5.2 Биологическое окисление
Совокупность окислительных реакций, происходящих в биологических объектах и обеспечивающих их энергией и метаболитами для осуществления процессов жизнедеятельности, называется биологическим окислением.
Существует два типа окисления: свободное окисление, не сопряженное с фосфорилированием АДФ (его называют еще микросомальное окисление) и окисление, сопряженное с фосфорилированием АДФ.
При свободном окислении высвобождающаяся при распаде химических связей энергия переходит в тепловую и рассеивается. По типу свободного окисления идут все без исключения оксигеназные реакции, все окислительные реакции, ускоряемые пероксидазами, многие реакции, катализируемые оксидазами. Процессы свободного окисления сосредоточены в цитоплазме, в мембранах эндоплазматической сети клетки, в мембранах лизосом, пероксисом и аппарата Гольджи.
Свободное окисление выполняет важную функцию модификации чужеродных соединений, например, лекарственных средств, гербицидов, продуктов загрязнения окружающей среды, попадающих в организм с водой, пищей. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию (разложение) и выведение из организма.
При других видах окисления происходит накопление энергии в макро-
эргических связях АТФ. Реакция АДФ + Н3РО4 → АТФ + НОН называется реакцией фосфорилирования. Окисление, сопряженное с фосфорилированием АДФ, осуществляется двумя способами: путем субстратного фосфорилирования и путем окислительного фосфорилирования.
Если фосфорилирование АДФ происходит за счет разрыва макроэргической связи субстрата, такое фосфорилирование называется субстратным.
Если атомы водорода с коферментов дегидрогеназ, принимающих участие в окислении субстратов, передаются в оксидоредуктазную цепь, где сопряженно с переносом протонов и электронов на молекулярный кислород происходит фосфорилирование АДФ с образованием АТФ, такое фосфорилирование называется окислительным.
5.2.1 Брожение и дыхание
38
Окисление органических соединений, как уже указывалось, является основным источником энергии в живом организме в целом, и в клетке, в частности.
Окисление органических соединений (углеводов, жиров, белков) в организме может протекать двумя путями: в присутствии кислорода воздуха – этот тип окисления называется аэробным, или дыханием, и в отсутствии кислорода – этот тип окисления называется анаэробным, или брожением.
Общее уравнение дыхания глюкозы, например:
С6Н12О6 + 6О2 → 6СО2 + 6Н2О + 2780 кДж. Различают три основных типа брожения:
маслянокислое: С6Н12О6 |
|
|
H3C |
|
|
|
CH2 |
|
СН2СООН + 2Н2 + 2СО2+ Q кДж |
|||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
масляная кислота |
|||||||||
молочнокислое: С6Н12О6 |
|
|
|
|
2 H3C |
|
HC |
|
СООН+QкДж |
|||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
|
|
|
|
|
|
|
|
молочная кислота |
||||||
спиртовое: С6Н12О6 |
|
|
|
|
|
|
2С2Н5ОН + СО2 + Q кДж |
|||||||
|
|
|
|
|
|
|||||||||
глюкоза |
|
|
|
|
|
этанол |
||||||||
Кроме этих основных видов брожения в природе существуют пропионовокислое, уксуснокислое, ацетоновое и другие виды, но они являются определенным сочетанием основных типов брожение и находят применение или сопровождают технологические процессы в различных отраслях промышленности.
Здесь мы приводим суммарные уравнения реакций аэробного и анаэробного окисления глюкозы. Но процесс окисления, в целом, представляет собой множество последовательно протекающих ферментативных реакций в клетках.
Конечной целью обоих этих процессов является:
а) синтез АТФ за счет утилизации энергии, аккумулированной в углеводах;
б) получение пластических соединений, являющихся исходным материалом для синтеза компонентов клетки.
5.2.2 Гликолиз
Гликолиз – универсальный и основной процесс катаболизма углеводов для большинства организмов, это последовательность реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
Важнейшими моносахаридами, катаболизм которых осуществляется по гликолитическому пути, являются Д-глюкоза и Д-фруктоза. Однако и другие моносахариды способны распадаться по пути гликолиза, поскольку они легко превращаются в эти сахара. Гликолиз – процесс анаэробный, однако он мо-
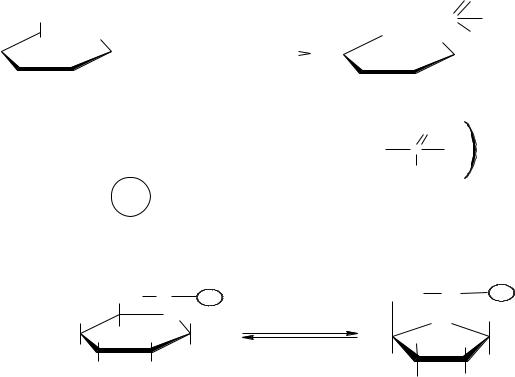
39
жет протекать как в отсутствии, так и в присутствии кислорода. Он является ключевым метаболическим путем, генерирующим энергию в форме АТФ в клетках, где отсутствует фотосинтез.
Исследования химизма гликолиза показали, что начальные этапы процессов брожения и дыхания имеют общий путь. Это открытие было уникальным, потому что оно вскрывало существование внутреннего единства живой материи. При дыхании у аэробных организмов гликолиз предшествует циклу трикарбоновых кислот и цепи переноса электронов. Пируват проникает в митохондрии, где он полностью окисляется до СО2, в результате чего с высокой эффективностью из гексозы извлекается свободная энергия. При брожении, в анаэробных условиях (дрожжи, молочнокислые бактерии), пируват превращается в продукты брожения (этанол, лактат).
Все реакции гликолиза протекают в цитоплазме клетки и катализируются десятью различными ферментами.
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой, относящимся к классу трансферазы:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
СН2ОН |
|
|
|
|
|
СН2О |
|
P |
OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
H |
|
|
|
|
|
O H |
|
2+ |
H |
|
|
|
|
|
O H OH |
|||||||
|
H |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
+ АТФ |
Mg |
|
|
|
H |
|
|
|
|
|
|
+ АДФ |
|||
|
|
OH |
H |
|
гексокиназа |
|
|
OH |
H |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
HO |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
OH |
|
|||||
|
|
H |
OH |
|
|
|
|
H |
OH |
|
||||||||||||
|
|
|
глюкоза |
|
|
глюкозо-6-фосфат |
|
|||||||||||||||
В дальнейшем остаток фосфорной кислоты  чать символом: Р .
чать символом: Р .
O
P OH
OH |
будем обозна- |
|
Второй реакцией гликолиза является превращение глюкозо-6-фосфата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фос- фат:
СН2 O |
Р |
|
СН2 O |
Р |
||
H |
O H |
|
гексозо-6-фосфат- |
O |
|
СН2ОН |
OH |
H |
|
изомераза |
H |
O |
|
HO |
OH |
|
|
|||
|
H |
|
OH |
|||
H |
OH |
|
|
|
||
|
|
OH |
H |
|
||
|
|
|
|
|
||
|
|
|
|
|
|
|
глюкозо-6-фосфат |
|
|
фруктозо-6-фосфат |
|||
Третья реакция катализируется ферментом фосфофруктокиназой (класс трансферазы):
40
СН |
2 |
O |
Р |
|
|
СН2 O |
Р |
|
|
O |
СН2ОН |
|
|
|
|||
|
|
|
2+ |
O |
СН2О Р |
|
||
H |
|
O |
+ АТФ |
Mg |
H |
O |
+ АДФ |
|
|
6-фосфофруктокиназа |
|||||||
H |
|
|
OH |
|
H |
|
||
|
|
|
|
OH |
|
|||
OH |
H |
|
|
|
||||
|
|
OH |
H |
|
||||
фруктозо-6-фосфат |
|
|
фруктозо-1,6-бисфосфат |
|
||||
Четвертую реакцию гликолиза катализирует фермент альдолаза (класс лиазы). Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
СН2 O |
Р |
|
|
|
|
O |
|
O |
СН2О |
P |
H2C |
OH |
|
C |
|
|
|
|
H |
|
|||
H |
O |
|
C |
O |
|
+ HC OH |
|
H |
OH |
|
альдолаза |
|
Р |
H2C O |
Р |
|
H2C O |
||||||
OH |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фруктозо-1,6-бисфосфат |
|
Диоксиацетонфосфат |
Глицеральдегид-3-фосфат |
||||
Пятая реакция – это реакция изомеризации триозофосфатов, катализируется ферментом триозофосфатизомеразой:
|
|
|
|
O |
|
СН2ОН |
|
C |
H |
|
|
триозофосфат- |
|
|
|||
|
|
|
|
|
|
C |
O |
изомераза |
HC |
OH |
|
|
|
|
|
||
H2C |
O |
Р |
H2C |
O |
Р |
|
|
|
|||
Диоксиацетонфосфат |
Глицеральдегид-3-фосфат |
||||
В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно – глицеральде- гид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы, дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат, т.е. дальнейшему окислению подвергается 2 молекулы фосфотриозы.
Образованием глицеральдегид-3-фосфата завершается первая стадия гликолиза.
Вторая стадия включает в себя окислительно-восстановительную реакцию, сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы (класс оксидоредуктазы), кофермента НАД+ и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАДН:
41
|
O |
|
|
C |
O |
|
|
C |
H |
|
|
О |
Р |
||
|
+ НАД+ + Н3РО4 |
глицеральдегидфосфат- |
|
||||
HC |
OH |
HC |
OH |
+ НАДН + Н+ |
|||
дегидрогеназа |
|||||||
H2C |
O |
Р |
|
H2C |
O |
Р |
|
Глицеральдегид-3-фосфат |
|
1,3-бисфосфоглицерат |
|||||
1,3-бисфосфоглицерат представляет собой высокоэнергетическое соединение.
Седьмая реакция катализируется фосфоглицераткиназой (класс трансферазы), при этом происходит передача богатого энергией фосфатного остатка на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты:
C |
O |
|
|
|
O |
|
|
О |
Р |
|
C |
OH |
|
||
|
фосфоглицерат- |
|
|
||||
HC |
OH |
+ АДФ |
HC |
OH |
+ АТФ |
||
киназа |
|||||||
|
|
||||||
H2C |
O |
Р |
|
H2C |
O |
Р |
|
1,3-бисфосфоглицерат |
|
3-фосфоглицериновая |
|||||
кислота
Данная реакция является реакцией субстратного фосфорилирования. Восьмая реакция сопровождается внутримолекулярным переносом
оставшейся фосфатной группы под действием фермента фосфоглицеромутазы (класс изомеразы).
|
O |
|
|
O |
|
C |
OH |
|
|
C |
|
|
|
фосфоглицеро- |
OH |
|
|
HC |
OH |
|
HC О |
Р |
|
|
мутаза |
||||
H2C |
O |
Р |
|
СН2ОН |
|
3-фосфоглицериновая |
|
2-фосфоглицериновая |
|||
|
кислота |
|
|
кислота |
|
Девятая реакция катализируется ферментом енолазой (класс лиазы):
O |
|
|
O |
|
|
C |
|
|
C |
|
|
OH |
|
енолаза |
OH |
Р + Н2О |
|
HC О |
Р |
C О |
|||
|
|||||
|
|
||||
СН2ОН |
|
|
СН |
|
|
|
|
|
2 |
|
|
2-фосфоглицериновая |
|
фосфоенолпировиноградная |
|||
кислота |
|
|
кислота |
|
|
Десятая реакция характеризуется разрывом высокоэнергетической связи и переносом фосфатного остатка от фосфоенолпировиноградной кислоты на АДФ (субстратное фосфорилирование).
Катализируется ферментом пируваткиназой (класс трансферазы):

|
|
|
42 |
|
|
|
O |
|
|
|
|
O |
|
C |
|
|
|
|
C |
|
OH |
|
|
|
пируват- |
OH |
|
C О |
|
|
|
|
||
Р |
+ |
АДФ |
киназа C О + АТФ |
|||
|
||||||
СН2 |
|
|
|
|
СН |
|
фосфоенолпировиноградная |
|
|
3 |
|||
|
пировиноградная |
|||||
кислота |
|
|
|
|
кислота |
|
Далее пути аэробного и анаэробного окисления расходятся.
Ванаэробных условиях дальнейшие превращения пирувата приводят к образованию продуктов брожения.
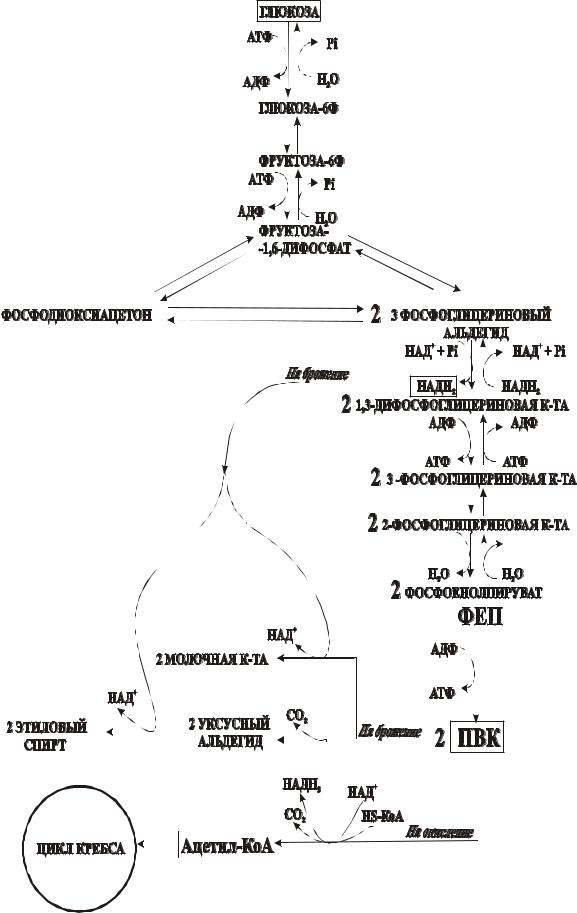
Вобщем виде схема гликолиза имеет вид (рис.1).
5.2.3Спиртовое брожение
Превращение пировиноградной кислоты в этанол идет в двух последовательных реакциях. В первой происходит ее декарбоксилирование:
|
|
O |
|
|
|
|
|
|
C |
|
|
|
O |
|
|||
|
|
OH |
пируватдекар- |
|
|
+ СО2 |
||
|
|
|
|
|
||||
C |
|
O |
H3C |
|
C |
|||
|
боксилаза |
|
||||||
|
||||||||
|
|
|
|
|||||
|
|
|
|
|
|
|
H |
|
СН3 |
|
|
||||||
|
|
|
|
|
||||
пировиноградная |
ацетальдегид |
|
||||||
|
|
кислота |
|
|
||||
|
|
|
|
|
|
|
||
Реакция катализируется пируватдекарбоксилазой (класс лиазы), которая содержит в качестве кофермента тиаминпирофосфат (ТПФ), активную форму витамина В1.
Вторая реакция состоит в восстановлении ацетальдегида в этанол за счет НАДН:
|
|
O |
+ НАДН+ Н |
+ алкогольдегид- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H3C C |
H3C |
|
CH2 |
|
OH + НАД+ |
|||||
|
рогеназа |
|
|
|||||||
|
|
H |
|
|
|
|
|
|
|
|
ацетальдегид |
|
|
|
этанол |
||||||
|
|
|
|
|
|
|
|
|||
Реакция катализируется алкогольдегидрогеназой (класс оксидоредуктазы), коферментом которой является НАДН.
В данной реакции используется тот НАДН, который образовался при гликолизе в шестой реакции, при этом регенерируется НАД+. Суммарная реакция спиртового брожения:
С6Н12О6 + 2Н3РО4 + 2АДФ |
|
2С2Н5ОН+ 2СО2+ 2АТФ+ 2Н2О |
|
||
глюкоза |
|
этанол |
Спиртовое брожение является важнейшей стадией в технологии хлеба,спирта, пива, вина.
43
Рис.1 Схема гликолиза
5.2.4Молочнокислое брожение
44
Молочнокислое брожение отличается от спиртового тем, что пировиноградная кислота не декарбоксилируется как при спиртовом брожении, а непосредственно восстанавливается лактатдегидрогеназой (класс оксидоредуктазы) с участием НАДН, образовавшегося при гликолизе в шестой реакции:
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
||
C |
|
|
|
|
|
|
|
|
C |
||||||
|
|
OH |
лактатдегид- |
|
|
|
OH |
||||||||
|
|
|
|
O + НАДН + Н+ |
|
|
|
|
OH + НАД+ |
||||||
C |
|
|
|
рогеназа |
HC |
|
|
||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
|
|
|
|
|
|
|
СН3 |
|||||
пировиноградная |
|
|
|
молочная кислота |
|||||||||||
|
|
кислота |
|
|
|
|
|
|
(лактат) |
||||||
|
|
Суммарная реакция превращения глюкозы в лактат: |
|||||||||||||
С6Н12О6 |
+ 2АДФ + 2Н3РО4 |
|
|
H3C |
|
CH |
|
|
СООН + 2АТФ + 2Н2О |
||||||
|
|
|
|
|
|||||||||||
|
|
||||||||||||||
HO
Молочнокислое брожение является основной стадией в производстве ржаного хлеба, в консервировании овощей и плодов, в изготовлении кисломолочных продуктов.
Молочнокислое брожение играет большую роль в засолке огурцов и помидоров, квашении капусты, мочке яблок. Молочная кислота является консервирующим фактором, предотвращающим развитие посторонней, особенно гнилостной, микрофлоры, придает продукту специфический вкус и аромат.
5.2.5Биоэнергетика анаэробного разложения углеводов
В процессе гликолиза затрачиваются две молекулы АТФ. Это реакции: первая – образования глюкозо-6-фосфата и третья – фруктозо-1,6-бисфосфа- та. В двух реакциях синтезируется АТФ за счет субстратного фосфорилирования. Это реакции образования глицерат-3-фосфата (см. реакцию 7) и ПВК (реакция 10). Поскольку в ходе гликолиза каждая молекула гексозы расщепляется на 2 трехуглеродных фрагмента, то, следовательно, в этом процессе синтезируются 4 молекулы АТФ. В шестой реакции (окисления глицеральде- гид-3-фосфата) образуется 2 молекулы НАДН2, которые в дыхательной цепи дадут 6 молекул АТФ. Итого в процессе гликолиза синтезируется 4+6–2=8 молекул АТФ. При образовании этилового спирта или молочной кислоты НАДН2 затрачивается на восстановление уксусного альдегида и ПВК соответственно. Поэтому выход АТФ при спиртовом или молочнокислом брожении глюкозы составит 4+6–2––6=2 молекулы АТФ.
5.2.6 Аэробное окисление
Клетки, недостаточно снабжаемые кислородом, могут частично или полностью существовать за счет энергии гликолиза. Однако большинство животных и растительных клеток в норме находятся в аэробных условиях. В этих условиях пируват, образовавшийся при расщеплении глюкозы, не восстанавливается до лактата, а постепенно окисляется до СО2 и Н2О в аэробной стадии катаболизма, при этом первоначально происходит окислительное декарбоксилирование пировиноградной кислоты.

45
5.2.6.1 Окислительное декарбоксилирование пировиноградной кислоты (ПВК)
Окисление ПВК до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс».
Процесс окислительного декарбоксилирования ПВК происходит в матриксе митохондрий. В нем принимают участие (в составе пируватдегидрогеназного комплекса) 3 фермента (пируватдегидрогеназа, дигидролипоилдегидрогеназа и дигидролипоилацетилтрансфераза) и 5 коферментов (тиаминпирофосфат (ТПФ (витамин В1)), амид липоевой кислоты, коэнзим А (СоА (витамин В3)), ФАД (флавинадениндинуклеотид (витамин В2)),НАД+(никотинамидадениндинуклеотид (витамин РР)).
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
H3C |
|
C |
|
СООН |
+ НSСоА |
|
|
|
|
O |
|
|
|
|
|
|
|||||
|
|
O |
|
+ НАД+ |
|
H3C |
|
C |
+ НАДН + Н+ + СО2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
SСоА |
ПВК
ацетил-СоА
Образовавшийся в процессе окислительного декарбоксилирования аце- тил-СоА окисляется далее в цикле трикарбоновых кислот с образованием СО2 и АТФ.
5.2.6.2 Цикл трикарбоновых кислот (Цикл Кребса).
Этот цикл известен также под названием цикла лимонной кислоты или цикла Кребса в честь Г. Кребса, определившего последовательность реакций цикла. За это открытие Кребс получил в 1953 году Нобелевскую премию.
Хотя цикл трикарбоновых кислот мы рассматриваем во взаимосвязи с катаболизмом углеводов, однако его роль в метаболизме веществ гораздо шире.
Цикл Кребса выполняет следующие функции:
1.Интегративную – объединяет пути катаболизма углеводов, жиров, белков; во всех аэробных организмах он выступает в роли центрального метаболического пути углерода.
2.Амфиболическую – выполняет не только катаболическую функцию распада ацетильных остатков, но и анаболическую, поскольку субстраты цикла используются для синтеза других веществ;
3.Энергетическую – совместно с цепью переноса электронов является основным поставщиком химической энергии в форме АТФ.
Реакции цикла протекают в матриксе митохондрий и представляют восемь последовательных превращений.
Первая реакция цикла начинается с конденсации ацетил-СоА с оксалоацетатом, в результате чего образуется лимонная кислота.
Реакция катализируется цитрат-синтазой (класс лиазы):
46
|
|
|
O |
|
СООН |
+ НОН цитратсинтаза |
|
СООН |
|||||
|
|
|
|
|
|
|
|
|
|
|
+ НSСоА |
||
H3C |
|
C |
|
+ C |
|
О |
|
|
|
||||
|
SСоА |
|
|
|
CH2 |
||||||||
|
|
||||||||||||
|
|
|
|||||||||||
|
|
|
|
CH2 |
НО |
|
C |
|
СООН |
||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
СООН |
|
|
|
|
|
|
||
ацетил-СоА |
|
|
|
|
|
CH2 |
|
||||||
|
оксалоацетат |
|
|
|
|
||||||||
|
|
|
|
|
|
|
СООН |
||||||
|
|
|
|
|
|
|
|
лимонная кислота |
|||||
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидрагированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную (изоцитрат). Обратимые реакции гидратации-дегидратации катализирует фермент аконитаза (класс лиазы):
|
|
СООН |
|
|
|
|
СООН |
|
|
|
|
|
|
|
СООН |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
CH2 |
||||||||||
|
|
|
CH2 |
Н2О |
|
|
|
|
|
|
Н2О |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
С |
|
COOH |
|
|
|
|
|
Сн |
|
COOH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
НО С COOH |
|
|
|
|
|
|
|
Н2О |
|
|
|
|
||||||||||||||
Н О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
CH |
|
|
|
НО |
|
СН |
|||||||||||
|
|
|
CH2 |
2 |
|
|
|
|
|
аконитаза |
|
|
||||||||||||||
|
|
|
аконитаза |
|
|
|
|
|
СООН |
|
|
|
|
|
|
|
СООН |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
СООН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изолимонная кислота |
|||||||||||
лимонная кислота |
цис-аконитовая кислота |
|
||||||||||||||||||||||||
Третья реакция лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД–зависимой дегидрогеназы ( класс оксидоредуктазы):
|
|
СООН |
|
СООН |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
||||||||||
|
|
|
НАД+ изоцитрат- |
|
CH2 |
|
||||||
|
|
Сн |
|
COOH + |
|
CH2 |
+ СО2 + НАДН + Н+ |
|||||
|
||||||||||||
|
|
|
|
|
|
|
дегидрогеназа |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
НО |
|
СН |
α |
C |
|
O |
||||||
|
|
|||||||||||
|
|
|||||||||||
|
|
|
|
СООН |
|
|
СООН |
|||||
|
|
|
|
|
||||||||
изолимонная кислота |
-кетоглутаровая |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
кислота |
|
Во время четвертой реакции происходит окислительное декарбоксилирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-СоА.
Механизм этой реакции сходен с механизмом реакции окислительного декарбоксилирования ПВК. α-кетоглутаратдегидроге-назный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс (см. пируватдегидрогеназный комплекс):

47
СООН |
|
СООН |
||||||||
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|||||||
|
|
α -кетоглутарат |
|
CH2 |
+ |
|||||
|
|
|
+ НАД+ + НSСоА |
|
|
|
|
|
+ НАДН + Н + СО2 |
|
|
CH |
дегидрогеназный |
|
CH |
||||||
|
|
2 |
|
комплекс |
|
|
2 |
|
||
|
|
|
|
|
||||||
C |
|
O |
|
С |
|
O |
||||
|
|
|
||||||||
|
|
|
||||||||
|
|
СООН |
|
|
|
|
SСоА |
|||
|
|
|||||||||
α -кетоглутаровая |
|
сукцинил-СоА |
||||||||
|
|
|
кислота |
|
||||||
Пятая реакция катализируется ферментом сукцинил-СоА-синтетазой (класс лигазы):
СООН |
|
|
СООН |
|
||||
|
|
|
|
|
|
|
|
|
CH2 |
|
|
||||||
|
сукцинил-СоА- |
|
|
CH2 |
+ ГТФ + НSСоА |
|||
|
|
|
+ ГДФ + Н3РО4 |
|
|
|
||
|
|
|
синтетаза |
|
|
|
||
|
CH2 |
|
|
|
CH2 |
|
||
C |
|
O |
|
|
|
СООН |
|
|
|
|
|
||||||
|
|
|
||||||
|
|
|
|
|
янтарная кислота |
|||
|
|
SСоА |
|
(сукцинат) |
||||
сукцинил-СоА
ГТФ + АДФ |
|
АТФ + ГДФ |
|
Данная реакция является реакцией субстратного фосфорилирования, т.к. за счет высокоэргической тиоэфирной связи сукцинил-КоА происходит образование высокоэргической фосфатной связи ГТФ.
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой (класс оксидоредуктазы), простетической группой при этом является ФАД.
СООН |
|
СООН |
||||
|
|
|
||||
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
CH |
||||
|
+ ФАД |
сукцинатдегид- |
|
|
|
+ ФАДН2 |
|
|
|
|
|||
|
рогеназа |
|
|
|
||
|
|
|
|
|||
|
CH2 |
|
CH |
|||
|
СООН |
|
|
|
|
|
|
|
СООН |
||||
янтарная кислота |
|
|||||
|
фумаровая кислота |
|||||
Седьмая реакция осуществляется под влиянием фермента фумаратгидратазы (класс лиазы):
СООН |
|
|
СООН |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH |
+ НОН |
фумарат |
HC |
|
|
OH |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
CH |
|
гидратаза |
|
CH2 |
||||
|
|
|
|||||||
|
СООН |
|
|
|
СООН |
||||
фумаровая кислота |
|
яблочная кислота |
|||||||
|
|
|
|
|
|
малат |
|||
В ходе восьмой реакции цикла трикарбоновых кислот под влиянием НАД-зависимой малатдегидрогеназы происходит окисление яблочная кислоты в оксалоацетат:

48
СООН |
|
СООН |
|
|
|
||||
|
OH |
|
|
|
|
|
|
|
|
HC |
|
C |
|
O |
+ НАДН |
+ |
|
||
|
|
|
|||||||
|
|
|
|||||||
|
+ НАД+ |
дрогеназа |
|
|
|
|
Н |
||
|
|
малатдеги- |
|
|
|
|
|
|
+ |
|
CH2 |
|
|
CH2 |
|
|
|
||
|
СООН |
|
|
СООН |
|
|
|
||
яблочная кислота |
|
оксалоацетат |
|
|
|||||
Таким образом за один оборот цикла происходит полное окисление одной молекулы ацетил-СоА и регенерация оксалоацетата, который вновь может конденсироваться с новой молекулой ацетил-СоА.
Схематически цикл Кребса представлен на рис. 2.
5.2.6.3 Дыхательная цепь переноса электронов. Окислительное фосфорилирование, биосинтез АТФ
Для непрерывной работы цикла Кребса необходимо постоянное поступление в систему ацетил-СоА, а восстановленные коферменты НАДН и ФАДН2 должны снова и снова окисляться. НАДН и ФАДН2 окисляются молекулярным кислородом не сразу и непрямо (в реакциях цикла Кребса молекулярный кислород нигде не участвует, хотя этот цикл является аэробным, т.е. кислородзависимым). Процесс идет постепенно с помощью последовательно функционирующих окислительно-восстановительных систем, переносящих водород, отнятый у субстрата в виде эквивалента электронов и протонов к молекулярному кислороду. Совокупность этих систем получила название дыхательной цепи переноса электронов.
Ферментные системы, составляющие дыхательную цепь переноса электронов, встроены во внутренней мембране митохондрий.
внешняя
мембрана
матрикс
кристы
внутренняя мембрана межмембранное
пространство
Рис.3 Строение митохондрии.
Митохондрии – это органеллы клетки (рис.3), играющие роль «силовых станций» клетки. Данная органелла является местом, где протекает цикл трикарбоновых кислот и окисление жирных кислот, генерирующие восстановленные коферменты, которые затем окисляются с помощью дыхательной электронтранспортной цепи.
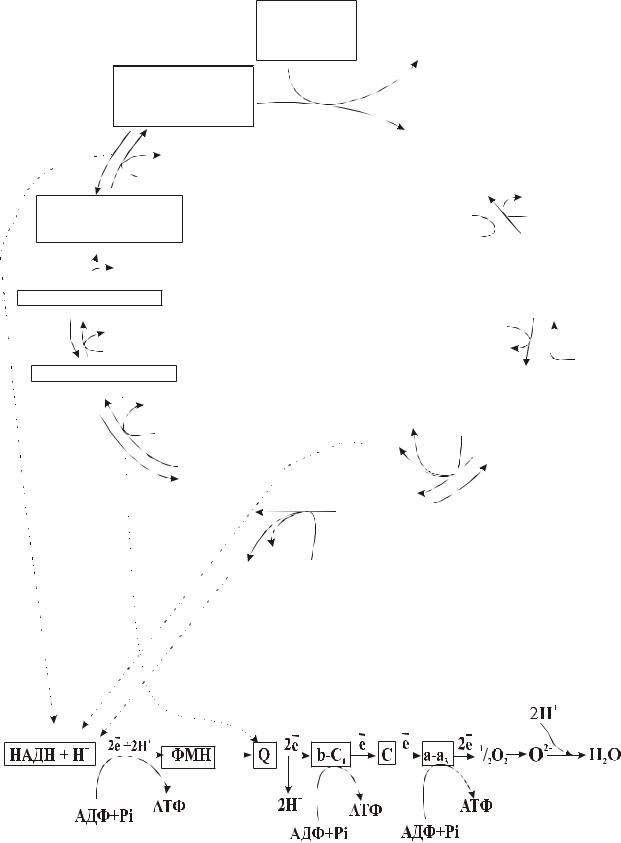
49
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
(ЦИКЛ КРЕБСА)




 НАДН2
НАДН2
НАД+
HOOC-CH-CH2-COOH
|
OH
яблочная к-та
 Н2О
Н2О
HOOC-CH=CH-COOH
фумаровая к-та
ФАДН2 ФАД
O
||
CH3-С~S-KOA
ацетил-KOA
HS-KOA
CH| 2-COOH
HO-C-COOH
|
CH2-COOH лимонная к-та
Н2О 

H2O
Н2О CH| 2-COOH
C-COOH
||
CH-COOH цис-аконитовая
к-та 
 Н2О
Н2О
HOOC-CH2-CH2-COOH янтарная к-та
ГТФ + HS-KOA |
|
|
|
ГДФ + Pi |
|
|
|
CH| 2-COOH |
|
||
CH| 2 |
|
|
|
О=C~S-KOA |
|
|
|
сукцинил-KOA |
|
|
|
Н |
|
|
CО2 |
|
|
|
|
А |
|
|
|
|
Д |
|
|
|
|
Н |
|
|
|
2 |
|
|
CH| 2-COOH |
|
CО2 НАД+ |
H-C-COOH |
|
| |
||
НАДН |
HO-C-COOH |
|
изолимонная к-та |
||
2 |
||
|
CH| 2-COOH CH2-C=O|
COOH a-кетоглутаровая к-та
НАД+ + + HS-KOA

 МИТОХОНДРИАЛЬНАЯ ДЫХАТЕЛЬНАЯ ЦЕПЬ
МИТОХОНДРИАЛЬНАЯ ДЫХАТЕЛЬНАЯ ЦЕПЬ
Рис. 2 Цикл Кребса
50
Митохондрия окружена двумя мембранами с сильно различающимися свойствами. Внутренняя мембрана митохондрии является барьером для протонов. Она способна пропускать такие молекулы как вода, молекулярный кислород, СО2, но фактически непроницаема для большинства полярных и ионизированных веществ (Na+, K+, НАД+, НАДН и т.д.). Наружная мембрана свободно проницаема для соединений с молекулярной массой около 10.000.
Компоненты дыхательной цепи распределены по плоскости внутренней мембраны равномерно. Они находятся в липидном окружении, прочно связаны с мембраной.
Также в митохондриальной мембране находится АТФ-синтетазный комплекс, ответственный за образованием АТФ.
Синтез АТФ из АДФ и фосфорной кислоты, который происходит с использованием энергии, освобождающейся при окислении веществ в живых клетках, и сопряжен с переносом электронов по дыхательной цепи, называется окислительным фосфорилированием.
Дыхательная цепь переноса электронов включает пять комплексов белков, в состав которых входят:
1.пиридинзависимые дегидрогеназы, коферментом которых является НАД+
АН2 + НАД+ |
|
НАДН + Н+ + А |
|
||
субстрат |
|
|
2.флавинзависимые дегидрогеназы, коферментом которых является ФАД или ФМН
НАДН + Н+ + ФМН  ФМН*Н2+ НАД+
ФМН*Н2+ НАД+
3. небелковый переносчик
Q (KoQ).
O |
|
Н3СО |
CH3 |
|
CH3 |
Н3СО |
СН2 CH C СН2 n н |
O |
|
убихинон |
|
(хинон) |
|
убихинон, который называют коферментом
OH
Н3СО |
CH3 |
|
|
|
|
|
+2Н(2 е, 2Н+) |
|
|
|
CH3 |
|
|
-2Н(2 е, 2Н+) |
|
|
|
|
|
|
СН |
|
CH |
C СН2 |
|
н |
|
Н СО |
2 |
n |
||||
3 |
|
|
|
|
||
|
OH |
|
|
|
|
|
|
убихинол |
|
|
|
|
|
|
(гидрохинон) |
|
|
|
|
|
4.Цитохромная система.
Цитохромы представляют собой гемопротеины, т.е. белки, содержащие
вкачестве простетической группы – гем. В составе гема имеется ион железа, который при переносе электронов подвергается обратимому окислени- ю-восстановлению.
2+ |
-1 e |
3+ |
|
Fe |
|
Fe |
|
|
|||
+1 e |
|||
|
|
51
Цитохромы относятся к одноэлектронным окислительно-восстанови- тельным соединениям. Они не могут принимать или отдавать водород, поэтому их называют переносчиками электронов.
Цитохромы подразделяются на цитохромы а, в, с и d в соответствии с положением их спектральных полос поглощения в восстановленном состоянии. Гемовые простетические группы цитохромов также имеют небольшие структурные различия; кроме того они отличаются структурой белка, с которым связан гем. Цитохромы а и а3 существуют и функционируют в виде единого прочного комплекса. Особенностью комплекса а×а3 является наличие в нем меди, связанной с компонентом а3, необходимой для его функционирования.
Перенос электронов комплексом а×а3 включает следующие реакции:
2+ |
-1 e |
3+ |
+ |
-1 e |
2+ |
|
Fe |
|
Fe |
Cu |
|
Cu |
|
|
|
|||||
|
+1 e |
|||||
+1 e |
||||||
|
|
|
|
Особенностью комплекса а×а3 является то, что эта система цитохромов непосредственно реагирует с молекулярным кислородом воздуха, т.е. электроны передаются на кислород, переводя его в ионы. Комплекс а×а3 называют цитохромоксидазой.
5.Железосерные белки, или негеминовые белки, т.е. белки, в составе которых железо не связано с гемом.
Компоненты дыхательной цепи расположены по мере возрастания окислительно-восстановительного потенциала. Окислительно-восстано- ви-тельной потенциал пары НАД/НАДН + Н+ = -0,32 В, а пары О2/Н2О = +0,82 В.
Последовательность реакций, протекающих в дыхательной цепи переноса электронов представлена в виде схемы (рис. 4).
|
НАД |
+ |
+ |
|
+ |
|
2 |
+ |
|
|
|
|
АН2 |
|
|
2Н , 2 |
е |
е, 2н |
е |
|
|
||||
|
НАДН+Н |
|
|
ФМНН |
СоQ |
|
|
|||||
|
|
|
|
|
|
|
|
2 |
|
2Н+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АДФ |
АТФ |
2Н+, 2 е |
|
|
|
|||
|
|
|
|
А Н |
ФАД ФАДН |
|
|
|
|
|||
|
|
|
|
1 |
2 |
|
2 |
|
|
|
|
|
е цит в |
|
е |
цит с1 |
е |
цит с |
цит a*a3 |
е |
О2 |
О2- Н2О |
|||
|
|
|||||||||||
|
|
|
АТФ |
|
|
|
|
|
|
|
4Н+ |
|
|
АДФ |
|
|
|
|
AДФ |
|
АТФ |
|
|||
О2 + 4е  2О2-
2О2-
4Н +2О2- 2Н2О
2Н2О
Рис. 4 Дыхательная цепь переноса электронов
52
Процесс начинается с переноса электронов и протонов от восстановленного субстрата АН2 к НАД+ (например: малат + НАД+ ® оксалоацетат + НАДН + Н+ (см. реакции цикла Кребса)).
Восстановленный НАДН + Н+ передает два электрона и два протона ФМН. От флавина электроны и протоны переходят к убихинону (CoQ). После убихинона пути электронов и протонов расходятся. Электроны в определенной последовательности передаются по цепи цитохромов и, наконец, через цитохромоксидазу (а×а3) достигают кислорода воздуха, переводя его в ион. При этом осуществляется одноэлектронный перенос по системе цитохромов. Существует также укороченная дыхательная цепь, когда субстрат А1Н2 взаимодействует с ФАД-дегидрогеназой (например: янтарная кислота + ФАД ® фумаровая кислота + ФАДН2 (см. реакции цикла Кребса)), которая восстанавливается до ФАДН2 и далее электроны и протоны идут на CoQ. Дальнейший путь электронов и протонов совпадают.
Протоны после убихинона выталкиваются в межмембранное пространство митохондрии за счет энергии, извлекаемой при движении электронов по дыхательной цепи.
В результате наружная сторона внутренней мембраны заряжается положительно, а матрикс митохондрии – отрицательно. Возникает электрохимический градиент концентраций ионов ΔМН+.
|
|
|
|
+ |
+ |
++ |
+ |
+ |
+ ++ |
|
||||
|
|
|
+ |
|
- |
|
- - |
- - |
+ |
|||||
|
+ + |
- |
|
- - |
|
+ |
||||||||
|
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
+ |
||
+ |
- |
- |
- |
- - |
|
- |
- |
- |
|
++ |
||||
++ |
|
- |
- - - |
- - - |
|
|
- |
+ |
||||||
+ |
|
|
- - |
-- |
|
|
|
+ ++++ |
|
|||||
+ |
|
|
- |
- - |
|
|
|
+ |
|
|
|
|
||
|
|
|
|
|
|
+ + |
|
|
|
|
|
|
||
|
|
|
|
|
|
+ |
Н |
|
|
|
|
|
|
|
Н+ |
|
Н+ |
Н |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
Диффузия протонов обратно через мембрану, т.е. в область с их меньшей концентрацией, происходит по концентрационному градиенту и сопряжена с фосфорилированием, осуществляемым АТФ-синтетазой.
Согласно хемиосмотической теории, разработанной П. Митчелом, энергия, сосредоточенная в протонном потенциале, используется АТФ-синте- тазой для выполнения химической работы, т.е. синтеза АТФ:
АДФ + Н3РО4 ® АТФ + НОН
Вданном случае синтез АТФ происходит одновременно за счет энергии, выделяемой по мере продвижения электронов по дыхательной цепи, т.е. одновременно с окислением водорода, снятого с субстрата до воды, синтезируется АТФ. Такой способ синтеза АТФ называется окислительным фосфорилированием.
Вдыхательной цепи в трех пунктах происходит сопряжение переноса электронов (окисления) и фосфорилирования. Первым этапом является перенос электронов от восстановленной анаэробной дегирогеназы НАДН + Н+ к
53
флавиновой дегидрогеназе ФМН. Второй точкой сопряжения является переход электронов от цитохрома в на цитохром с1. Третья молекула АТФ выделяется, когда цитохромоксидаза (а×а3) передает электроны кислороду воздуха. Таким образом, при окислении молекулы водорода, снятой с субстрата НАДзависимой дегидрогеназой, синтезируется 3 молекулы АТФ. Если водород передается ФАД-зависимой дегидрогеназой, то первая точка сопряжения минуется, поскольку от ФАДН2 электроны и протоны передаются коферменту Q, следовательно образуется только 2 молекулы АТФ.
5.2.6.4 Энергетика аэробного окисления глюкозы
Итак, полный путь окисления глюкозы включает гликолиз, окислительное декарбоксилирование ПВК, в результате чего образуется ацетил-СоА, окисление ацетил-СоА в цикле Кребса, передача водорода от НАДН + Н+ и ФАДН2 в виде эквивалента протонов и электронов по дыхательной цепи и окисление его до воды.
При этом образование АТФ происходит как за счет субстратного, так и за счет окислительного фосфорилирования. Поэтому для расчета энергетического выхода учтем, что в процессе гликолиза за счет субстратного фосфорилирования образуется 4 молекулы АТФ (реакции 7 и 10). Кроме того, в реакции 6 образуется 2НАДН + Н+, которые могут передавать электроны и протоны в дыхательную цепь, т.е. окисляться. Однако, сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Для передачи цитоплазматического НАДН в дыхательную цепь могут быть использованы так называемые челночные механизмы:
1.глицерол – фосфатный;
2.малат – аспартатный.
При использовании глицерол-фосфатного челночного механизма окисление 1 молекулы НАДН дает две молекулы АТФ, а при использовании ма- лат-аспартатного челночного механизма – 3 АТФ.
Значит, 2НАДН + Н (цитоплазматически перенесенные в митохондрию, например, с помощью малат-аспартатного челночного механизма) при окислении в дыхательной цепи дадут 6 АТФ, итого гликолиз дает 10 молекул АТФ, из которых вычтем 2, затраченные на активирование в реакциях 1 и 3, т.е. остается 8 молекул АТФ.
Т.к. при распаде глюкозы образуется 2 молекулы ПВК. Следовательно, в результате окислительного декарбоксилирования образуется 2НАДН + Н+, что эквивалентно 6АТФ.
В цикл Кребса от одной молекулы глюкозы также вступает 2 молекулы ацетил-СоА, следовательно, количество образовавшихся НАДН и ФАДН2 удвоим.
Итак, в реакциях 3, 4, 8 образуется 6 НАДН2 = 6×3 = 18 АТФ. В реакции 5 образуется 2ГТФ = 2 АТФ (за счет субстратного фосфорилирования), в реакции 6 – 2ФАДН2=2×2 = 4 АТФ. Итого: 8 + 6 + 18 + 2 + 4 = 38 молекул АТФ.
54
При использовании глицерол-фосфатного челночного механизма цитоплазматический НАДН образуется 2 АТФ, следовательно, общий энергетический выход будет равен 36 молекул АТФ, а не 38.
5.3 Токсичность кислорода.
Известно, что кислород токсичен для живых организмов. Например, некоторые из строгих анаэробов погибают в кислородсодержащей атмосфере. Токсичность кислорода для организмов ставит два вопроса:
1)почему он токсичен?
2)почему аэробы способны выжить в атмосфере, содержащей это ток-
сичное вещество?
На эти вопросы логично ответить следующим образом. В невозбужденном состоянии кислород нетоксичен.Однако его электронная структура, содержащая два неспаренных электрона
2s2 2p4
накладывает ограничения на то, каким образом кислород способен выступать в роли акцептора электронов.
Реакция восстановления О2 в 2О-2 : О2 + 4е + 4Н + → 2Н2О идет не одномоментно, а имеют место четыре одноэлектронных перехода:
О2 + 1е → О2− ∙
О2 + 1е + 2Н + → Н2О2 Н2О2 + 1е + Н + → НО∙ + Н2О
НО∙ + 1е + Н + → Н2О
Суммарно О2 + 4е + 4Н + → 2Н2О
Промежуточные продукты восстановления: О2∙ − – супероксиданион, Н 2О2 –
пероксид водорода, НО∙ – гидроксильный радикал представляют собой сильные окислители.
Гидроксильный радикал может образоваться и в ходе следующей реак-
ции:
Н2О2 + О2− ∙ → О2 + ОН − ∙ + ОН
Небольшие количества токсичных форм кислорода, О2− ∙ , Н2О2 и НО∙
образуются как продукты окислительного метаболизма в клетках, а также на заключительном этапе передачи электронов на кислород (в дыхательной цепи) осуществляемой цитохромоксидазой.
Активные формы кислорода весьма токсичны для клеток, т.е. они повреждают многие клеточные структуры. Кислородные радикалы и пероксиды способны разрушать белки, липиды и нуклеиновые кислоты. Основными мишенями свободных радикалов являются ненасыщенные связи в липидах мем-
55
бран. Полиненасыщенные жирные кислоты, входящие в состав мембран, – это основные субстраты процессов пероксидного окисления липидов (ПОЛ). Первичными продуктами ПОЛ являются диеновые коньюгаты:
–СН2–СН2–СН=СН–СН=СН–СН2– Образование этих продуктов ведет к увеличению полярности хвостов
жирных кислот, что в свою очередь ведет к их вытеснению из толщи мембраны на поверхность. В определенной степени эти процессы способствуют самообновлению клеточных мембранных структур, а также оказывают существенное воздействие на проницаемость мембран. Однако чрезмерное образование активных форм кислорода ведет к значительным нарушениям структуры и функцию липидов, белков, нуклеиновых кислот, что в конечном итоге приводит к гибели клетки.
Активные формы кислорода окисляют группы –SH– полипептидных цепей белков, приводят к инактивации белков. Окислительное повреждение ДНК может индуцировать мутацию.
У млекопитающих повреждение сердца при сердечном приступе связано с усилением образования свободных радикалов в месте повреждения ткани. Предполагается, что разрушение молекул под действием токсичных форм кислорода может быть также важнейшим неспецифическим фактором в патогенезе широкого круга заболеваний, включая артриты, эмфизему, некоторые виды рака и даже процесс старения.
Частичная детоксикация Н2О2 и О2− ∙ происходит при участии природ-
ных антиоксидантов, например аскорбиновой кислоты, витамина Е и глу-та- тиона. Н2О2 обезвреживается также под действием ферментов – каталазы и пероксидазы:
2Н2О2 каталаза О2 + 2Н2О
Н2О2 + ДН2 пероксидазаД + 2Н2О
(где ДН2 – восстановленное органическое соединение, выступающее в качестве донора водорода)
Супероксиданион радикал кислорода О2− ∙ обезвреживается ферментом супероксиддисмутазой:
О2- + О2- + 2Н+ супероксид Н2О2 + О2 дисмутаза
Образующаяся Н2О2 разлагается антиоксидантами, каталазой и пероксидазой. Супероксиддисмутаза обнаружена во всех аэробных организмах от токсичного действия кислорода. У анаэробов этот фермент отсутствует.
В эукариотических клетках фермент глутатионпероксидаза более эффективно осуществляет детоксикацию Н2О2, чем каталаза. В качестве кофактора этот фермент содержит восстановленный глутатион, а также в активном центре фермента содержится аминокислота селеноцистеин. Цинк, медь и марганец являются необходимыми компонентами для активности изофермен-

56
тов супероксиддисмутазы. Таким образом мы видим, что микроэлементы играют также важную роль в детоксикации активных форм кислорода.
5.4 Пентозофосфатный путь окисления углеводов
Помимо катаболизма углеводов по пути гликолиза существует другой, альтернативный путь, получивший название гексозомонофосфатного или пентозофосфатного пути.
Расхождение путей окисления начинается со стадии образования глю- козо-6-фосфата.
Если глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат, который фосфорилируется второй раз и превращается во фруктозо-1,6-дифосфат, то в этом случае дальнейший распада углеводов происходит по обычному гликолитическому пути. Если второго фосфорилирования фруктозы-6-фосфат не происходит, то фосфорилированная глюкоза может подвергаться прямому – окислению до фосфопентоз.
В норме доля пентозофосфатного пути в количественном превращении глюкозы обычно невелика, варьирует у разных организмов и зависит от типа ткани, ее функционального состояния.
Значение этого пути в обмене веществ велико. Этот путь выполняет 3 основные функции:
1)поставляет НАДФН, который используется в биосинтезе жирных кислот, холестерина и т.д.;
2)является источником рибозо-5-фосфата, необходимого для синтеза нуклеиновых кислот;
3)генерирует эритрозо-4-фосфат, который используется для синтеза ароматических аминокислот: фенилаланина, тирозина, триптофана.
Реакции пентозофосфатного цикла протекают в цитоплазме клетки и состоят из окислительной и неокислительной стадий.
Первая окислительная реакция – дегидрирование глюкозо-6-фосфата:
|
|
|
|
СН2О |
|
РО3Н2 |
|
|
|
|
|
СН2 О РО3Н2 |
|||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H |
|
|
|
|
O H |
|
|
|
H |
|
|
|
O |
|
|||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
H |
|
+ НАДФ+ |
глюкозо-6-фосфат |
|
|
OHH |
|
|
|
O + НАДФН + Н+ |
||||||
|
|
OH |
|
H |
|
|
|
|
H |
||||||||||
|
|
|
|
дегидрогеназа |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
OH |
|
|
|
HO |
|
|
|
|
|
||||
|
H |
|
OH |
|
|
|
|
H |
|
OH |
|
||||||||
|
глюкозо-6-фосфат |
|
|
6-фосфоглюконолактон |
|
||||||||||||||
6-Фосфоглюконолактон – соединение неустойчивое и с большой скоростью гидролизуется:

57
|
|
СН2ОРО3Н2 |
|
|
|
|
|
|
СООН |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||
|
|
|
|
|
|
|
HC |
|
|
|
|
|||||||||
|
|
H |
H |
O |
+ НОН |
6-фосфоглюконо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
OH |
лактоназа |
HO |
|
C |
|
|
|
H |
||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
OH |
|
|
|
|
|
|
H |
|
|
C |
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
H |
|
|
|
C |
|
OH |
|||||||||||
6-фосфоглюконо- |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
лактон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
H2C |
|
|
|
|
O РО3Н2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
6-фосфоглюконовая кислота
Во второй окислительной реакции 6-фосфоглюконовая дегидрируется и декарбоксилируется:
|
|
|
|
СООН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН2ОН |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
|
OH |
|
|
|
|
6-фосфоглюконат- |
+ |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
HC |
|
|
|
|
|
OH |
|
|
|
|
|
+ |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
HO |
|
C |
|
|
|
H |
+ |
НАДФ |
|
|
дегидрогеназа |
|
|
|
|
|
|
|
|
|
НАДФ + Н |
+ СО2 |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
C |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O РО3Н2 |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
|
|
|
|
|
|
|
||||||
H |
|
|
C |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H2C |
|
|
|
|
O |
|
РО3Н2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рибулозо-5-фосфат |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
6-фосфоглюконовая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
Рибулозо-5-фосфат может изомеризоваться с образованием ксилулозо- |
||||||||||||||||||||||||||||||||||||||||
5-фосфат или рибозо-5-фосфат: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
C |
H |
|
|
|
|
СН2ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
СН2ОН |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
O |
|
||||||
HC |
|
|
|
|
|
OH |
изомераза |
|
|
|
эпимераза |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
OH |
|
|
|
|
|
HC |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
||||||||||
HC |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
HC |
|
|
OH |
|
|
C |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
OH |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
СН2ОРО3Н2 |
|
|
|
|
СН2 |
|
|
|
O |
|
РО3Н2 |
|
|
|
|
|
|
|
СН2О |
|
РО3Н2 |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
рибозо-5-фосфат |
|
|
рибулозо-5-фосфат |
|
|
|
|
|
|
|
ксилулозо-5-фосфат |
|||||||||||||||||||||||||||||||||||
При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает неокислительный этап пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях.
Шесть молекул глюкозо-6-фосфата, вступая в пентозофосфатный цикл, образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2, после чего из 6 молекул рибулозо-5-фосфата снова регенерируется 5 молекул глюкозо-6-фос- фата. Образовавшийся НАДФН используется в цитозоле на восстановительные синтезы и, как правило, не участвует в окислительном фосфорилировании, протекающем в митохондриях.
6глюкозо − 6фосфат + 12НАДФ+ → 6СО2 + 12НАДФН + Н + + 5глюкозо − 6фосфат
5.5 Включение других углеводов в процесс гликолиза
58
Кроме глюкозы окислению могут подвергаться и другие моносахариды, которые образуются при гидролизе дисахаридов и полисарахаридов, например: фруктоза – при гидролизе сахарозы и т.д. При этом они превращаются тем или иным путем в глюкозу или фруктозу-6- фосфат.
5.5.1Фруктоза
Фруктоза включаясь в гликолиз, подвергается фосфорилированию при участии фермента гексокиназы и АТФ:
АТФ АДФ
фруктоза гексокиназа  фруктозо-6-фосфат
фруктозо-6-фосфат
Эта реакция ингибируется глюкозой, образовавшийся фруктозо-6- фосфат превращается во фруктозо-1,6-бисфосфат (см. реакции гликолиза), что в итоге приводит к образованию ПВК. Таков главный путь включения фруктозы в метаболизм в мышечной ткани, почках. Однако, в печени существует другой путь включения фруктозы в гликолиз.
В ней имеется фермент фруктокиназа, который катализирует фосфорилирование фруктозы не по шестому, а по-первому атому углерода:
СН2ОН СН2ОН |
|
СН2ОН СН2ОРО3Н2 |
||
O |
|
АТФ АДФ |
|
O |
H ОН |
|
|
H ОН |
|
|
|
|
||
OH |
ОН |
фрукто- |
H |
ОН |
киназа |
||||
OH Н |
|
|
|
OH Н |
|
|
|
фруктозо-1-фосфат |
|
Эта реакция не блокируется глюкозой. Образовавшийся фруктозо-1- фосфат расщепляется под действием альдолазы на диоксиацетонфосфат и Д- глицеральдегид:
СН2ОН |
|
|
|
СН ОН |
|
|
|
Н |
||
СН2ОРО3Н2 |
|
|
С=О |
|||||||
|
|
O |
2 |
|
+ |
|||||
|
|
|
|
альдолаза |
С=О |
|
|
СН-ОН |
||
|
H ОН |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
ОН |
|
|
|
|
|
||
|
|
|
|
|
|
СН ОРО Н |
2 |
|
СН2-ОН |
|
|
OH Н |
|
|
|
||||||
|
|
|
|
2 |
3 |
глицер- |
||||
|
|
|
|
|
|
диоксиацетон- |
|
|||
|
|
|
|
|
|
|
альдегид |
|||
|
|
|
|
|
|
фосфат |
|
|
||
Образовавшийся глицеральдегид под влиянием соответствующей киназы подвергается фосфорилированию и включается в гликолиз:
O |
|
|
O |
C |
H |
АТФ АДФ |
C |
|
|
|
H |
CH |
OH |
киназа |
HC OH |
|
|
СН2-О-РО3Н2 |
|
CH2 |
OH |
|
|
|
глицеральдегид-3- |
||
|
|
|
фосфат |
59
Схематически данный процесс можно представить таким образом (ферменты см. в тексте):
АТФ |
|
АТФ |
|
|
|
АДФ |
Фруктоза |
АДФ |
фруктозо-1- Р |
|
фруктозо-6- Р |
АТФ
глицераль- |
|
АДФ |
дегид |
дигидрокси- |
|
|
фруктозо-1,6- Р |
|
|
ацетонфосфат |
|
АТФ
глицеральде- гид-3-фосфат
АДФ
по пути гликолиза
5.5.2 Галактоза
Обмен галактозы начинается с превращения ее в галактозо-1-фосфат. Эта реакция катализируется галактокиназой:
АТФ АДФ
Галактоза галакто-  галактозо-1-фосфат киназа
галактозо-1-фосфат киназа
Далее галактозо-1-фосфат в присутствии УДФ-глюкозы и фермента трансферазы превращается в УДФ-галактозу, одновременно образуется глю- коза-1-фосфат:
|
|
|
СН2ОН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сн2он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
о н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
ОН |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
О |
|
|
|
+ |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
H |
H |
|
|
|
|
|
|
|
|
н |
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
OH |
|
|
|
P |
|
ОН |
|
|
он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН2 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
о Р |
|
|
|
O |
|
|
P |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
H |
|
|
OH |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
галактозо-1- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
фосфат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
УДФ-глюкоза |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сн2он |
|
|
|
|
|
|
|
|
|
|
|
|
|
сн2он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
н |
|
|
|
|
|
о н |
|
|
|
|
|
ОН |
|
о н |
|
|
O |
|
|
O |
н |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
н |
|
н |
о |
он+ |
|
н |
н |
|
|
|
|
|
|
он |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
он |
|
о |
|
р |
|
|
|
|
|
он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р |
O |
P |
O |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
о |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
он |
|
|
|
|
|
|
|
|
|
|
|
он |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
он |
|
|
|
|
|
|
|
|
|
OH |
|
|
OH |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
глюкозо-1-фосфат УДФ-галактоза
O
HN
транс-
O N фераза
н |
O |
|
H
он HN СН2
СН2
O N
N
O
н н
н H он он
H он он
Глюкозо-1-фосфат переходит в глюкозо-6-фосфат и далее участвует в гликолизе или под влиянием фосфатазы образует свободную глюкозу.

60
УДФ-галактоза под действием эпимеразы превращается в УДФ-глюко-
зу:
УДФ-галактоза эпимераза УДФ-глюкоза
УДФ-глюкоза взаимодействуя с пирофосфатом образует глюкозо-1- фосфат:
пирофос- УДФ-глюкоза + Н4Р2О7  форилаза
форилаза УТФ + глюкозо-1-фосфат
УТФ + глюкозо-1-фосфат
Глюкозо-1-фосфат следует по пути превращений описанных выше. Схематически этот процесс можно представить (ферменты см. в
тексте):
Галактоза
АТФ

 АДФ Галактозо-1-фосфат
АДФ Галактозо-1-фосфат
УДФ-глюкоза
Глюкоза-1-фосфат УДФ-галактоза
УДФ-галактоза
УДФ-глюкоза H4P2O7

 УТФ Глюкозо-1-фосфат
УТФ Глюкозо-1-фосфат
5.6 Биосинтез
5.6.1 Глюконеогенез
Глюкоза может не только окисляться в клетках, но и синтезироваться из различных продуктов метаболизма. Такими продуктами в первую очередь являются молочная и пировиноградная кислоты, так называемые гликогенные аминокислоты, глицерол и др. соединения, иначе говоря, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот. Таким образом, ГЛЮКО- НЕОГЕНЕЗ-это синтез глюкозы из неуглеводных продуктов.
Большинство стадий глюконеогенеза представляет собой обращение реакций гликолиза. Только 3 реакции гликолиза необратимы, поэтому на 3-х этапах используются другие ферменты.
Рассмотрим синтез глюкозы из пировиноградной кислоты.
Реакция превращения ПВК в фосфоенолпировиноградная кислоту необратима, поэтому ФЕП получается обходным путем. Первый этап протекает в митохондриях:

61
|
СН3 |
СООН |
|
|
|||||||
|
|
|
О |
+ АДФ |
+ Н3РО4 |
||||||
С О +СО2+АТФ пируват- |
С |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карбоксилаза |
CH2 |
|
|
||||||||
COOH |
|
|
|
|
|
||||||
ПВК |
COOH |
|
|
||||||||
|
|
|
|
|
оксалоацетат |
|
|||||
Коферментом пируваткарбоксилазы является биотин (витамин Н). Оксалоацетат не может пройти через мембрану митохондрий, поэтому-
восстанавливается в митохондриях до яблочной кислоты под действием митохондриальной малатдегидрогеназы:
СООН COOH
С |
|
О + НАДН |
+ Н+ |
малатде- |
СНОН + НАД+ |
|
|
||||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
CH2 |
|
гидрогеназа |
CH2 |
|||
COOH |
|
|
COOH |
|||
оксалоацетат |
|
|
||||
|
ЯБЛОЧНАЯ КИСЛОТА |
|||||
|
|
|
|
|||
Малат легко выходит из митохондрии в цитоплазму. Здесь он вновь окисляется при помощи цитоплазматической малатдегидрогеназы:
СООН COOH
СНОН + НАД+ |
малатде- |
C |
|
О + НАДН + Н+ |
||
|
||||||
|
||||||
|
||||||
гидрогеназа |
||||||
|
CH2 |
CH2 |
||||
|
COOH |
|
||||
|
|
COOH |
||||
ЯБЛОЧНАЯ |
|
|||||
кислота |
оксалоацетат |
|||||
Путем декарбоксилирования и фосфорилирования оксалоацетат превращается в фосфоенолпировиноградную кислоту:
СООН |
фосфоенол- |
СН2 |
||||
С |
|
О + ГТФ |
пируват |
|
|
|
|
|
СОРО3Н2 + ГДФ + СО2 |
||||
|
|
|||||
|
|
|
||||
|
|
карбоксики- |
||||
CH2 |
наза |
COOH |
||||
|
|
|
|
|||
COOH |
|
фосфоенолпировино- |
||||
оксалоацетат |
|
градная кислота |
||||
Далее идут обратимые реакции гликолиза, вплоть до превращения фруктозо-1,6-бисфосфат во фруктозо-6-фосфат. Это вторая необратимая реакция, катализируемая ферментом фосфатазой:
|
СН2ОРО3Н2 |
|
СН2ОРО3Н2 |
СН2ОРО3Н2 |
СН2ОН |
||||||
|
|
||||||||||
|
|
O |
|
||||||||
|
|
|
+ НОН |
фосфатаза |
|
O |
|
|
|||
|
|
H |
HO |
|
|
H |
HO |
|
+ H3PO4 |
||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
OH |
H |
|
OH |
H |
OH |
H |
OH |
|||
|
|
|
|
|
|
|
|
||||
фруктозо-1,6-бисфосфат |
фруктозо-6-фосфат |

62
Фруктозо-6-фосфат обратимо превращается в глюкозо-6-фосфат, а далее следует третья необратимая реакция:
|
|
СН |
-О-РО |
Н |
|
|
|
|
|
|
CH2OH |
|
|||||||||
|
|
|
|
2 |
3 |
|
2 |
|
H |
|
|
|
|
|
O H |
|
|||||
H |
|
|
|
|
O H |
|
+ НОН |
фосфатаза |
|
H |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
OH |
H |
|
+ H3PO4 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
OH |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
OH |
||||||
HO |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
OH |
|
||||
H |
OH |
|
|
|
|
|
|
||||||||||||||
глюкозо-6-фосфат |
|
|
|
|
|
глюкоза |
|
||||||||||||||
5.6.2 Фотосинтез
В растительных клетках глюкоза синтезируется за счет фотосинтеза. Фотосинтез – это синтез углеводов и других органических соединений
из неорганических – СО2 и Н2О – под действием энергии солнечного света. Различают две части фотосинтеза – световой и темновой процессы. Световой процесс включает поглощение света, разложение воды на во-
дород и кислород (фотоокисление),восстановление НАДФ+, фосфорилирование АДФ:
12Н2О + 12НАДФ+ ¾ ¾hv ® 6О2 + 12(НАДФН + Н + )
18(АДФ + Н3 РО4 ) ¾¾hv ® 18(АТФ + Н 2 О)
Темновой процесс фотосинтеза – это восстановление диоксида углерода за счет водорода НАДФН и энергии АТФ.
6СО2 + 12(НАДФН + Н + ) → С6 Н12О6 + 6Н 2О + 12НАДФ+
18(АТФ + Н 2 О) → 18(АДФ + Н 3 РО4 )
Суммарный результат светового и темнового процессов:
6СО2 + 6Н2О ¾¾hv ® C6 Н12О6 + 6О2
Выделяемый растениями кислород образуется из воды при ее разложении в световом процессе.
Механизм светового процесса
Свет поглощается хлорофиллом, связанным с белками. Хлорофилл-это производное порфирина, содержащее магний.
Поглощающие свет хлорофилл-белковые комплексы находятся в тилакоидах – мембранных структурах хлоропластов.
При поглощение света хлорофилл переходит в высокоэнергетическое, возбужденное состояние.
В этом состоянии он становится донором высокоэнергетического электрона. Электрон акцептируется электронпереносящей цепью мембраны тилакоидов, а молекула хлорофилла превращается в свободный радикал:
nАТФ
хлорофилл* 4е
4е
hv |
хлорофилло |
хлорофилл  4е
4е


 4е
4е
2(НАДФН+Н+)
4Н+
 О2
О2
2Н2О
63
Этот же комплекс хлорофилла с белком осуществляет фоторазложение
воды:
2Н2О → О2 + 4Н + + 4е
Электроны, образующиеся при восстановлении воды акцептируются радикалами хлорофилла, который возвращается в исходное, невозбужденное состояние.
Электронпереносящая цепь тилакоидных мембран содержит переносчики электронов,которые по механизму действия сходны с переносчиками митохондриальной электронпереносящей цепи. Как и в митохондриях перенос электронов сопровождается синтезом АТФ. Конечным акцептором электронов в тилакоидной мембране служит НАДФ+, который восстанавливается в НАДФН. Акцептором электронов с электропереносящей цепи может быть и радикал хлорофилла. В этом случае АТФ синтезируется, а фотолиз воды и восстановление НАДФ не происходят. С другой стороны возможны фотолиз воды и восстановление НАДФ без синтеза АТФ в электронпереносящей цепи.
Реакции темнового процесса.
Реакция фиксации СО2 катализируется рибозо-1,5-бисфосфаткарбокси-
лазой
|
|
|
|
СН2ОРО3Н2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
С |
|
O |
|
СН2ОРО3Н2 |
COOH |
|||||||||
|
|
|||||||||||||||
|
|
|||||||||||||||
H |
|
|
|
|
|
|
|
OH + СО2 + Н2О |
||||||||
|
C |
|
|
|
|
CH2 |
|
ОН + HC |
|
OH |
||||||
|
|
|
||||||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
C |
|
|
OH |
|
|
COOH |
СН2ОРО3Н2 |
||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
СН2ОРО3Н2 |
|
|
|||||||||
|
|
|
|
|
|
3-фосфоглицерино- |
||||||||||
рибулозо-1,5-бисфосфат |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
вая кислота |
|
|
|
|||
В результате получается две молекулы 3-фосфоглицериновой кислоты. Для синтеза одной молекулы глюкозы необходима фиксация шести молекул
СО2.
Далее 3-фосфоглицерат в реакциях, идентичных тем, которые происходят при глюконеогенезе, превращается во фруктозо-6-фосфат:
6 СО2 6 рибулозо-1,5-бисфосфат 12 1,3-бисфосфоглицериновая кислота
12 1,3-бисфосфоглицериновая кислота
6 АДФ |
|
6 АТФ |
(5 молекул) |
|
|
Рибулозо-5-фосфат |
... |
|
 12 АТФ
12 АТФ
...
 12 НАДФН+Н+
12 НАДФН+Н+
6 фруктозо-6-фосфат
(1 молекула) 1 глюкозо-6-фосфат
Одна из шести молекул фруктозо-6-фосфата составляет чистый выход и может превратиться в глюкозо-6-фосфат. Пять других молекул фруктозо-6- фосфата необходимы для возобновления цикла: они превращаются в шесть молекул рибулозо-5-фосфата по пути неокислительного образования пентоз. Наконец, рибулозо-5-фосфат при участии соответствующей киназы образует рибулозо-1,5-бисфосфат и цикл повторяется.
64
Следует отметить, что главными нефосфорилированными углеводами, образующимися при фотосинтезе, у большинства растений являются сахароза и крахмал, а не глюкоза.
5.6.3 Биосинтез сахарозы
При синтезе сахарозы донором глюкозы является уридиндифосфатглюкоза (УДФ-глюкоза). Катализирует реакцию сахарозосинтаза:
УДФ-глюкоза + фруктоза |
сахарозо- |
сахароза + УДФ |
|
||
синтаза |
5.6.4 Биосинтез гликогена и крахмала
Гликоген – это форма запасания углеводов у животных и человека, а крахмал – в клетках растений.
Биосинтез полисахаридов осуществляется путем последовательных реакций трансгликозирования.В реакциях участвует большое число моле- кул-доноров и молекула акцептора, называемая «затравкой».Донорами биосинтеза служат НДФ-сахара (нуклеозиддифосфатсахара),а затравкой - низкомолекулярный фрагмент синтезируемого полисахарида (п≥4).
Прежде всего глюкоза фосфорилируется при участии фермента гексокиназы:
|
|
|
CH2OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OPO3H2 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
O H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O H |
|
|||||||
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
гексокиназа |
|
|
|
H |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
OH H |
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
АТФ |
|
|
|
OH |
|
H |
|
+ АДФ |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
HO |
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
OH |
|||||||||||
|
H |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
OH |
|
||||||||||||||||||
|
глюкоза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глюкозо-6-фосфат |
|
|||||||||||||
Глюкозо-6-фосфат превращается в глюкозо-1-фосфат: |
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
CH2OPO3H2 |
|
|
|
|
|
|
|
CH2OH |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O H |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||||||||||||||||
|
|
|
|
H |
|
|
фосфоглюко- |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
H |
|
|
|
||||||||||||||
|
|
|
|
|
OH |
H |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
мутаза |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
|
ОРО3Н2 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
HO |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
OH |
|
||||||||||
|
|
|
|
|
|
H |
|
|
|
OH |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
глюкозо-1-фосфат |
|
|||||||||||||||||||
|
|
|
глюкозо-6-фосфат |
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена:
65
транс- ГЛЮКОЗО-1-ФОСФАТ + УТФ  фераза
фераза 

 УДФ-глюкоза + Н4Р2О7
УДФ-глюкоза + Н4Р2О7
УДФ-глюкоза:
|
|
сн2он |
н |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||
Н |
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
н |
н |
|
|
O |
|
|
O |
|
HN |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
он |
|
|
о |
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
СН2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
Р |
|
|
P |
|
|
|
|
|
|
|||||||||||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
он |
|
|
|
|
||||||||||||||||||||
|
н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
N |
||||
|
|
|
|
|
OH |
|
|
OH |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
O
н н
н  H
H
он
В биосинтезе крахмала может участвовать АДФ-глюкоза. На второй стадии происходит перенос глюкозного остатка, входящего в состав УД- Ф-глюкозы на гликозидную цепь гликогена («затравка»). При этом образуется α-(1→4)-связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозной цепи.
Эта реакция катализируется ферментом гликогенсинтазой (в крахмалекрахмалсинтазой).
|
СН2ОН |
|
|
|
|
|
|
|
|
H |
H |
O Н |
|
|
|
|
|
|
|
|
H |
O |
O |
Н |
|
|
|
|
|
HO OH |
|
О P O |
P О |
-уридин + |
O |
O |
O |
О R |
|
H |
|
OH |
OH |
OH |
о |
о |
|
||
|
ОН |
|
|
||||||
УДФ-глюкоза |
|
|
|
|
гликоген (n-остатков) |
|
|
||
|
O |
|
O |
|
O |
O |
|
||
гликоген- |
|
|
|
+ УДФ |
|||||
|
|
|
|
|
|
|
|||
синтаза |
|
|
|
О |
|
О |
О |
|
|
|
|
|
|
|
О R |
||||
|
|
|
|
гликоген (n+1 остатков) |
|
|
|
||
Установлено, что гликогенсинтаза (крахмалсинтаза) неспособна катализировать образование α-(1→6) гликозидной связи, имеющейся в точках ветвления. Этот процесс катализирует специальный «ветвящий» фермен- т-гликозил (1→6)-трансфераза. Этот фермент катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксильную группу остатка глюкозы той же или другой цепи гликогена (крахмала).
Схематически этот процесс можно представить:
|
|
гликозил |
1,4-гликозидная |
цепь |
(1 6)трансфераза |
(амилоза) |
|
|
гликоген (амилопектин)
5.7 Расщепление крахмала и гликогена
66
Ведущая роль в расщеплении гликогена в клетках принадлежит фосфорилазам. Фосфорилазы переводят гликоген из запасной формы в метаболически активную. В присутствии фосфорилазы гликоген распадается с образованием фосфорного эфира глюкозы без предварительного расщепления на более крупные обломки:
|
СН2ОН |
|
|
|
|
|
СН2ОНO |
|
|
СН2ОН |
|
|
|||
|
|
|
|
|
H |
H |
H H |
O |
H |
|
|||||
|
H H |
O |
H |
|
+ Н3РО4 |
фосфори- |
H |
|
|
|
|||||
|
|
|
|
H О + |
|
|
H |
|
|
||||||
О |
ОН |
H |
|
О |
лаза |
О ОН |
OH |
О |
РО3Н2 |
||||||
H |
ОН |
|
n |
|
|
H |
ОН |
n-1 |
ОН |
H |
ОН |
||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
гликоген |
|
|
|
|
укороченная цепь |
глюкозо-1-фосфат |
|
|||||||
|
|
|
|
|
гликогена на 1 звено |
|
|
|
|
|
|||||
Глюкозо-1-фосфат может превращаться в глюкозо-6-фосфат и включаться в гликолиз. В растительных тканях крахмал под действием нескольких ферментов класса гидролаз (α,β-амилазы,олиго-1,6-глюкозидаза), а также крахмалфосфорилазы может расщепляться до составляющих его моносахаридов (см. раздел: Ферментативный гидролиз крахмала.).
Список литературы
Биологическая химия

67
Конспект лекций для студентов специальностей
49 01 01, 49 01 02, 91 01 01
Углеводы. Обмен углеводов
Составители |
доцент Макасеева О. Н. |
|
ст. преподаватель Дудинская О. В. |
Оформление графического материала
Редактор |
Бажанова Т. Л. |
Технический редактор |
Щербакова А. А. |
|
|
Подписано в печать__________ |
Формат 60×84 1/16 |
Печать офсетная. Усл. печ. л. _________ |
Уч.-изд. л._______ |
Тираж _200_экз. Заказ ________- |
Бесплатно |
ЛП № 226 от 12.02.2003г. |
|
ЛИ № 604 от 03.06.2003г. |
|
|
|
Отпечатано на ризографе УО МГУП |
|
212027, Могилев, пр-т Шмидта, 3 |
|
