
uglevodorody_mu_miroshnichenko
.pdf
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА «ОРГАНИЧЕСКАЯ ХИМИЯ»
А. В. Мирошниченко
УГЛЕВОДОРОДЫ
Методические указания к лабораторным работам по Органической химии
для студентов направления 240100 «Химическая технология и биотехнология»
Волгоград
2011
УДК 547(075)
Рецензент
канд. хим. наук доцент кафедры «Органическая химия» О. Н. Кутыга
Печатается по решению редакционно-издательского совета Волгоградского государственного технического университета
Углеводороды : метод. указания / сост. А. В. Мирошниченко. – Волгоград : ИУНЛ ВолгГТУ, 2011. – 12 с.
Методические указания к лабораторному практикуму предназначены для студентов направления 240100 «Химическая технология и биотехнология». В методических указаниях содержатся методики лабораторных способов получения отдельных классов углеводородов – предельных, этиленовых, ацетиленовых и ароматических, а также приведены примеры выполнения качественных реакций и некоторых специфических свойств этих соединений.
Волгоградский государственный технический университет, 2011
2
ВВЕДЕНИЕ
Лабораторная работа по теме «Углеводороды» выполняется студентами после того как будет прочитан раздел курса по всем классам углеводородов.
Цель работы – на ряде качественных пробирочных реакций познакомить студентов с простейшими лабораторными способами получения и некоторыми специфическими свойствами отдельных классов углеводородов – предельных, этиленовых, ацетиленовых и ароматических.
Перед выполнением работы студенты должны познакомиться с основными теоретическими вопросами по этим темам, проработав соответствующий материал лекций или главы рекомендованного учебного пособия. Это необходимо для того, чтобы выполнять работу осмысленно, с полным пониманием наблюдаемых явлений и причинной зависимости между ними.
Выполняя пробирочные реакции, необходимо соблюдать некоторые правила техники безопасности.
1)Наиболее часто наблюдается выбрасывание жидкости из пробирки при нагревании ее на открытом пламени микрогорелки. В связи с этим, нагревая пробирку, надо отверстие ее направлять в сторону от себя и от соседа. Особенно надо остерегаться, чтобы брызги жидкости не попали в глаза. Выбрасывание жидкости при нагревании происходит вследствие частичного перегрева ее. Поэтому, нагревая пробирку, надо все время непрерывно поворачивать ее или осторожно встряхивать ее содержимое. Кроме того, надо следить, чтобы пробирка находилась не в вертикальном,
апо возможности в наклонном положении. При наклонном положении и осторожном нагревании брызги ударяются о стенки пробирки и не вылетают наружу.
Иногда выбрасывание жидкости может произойти при вспенивании реакционной массы вследствие чрезмерного нагревания. В этих случаях надо уменьшить нагревание и поддерживать его на таком уровне, чтобы выделение газа не было слишком бурным. При замедлении реакции следует осторожно усилить нагрев, все время следя за ходом реакции.
2)При работе с газоотводной трубкой нужно помнить, что убирать горелку из-под пробирки с реакционной смесью можно только после того, как нижний конец газоотводной трубки удален из жидкости. Если убрать горелку, когда нижний конец газоотводной трубки погружен в жидкость, то при охлаждении пробирки с реакционной смесью произойдет уменьшение давления и жидкость по газоотводной трубке поднимется вверх, а затем попадет в пробирку. В лучшем случае при этом опыт будет испорчен, иногда же дело может окончиться разрывом нагретой пробирки, разбрызгиванием реакционной смеси, а нередко ожогами лица и рук работающего. Вот почему работа с газоотводной трубкой требует
3
внимательного отношения. Заметив, что жидкость в газоотводной трубке начинает подниматься, надо немедленно опустить вниз пробирку, чтобы уровень жидкости в ней стал ниже конца газоотводной трубки и одновременно продолжать нагревание пробирки с реакционной смесью. Когда выделение газа возобновится, и жидкость будет вытолкнута из газоотводной трубки, ее следует снова погрузить в реакционную смесь.
Остальные правила техники безопасности общие для лаборатории органической химии.
Реактивы и материалы: обезвоженный ацетат натрия; натронная известь (смесь порошков оксида кальция с гидроксидом натрия, 3:1); насыщенный раствор бромной воды; 1%-ный раствор перманганата калия; 5%- ный раствор брома; концентрированные кислоты: соляная, серная, азотная; концентрированный раствор аммиака; 1 н раствор карбоната натрия; аммиачный раствор хлорида меди (I); 1%-ный спиртовой раствор фенолфталеина, обезвоженный бензоат натрия, бензол (марки "хч"); специально очищенный толуол, 10 %-ный раствор брома в четыреххлористом углероде; восстановленное железо, лед или снег.
Оборудование: ступка, пестик, газоотводная трубка с пробкой, стеклянная лопатка, набор пробирок в штативе, фарфоровая чашечка.
Опыт 1. Получение метана (реакция Дюма) и изучение его свойств
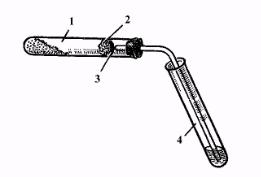
В ступке тщательно растирают обезвоженный ацетат натрия с натронной известью (массовое соотношение 1:2). Смесь помещают в пробирку (высота слоя 8–10 мм), закрывают пробкой с газоотводной трубкой (рис.1) и закрепляют в пробиркодержателе. В штатив ставят две пробирки. В одну пробирку наливают 2—3 мл раствора перманганата калия, в другую
— 2 мл бромной воды.
Рис.1. Прибор для получения метана:
1 |
– |
пробирка |
с реакционной |
смесью, |
2 |
– |
вата, 3 – |
газоотводная |
трубка, |
4 – пробирка с раствором. |
|
|||
В пробиркодержателе закрепляют пробирку с содержимым и равномерно нагревают всю пробирку, а затем ту часть, где находится основное количество смеси. Конец газоотводной трубки поочередно вводят в
предварительно подготовленные растворы перманганата калия и бромной воды. Пропускание газа проводят в течение 20–30 с. Растворы не изменяют своей окраски, что свидетельствует о том, что метан при комнатной
4

температуре не окисляется и не способен вступать в реакции присоединения. Газоотводную трубку переворачивают вверх и поджигают газ. Метан горит несветящимся голубоватым пламенем. При внесении фарфоровой чашки в пламя сажа на ней не образуется.
После охлаждения пробирки к ее содержимому добавляют 1–2 капли концентрированной соляной кислоты. Наблюдают характерное «вскипание» — качественная реакция на карбонаты – в данном случае побочный продукт получения метана из ацетата натрия. Если быстро соединить пробирку с газоотводной трубкой и опустить ее в заранее приготовленную пробирку с 2–3 каплями насыщенного раствора гидрата окиси бария Ba(OH)2, можно заметить помутнение баритовой воды вследствие выделения белого осадка карбоната бария.
Напишите уравнения проведенных реакций, в том числе и горения метана. Почему метан горит без образования сажи?
Опыт 2. Получение этилена и его химические свойства
В сухую пробирку наливают 1 мл этанола и осторожно 2 мл концентрированной серной кислоты, помещают несколько крупинок окиси алюминия Al2O3 или сухого песка, закрывают пробкой с газоотводной трубкой (см. рис.1). Этанол при смешивании с серной кислотой образует этилсульфат:
CH3-CH2-OH + HO-SO3H  CH3-CH2-O-SO3H + H2O кислый этиловый эфир
CH3-CH2-O-SO3H + H2O кислый этиловый эфир
серной кислоты
Смесь осторожно нагревают, не допуская сильных толчков реакционной смеси:
Так же, как в опыте 1, изучают взаимодействие этилена с растворами бромной воды и перманганата калия (реакция Вагнера). Выделяющийся этилен моментально обесцвечивает бромную воду, а фиолетовый раствор перманганата калия почти мгновенно исчезает и появляется бурый осадок оксида марганца (IV):
1,2-дибромэтан
5

этиленгликоль
После всех реакций газоотводную трубку переворачивают вверх и поджигают этилен. Он горит светящимся желтоватым пламенем. При внесении в пламя фарфоровой чашки на ней образуется черное пятно. Это объясняется неполным окислением этилена при горении на воздухе, вследствие большего процентного содержания углерода в молекуле:
Запишите все реакции и расставьте коэффициенты в последних двух уравнениях реакций, составьте уравнение полного сгорания этилена. Рассчитайте массовые доли углерода и водорода в этилене.
Опыт 3. Получение ацетилена и изучение его свойств
В пробирку помещают небольшой кусочек карбида кальция СаС2 и приливают 1 мл воды. Пробирку закрывают пробкой с газоотводной трубкой (см. рис.1), и выделяющийся ацетилен пропускают через заранее приготовленные растворы: бромной воды, перманганата калия, аммиачного раствора хлорида меди (I). При пропускании ацетилена через насыщенную бромную воду наблюдают постепенное ее обесцвечивание:
1,1,2,2-тетрабромэтан
При окислении ацетилена перманганатом калия фиолетовая окраска исчезает и появляется осадок оксида марганца (IV) бурого цвета:
щавелевая кислота
Терминальные ацетиленовые углеводороды способны обменивать свои кислые протоны на металлы с образованием солей — окрашивание в красный цвет раствора с дальнейшим выпадением красно-бурого осадка ацетиленида меди (I):
6

Ацетиленид меди образуется только в присутствии аммиака (практически берется аммиачный раствор однохлористой меди). Аммиак необходим для связывания выделяющегося при реакции хлористого водорода. Реакция эта очень чувствительна, ее применяют для открытия следов ацетилена в воздухе цехов промышленных предприятий, использующих ацетилен.
Ацетилениды требуют осторожного обращения. В высушенном виде они очень опасны, так как взрываются при ударе или нагревании.
Так же, как и в предыдущих опытах, изучают горение ацетилена на воздухе. Он горит коптящим пламенем:
После проведения опыта в пробирку, в которой получали ацетилен, добавляют каплю фенолфталеина. Появляется малиновое окрашивание — качественная реакция на присутствие щелочей — в данном случае побочный продукт получения ацетилена из карбида кальция.
Объясните, почему ацетилен взаимодействует с бромом значительно медленнее, чем этилен? Напишите уравнение получения ацетилена и расставьте коэффициенты в уравнениях реакций, составьте уравнение полного сгорания ацетилена.
Опыт 4. Получение бензола из бензойнокислого натрия
Получение бензола из натриевой соли бензойной кислоты аналогично получению метана из натриевой соли уксусной кислоты.
В ступке готовят тонко измельченную смесь из 2 г бензойнокислого натрия и 4 г натронной извести. Полученную смесь пересыпают в пробирку и закрывают пробкой с газоотводной трубкой (см. рис. 1). Конец газоотводной трубки опускают в сухую пробирку, охлаждаемую водой со льдом (или снегом). Пробирку со смесью тщательно прогревают в пламени спиртовки до образования прозрачного раствора. При дальнейшем нагревании в приемной пробирке образуется бензол, который обычно кристаллизуется. Он имеет характерный запах.
Так как пары бензола обладают хотя и специфическим, но довольно слабым запахом, их переводят обычно в нитробензол, обладающий очень интенсивным запахом. Для этого пары бензола пропускают через нитрующую смесь из концентрированных азотной и серной кислот. Последняя является водоотнимающим средством:
7

|
H2SO4 |
|
|
|
NO2 |
+ HO-NO2 |
|
|
|
+ H O |
|
|
|
|
|
||
|
|||||
|
|
|
|
|
2 |
|
|
|
|
|
|
нитробензол
Конец газоотводной трубки с исходной смесью опускают в предварительно приготовленную пробирку с несколькими каплями концентрированных азотной и серной кислот (в отношении 1:1). Через несколько секунд в пробирке над слоем кислот появляется темная капля нитробензола. В нее наливают 8–10 капель воды, чтобы разбавить концентрированные кислоты, взбалтывают и определяют наличие нитробензола по резкому запаху, напоминающему запах горького миндаля. Обратите внимание на плотность нитробензола, на положение капли его до
ипосле разбавления кислот водой.
Кисходной смеси бензойнокислого натрия и натронной извести добавляют 1–2 капли концентрированной соляной кислоты. Опишите наблюдаемые явления.
Полученный бензол разделяют на три пробирки. В первую добавляют 1 мл воды, во вторую – 1 мл этанола, в третью – 1 мл диэтилового эфира. Взбалтывают содержимое пробирок и наблюдают растворимость в данных растворителях.
Помещают в фарфоровую чашечку 1 каплю бензола и поджигают его (опыт проводят в вытяжном шкафу!).
Напишите уравнение получения бензола и составьте уравнение полного его сгорания.
Опыт 5. Свойства бензола и его гомологов
1) Бензол не присоединяет бром из бромной воды.
В пробирку с тремя каплями бромной воды добавляют три капли бензола. Бензол легче воды и в ней не растворяется (см. опыт 4). Поэтому после встряхивания смеси бензола с водой он всплывает наверх при стоянии. При этом наблюдается обесцвечивание нижнего слоя бромной воды и окрашивание бензола в желтый цвет. Объясните, что при этом происходит?
Бромирование бензола и его гомологов, в отличие от непредельных соединений жирного ряда, протекает в особых условиях в присутствии специальных катализаторов, при этом происходит замещение атома водорода бромом с выделением бромистого водорода:
8
|
Fe |
|
|
|
Br |
+ Br2 |
|
|
|
+ HBr |
|
|
|
|
|
||
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
В две сухие пробирки помещают по 1 мл бензола и толуола. (Опыт проводят в вытяжном шкафу!). В каждую пробирку добавляют по 1 мл раствора брома в четыреххлористом углероде. Пробирки осторожно нагревают в пламени спиртовки до слабого кипения.
После охлаждения в пробирки добавляют несколько крупинок порошка восстановленного железа и снова осторожно подогревают смесь 2–3 минуты. Затем содержимое пробирки выливают в пробирку с 2 мл воды.
Напишите уравнения бромирования бензола и толуола в присутствии железа и без него, опишите наблюдения.
2) Бензол не окисляется раствором марганцевокислого калия.
Впробирку с 5 каплями воды добавляют каплю 0,1 н KMnO4 и 1 каплю 2н H2SO4. К полученному розовому раствору добавляют 1 каплю бензола и встряхивают. Наблюдается ли обесцвечивание?
3) Окисление гомологов бензола
Впробирку наливают 0,5 мл толуола и добавляют раствор перманганата калия, подкисленного каплей раствора серной кислоты. Содержимое пробирки энергично встряхивают и нагревают над пламенем микрогорелки. Наблюдается постепенное обесцвечивание розового раствора и выделение на стенках пробирки коричневых окислов марганца:
Врезультате окисления каждая боковая цепь в кольце бензола в конечном счете образует карбоксильную группу. Поэтому, пользуясь реакцией окисления боковых цепей, можно точно установить строение ароматических углеводородов.
9
Контрольные вопросы
1)Каковы общие формулы гомологических рядов предельных, этиленовых, ацетиленовых и ароматических углеводородов?
2)Особенности строения алканов, алкенов и алкинов (sp3-, sp2- и spгибридизация).
3)Строение бензола. Признаки ароматичности и условия ароматичности соединений.
4)Какие из изученных классов соединений химически более
активны?
5)Какие реакции характерны для предельных и непредельных углеводородов?
6)Расположите в ряд С-Н-кислотности алканы, алкены и алкины. Объясните причину подвижности водорода при тройной связи, исходя из особенностей строения ацетилена. Ответ подтвердите реакциями.
7)Почему в ряду соединений метан, этен, этин при их горении пламя становится более коптящим?
8)Охарактеризуйте отношение алканов, алкенов, алкинов и аренов к брому и окислителям.
10
