
Часть 2
.PDF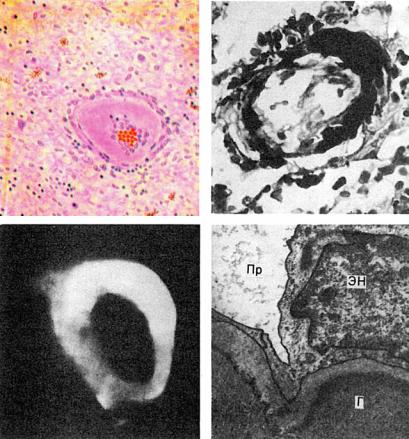
Глава 2. Дистрофии |
93 |
а |
|
б |
в |
|
г |
Рис. 2-10. Гиалиноз сосудов селезенки: а — стенка центральной артерии фолликула селезенки представлена гомогенными массами гиалина; б — фибрин среди гиалиновых масс при окраске по методу Вейгерта; в — фиксация в гиалине IgG-иммунных комплексов (люминесцентная микроскопия); г — массы гиалина (Г) в стенке артериолы; ЭН — эндотелий; Пр — просвет артериолы. Электронограмма, ×15 000
–липогиалин — содержит липиды и β-липопротеиды, его обнаруживают часто при сахарном диабете;
–сложный гиалин — состоит из иммунных комплексов, фибрина и разрушающихся структур сосудистой стенки (см. рис. 2-10), характерен для болезней с иммунопатологическими нарушениями, например ревматических заболеваний.
Гиалиноз собственно соединительной ткани развивается обычно в исходе фибриноидного набухания, ведущего к деструкции коллагена и пропитыванию ткани белками плазмы и полисахаридами.

94 |
Общая патологическая анатомия |
Микроскопически находят набухание соединительнотканных пучков, они теряют фибриллярность и сливаются в однородную, плотную, хрящеподобную массу; клеточные элементы сдавлены и атрофированы. Этот механизм развития системного гиалиноза соединительной ткани особенно часто встречается при заболеваниях с иммунными нарушениями (ревматических болезнях). Гиалиноз может завершать фибриноидные изменения в дне хронической язвы желудка, в червеобразном отростке при аппендиците, он подобен механизму местного гиалиноза в очаге хронического воспаления.
Гиалиноз как исход склероза имеет и местный характер. Он развивается
врубцах, фиброзных спайках серозных полостей, сосудистой стенке при атеросклерозе, инволюционном склерозе артерий, при организации тромба,
вкапсулах, строме опухоли и т.д. В основе гиалиноза в этих случаях лежат нарушения обмена соединительной ткани. Подобный механизм имеет гиалиноз некротизированных тканей и фибринозных наложений.
Внешний вид органов при выраженном гиалинозе меняется. Гиалиноз мелких артерий и артериол ведет к атрофии, деформации и сморщиванию органа (например, развитию артериолосклеротического нефроцирроза). При гиалинозе собственно соединительной ткани она становится плотной, белесоватой, полупрозрачной (например, гиалиноз клапанов сердца при ревматическом пороке).
Исход в большинстве случаев неблагоприятный, но возможно и рассасывание гиалиновых масс. Гиалин в рубцах — келоиды, которые могут разрыхляться и рассасываться. Гиалиноз молочной железы обратим, причем рассасывание гиалиновых масс происходит в условиях гиперфункции желез. Иногда гиалинизированная ткань ослизняется.
Функциональное значение различно в зависимости от локализации, степени и распространенности гиалиноза. Распространенный гиалиноз артериол может привести к функциональной недостаточности органа — почечной недостаточности при артериолосклеротическом нефроциррозе. Местный гиалиноз (например, клапанов сердца при его пороке) тоже может быть причиной функциональной недостаточности органа. Однако в рубцах он может не причинять особых расстройств.
Амилоидоз
Амилоидоз1 (от лат. amylum — крахмал), или амилоидная дистрофия, — стромально-сосудистый диспротеиноз, который сопровождается глубоким нарушением белкового обмена, появлением аномального фибриллярного белка и образованием в межуточной ткани и стенках сосудов сложного вещества — амилоида.
Венский патолог К. Рокитанский в 1844 г. описал своеобразные изменения паренхиматозных органов, которые, помимо резкого уплотнения,
1 В современных учебниках амилоидоз рассматривается в разделе болезней аутоиммуннизации.
Глава 2. Дистрофии |
95 |
приобретали восковой, сальный вид. Заболевание, при котором возникали подобные изменения органов, он назвал «сальной» болезнью. Спустя несколько лет Р. Вирхов показал, что изменения эти связаны с появлением в органах особого вещества, которое йод и серная кислота окрашивают в синий цвет. Он назвал его амилоидом, а «сальную» болезнь — амилоидозом. Белковую природу амилоида установили русский патолог М.М. Руднев вместе с В. Кюне в 1865 г.
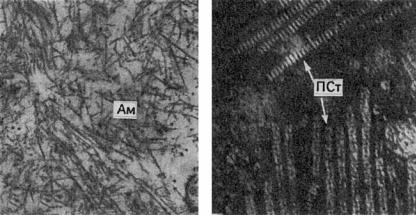
Химический состав и физические свойства амилоида. Амилоид — гликопротеид, основные компоненты которого — фибриллярные белки (F-компонент). Они образуют фибриллы, имеющие характерную ультрамикроскопическую структуру (рис. 2-11). Фибриллярные белки амилоида неоднородны. Выделяют 4 типа этих белков, характерных для определенных форм амилоидоза:
–АА-белок — неассоциированный с иммуноглобулинами белок образуется из своего сывороточного аналога — белка SAA;
–AL-белок — ассоциированный с иммуноглобулинами белок, предшественники которого — L-цепи (легкие цепи) иммуноглобулинов;
–AF-белок, в образовании которого участвует главным образом преальбумин;
–ASCI-белок, предшественник которого тоже преальбумин.
Белки фибрилл амилоида идентифицируют при иммуногистохимическом исследовании специфическими сыворотками, химическими (реакциями с перманганатом калия, щелочным гуанидином) и физическими (автоклавированием) реакциями.
Фибриллярные белки амилоида, которые продуцируют клетки — амилоидобласты, входят в сложные соединения с глюкопротеидами плазмы
а |
|
б |
Рис. 2-11. Ультраструктура амилоида: а — фибриллы амилоида (Ам), ×35 000; б — палочковидные образования, состоящие из пентагональных структур (ПСт), ×300 000 (Гленнер и др.)

96 Общая патологическая анатомия
крови. Плазменный компонент (Р-компонент) амилоида — палочковидные структуры («периодические палочки») (см. рис. 2-11). Фибриллярный и Р-компонент амилоида обладают антигенными свойствами, они вступают в соединения с хондроитинсульфатами ткани, к образующемуся комплексу присоединяются гематогенные добавки, наиболее значимые из них — фибрин и иммунные комплексы. Связи белков и полисахаридов в амилоидном веществе чрезвычайно прочные, чем объясняется отсутствие эффекта при действии на амилоид различных ферментов организма.
Характерное свойство амилоида — его красное окрашивание конго |
|
красным, метиловым (или генциановым) фиолетовым; характерна специ- |
|
фическая люминесценция с тиофлавинами S или Т. Амилоид выявляют |
|
с помощью поляризационного микроскопа. Ему свойственны дихроизм |
|
и анизотропия, спектр двойного лучепреломления лежит в пределах |
|
540–560 нм. Эти свойства позволяют отличать амилоид от других фиб- |
|
риллярных белков. Для макроскопической диагностики амилоидоза |
|
на |
ткань действуют раствором Люголя, а затем 10% раствором сер- |
ной |
кислоты — амилоид приобретает сине-фиолетовый или грязно- |
зеленый цвет.
Красочные реакции амилоида, связанные с особенностями его химического состава, зависят от формы, вида и типа амилоидоза. Иногда они отсутствуют — ахроматический амилоид, или ахроамилоид.
Классификация амилоидоза учитывает возможную причину, специфику белка фибрилл амилоида, распространенность амилоидоза, своеобразие клинических проявлений в связи с преимущественным поражением определенных органов и систем (табл. 2-3).
Таблица 2-3. Классификация амилоидоза (ВОЗ, 1993)
Тип амилоидоза |
Белок-предшественник |
Клиническая форма |
|
|
|
AA |
SAA (острофазовый |
Вторичный амилоидоз |
|
белок) |
Периодическая болезнь |
|
|
Синдром Маккла и Уэллса |
|
|
|
AL |
Легкие цепи иммуно- |
Первичный амилоидоз |
|
глобулинов |
Амилоидоз при миеломной болезни |
|
|
|
ATTR |
Транстеритин |
Семейная амилоидная полинейропатия |
|
|
Семейная амилоидная кардиопатия |
|
|
Системный старческий амилоидоз |
|
|
|
По происхождению выделяют первичный (идиопатический), включая наследственный (генетический, семейный), вторичный (приобретенный) и старческий амилоидоз. Первичный, наследственный, и старческий амилоидоз рассматривают в качестве нозологических форм. Вторичный амилоидоз — осложнение тех или иных заболеваний, «вторая болезнь».
Первичный (идиопатический) амилоидоз характеризуется отсутствием предшествующего или сопутствующего причинного заболевания; пора-
Глава 2. Дистрофии |
97 |
жение преимущественно мезодермальных тканей — сердечно-сосудистой системы, поперечнополосатых и гладких мышц, нервов и кожи (генерализованный амилоидоз); склонность к образованию узловатых отложений; непостоянство красочных реакций амилоидного вещества; часты отрицательные результаты при окраске конго красным.
Наследственный (генетический, семейный) амилоидоз. Значение генетических факторов в развитии амилоидоза подтверждается своеобразием его географической патологии и особой предрасположенностью к нему определенных этнических групп населения. Наиболее часто встречаемый тип наследственного амилоидоза с преимущественным поражением почек характерен для периодической болезни — семейной средиземноморской лихорадки, которую наблюдают у представителей древних народов (евреев, армян, арабов).
Семейный нефропатический амилоидоз протекает с лихорадкой, крапивницей и глухотой, описан в английских семьях (форма Маккла и Уэллса). Наследственный нефропатический амилоидоз имеет несколько вариантов. Для наследственной нейропатии I типа (португальского амилоидоза) характерно поражение периферических нервов нижних конечностей; для нейропатии II типа, встречаемой в американских семьях, — поражение периферических нервов верхних конечностей. При нейропатии III типа, которая описана у американцев, встречается сочетание ее
снефропатией. При нейропатии IV типа, описанной в финских семьях, отмечено сочетание не только с нефропатией, но и с сетчатой дистрофией роговицы.
Наследственный кардиопатический амилоидоз, встречаемый у датчан, мало отличается от генерализованного первичного амилоидоза.
Вторичный (приобретенный) амилоидоз — осложнение ряда заболеваний («вторая болезнь»): хронические инфекции (особенно туберкулез), болезни
сгнойно-деструктивными процессами (хронические неспецифические воспалительные заболевания легких, остеомиелит, нагноение ран), злокачественные новообразования (парапротеинемические лейкозы, лимфогранулематоз, рак), ревматические болезни (ревматоидный артрит). Вторичный амилоидоз, при котором, как правило, поражаются многие органы и ткани (генерализованный амилоидоз), встречаются чаще относительно других форм амилоидоза.
При старческом амилоидозе типичны поражения сердца, артерий, головного мозга и островков поджелудочной железы. Эти изменения, как и атеросклероз, обусловливают старческую физическую и психическую деградацию. У старых людей имеется несомненная связь между амилоидозом, атеросклерозом и диабетом, которая объединяет возрастные нарушения обмена. При старческом амилоидозе наиболее часты локальные формы (амилоидоз предсердий, головного мозга, аорты, островков поджелудочной железы), хотя встречается и генерализованный старческий амилоидоз с преимущественным поражением сердца и сосудов, который клинически мало отличается от генерализованного первичного амилоидоза.
98 |
Общая патологическая анатомия |
По специфике белка фибрилл амилоида выделяют AL-, АА-, AF- и ASCIамилоидоз.
• AL-амилоидоз включает первичный (идиопатический) амилоидоз и амилоидоз при «плазмоклеточной дискразии», которая объединяет парапротеинемические лейкозы (миеломную болезнь, болезнь Вальденстрема, болезнь тяжелых цепей Франклина), злокачественные лимфомы. AL-амилоидоз — всегда генерализованный амилоидоз с поражением сердца, легких и сосудов.
•АА-амилоидоз охватывает вторичный амилоидоз и две формы наследственного — периодическую болезнь и болезнь Маккла и Уэллса. Это тоже генерализованный амилоидоз, но с преимущественным поражением почек.
•AF-амилоидоз — наследственный, представлен семейной амилоидной нейропатией (FAP); поражаются периферические нервы.
•ASC-амилоидоз — старческий генерализованный или системный (SSA) амилоидоз с преимущественным поражением сердца и сосудов.
Учитывая распространенность амилоидоза, различают генерализованную
илокальную формы. Генерализованный амилоидоз включают первичный амилоидоз и амилоидоз при «плазмоклеточной дискразии» (формы AL-амило- идоза), вторичный и некоторые типы наследственного амилоидоза (формы АА-амилоидоза) и старческий системный амилоидоз (ASCI-амилоидоз). Локальный амилоидоз включает ряд форм наследственного и старческого амилоидоза, локальный опухолевидный амилоидоз — так называемая амилоидная опухоль.
По своеобразию клинических проявлений с преимущественным поражением органов и систем выделяют кардиопатический, нефропатический, нейропатический, гепатопатический, эпинефропатический, смешанный типы амилоидоза и АРUD-амилоидоз. Кардиопатический тип чаще встречают при первичном и старческом системном амилоидозе, нефропатический — при вторичном амилоидозе, периодической болезни и болезни Маккла
иУэллса. Для вторичного амилоидоза характерны и смешанные типы — сочетание поражения почек, печени, надпочечников, желудочно-кишечного тракта. Нейропатический амилоидоз, как правило, имеет наследственный характер. APUD-амилоид развивается в органах APUD-системы при развитии в них опухолей (апудом) и в островках поджелудочной железы при старческом амилоидозе.
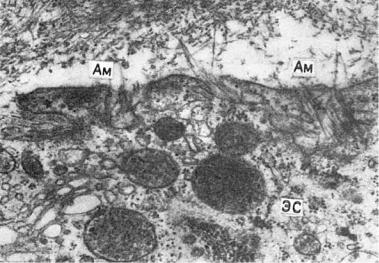
Морфо- и патогенез амилоидоза. Функцию амилоидобластов, продуцирующих белок фибрилл амилоида (рис. 2-12), при различных формах амилоидоза выполняют разные клетки. При генерализованных формах амилоидоза — главным образом макрофаги, плазматические и миеломные клетки, однако не исключена роль фибробластов, ретикулярных клеток
иэндотелиоцитов. При локальных формах роль амилоидобластов играют кардиомиоциты (амилоидоз сердца), гладкомышечные клетки (амилоидоз аорты), кератиноциты (амилоидоз кожи), В-клетки островков поджелудочной железы (инсулярный амилоидоз), С-клетки щитовидной железы
идругие эпителиальные клетки APUD-системы.
Глава 2. Дистрофии |
99 |
Рис. 2-12. Амилоидобласт. Фибриллы амилоида (Ам) в инвагинатах плазмолеммы звездчатого ретикулоэндотелиоцита с гиперплазией гранулярной эндоплазматической сети (ЭС), свидетельствующей о его высокой синтетической активности, ×30 000
Появление клона амилоидобластов объясняется мутационной теорией амилоидоза. При вторичном амилоидозе, исключая амилоидоз при «плазмоклеточной дискразии», мутации и появление амилоидобластов связывают с длительной антигенной стимуляцией. Клеточные мутации при «плазмоклеточной дискразии» и амилоидозе опухолей, а возможно, и при локальном опухолевидном амилоидозе обусловлены опухолевыми мутагенами. При генетическом (семейном) амилоидозе мутация гена происходит в различных локусах, чем и определяются различия в составе амилоидного белка у разных людей
иживотных. При старческом амилоидозе вероятны подобные механизмы, так как эта разновидность амилоидоза — фенокопия генетического амилоидоза. Антигены белка амилоидных фибрилл — чрезвычайно слабые иммуногены: мутирующиеся клетки не распознаются иммунокомпетентной системой
ине элиминируются. Развивается иммунологическая толерантность к белкам амилоида, что обусловливает прогрессирование амилоидоза. Чрезвычайно редко рассасывание амилоида макрофагами (гигантскими клетками инородных тел) — амилоидоклазия.
Образование амилоидного белка связано с ретикулярными (периретикулярный амилоидоз) или коллагеновыми (периколлагеновый амилоидоз) волокнами. Для периретикулярного амилоидоза, при котором амилоид выпадает по ходу мембран сосудов, желез и ретикулярной стромы паренхиматозных органов, характерно преимущественное поражение селезенки, печени, почек, надпочечников, кишечника, интимы сосудов мелкого
100 |
Общая патологическая анатомия |
исреднего калибра — паренхиматозный амилоидоз. Для периколлагенового амилоидоза, при котором амилоид выпадает по ходу коллагеновых волокон, свойственно преимущественное поражение адвентиции сосудов среднего и крупного калибра, миокарда, поперечнополосатых и гладких мышц, нервов, кожи — мезенхимальный амилоидоз. Таким образом, амилоидные отложения имеют довольно типичную локализацию: в стенках кровеносных
илимфатических капилляров и сосудов в интиме или адвентиции, в строме органов по ходу ретикулярных и коллагеновых волокон, в собственной оболочке железистых структур. Амилоидные массы вытесняют и замещают паренхиматозные элементы органов — наступает их хроническая функциональная недостаточность.
Патогенез амилоидоза сложен и неоднозначен у различных его форм
итипов. Хорошо изучен патогенез АА- и AL-амилоидоза.
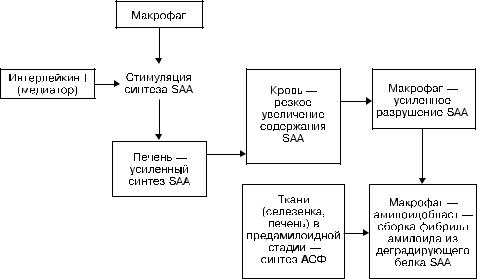
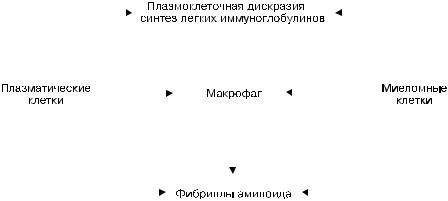
При АА-амилоидозе фибриллы амилоида образуются из поступающего в макрофаг — амилоидобласт, плазменного предшественника фибриллярного белка амилоида — белка SAA, который усиленно синтезируется в печени (рис. 2-13). Усиленный синтез SAA гепатоцитами стимулирует макрофагальный медиатор интерлейкин-1, что приводит к резкому увеличению содержания SAA в крови (предамилоидная стадия). В этих условиях макрофаги не в состоянии осуществить полную деградацию SAA, и из его фрагментов в инвагинатах плазматической мембраны амилоидобласта происходит сборка фибрилл амилоида (см. рис. 2-12). Стимулирует эту сборку амилоидстимулирующий фактор, который обнаруживают в селезенке, печени в предамилоидной стадии. Таким образом, ведущую роль в патогенезе АА-амилоидоза играет макрофагальная система: она стимулирует усилен-
Рис. 2-13. Схема патогенеза АА-амилоидоза
Глава 2. Дистрофии |
101 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2-14. Схема патогенеза AL-амилоидоза
ный синтез белка-предшественника SAA печенью, она же участвует и в образовании фибрилл амилоида из деградирующих фрагментов этого белка.
При AL-амилоидозе сывороточные предшественники белка амилоидных фибрилл — L-цепи иммуноглобулинов. Возможны два механизма образования AL-амилоидных фибрилл: нарушение деградации моноклоновых легких цепей с образованием фрагментов, способных к агрегации в амилоидные фибриллы; появление L-цепей с особыми вторичными и третичными структурами при аминокислотных заменах. Синтез амилоидных фибрилл из L-цепей иммуноглобулинов может происходить не только в макрофагах, но и в плазматических и миеломных клетках, синтезирующих парапротеины (рис. 2-14). Таким образом, к патогенезу AL-амилоидоза причастна, прежде всего, лимфоидная система. С ее извращенной функцией связано появление амилоидогенных легких цепей иммуноглобулинов — предшественников амилоидных фибрилл. Роль макрофагальной системы при этом вторичная, соподчиненная.
Макро- и микроскопическая характеристика амилоидоза. Внешний вид органов при амилоидозе зависит от степени процесса. Если отложения амилоида небольшие, внешний вид органа изменен мало, и амилоидоз обнаруживают лишь при микроскопическом исследовании. При выраженном амилоидозе орган увеличен, становится очень плотным и ломким, а на разрезе имеет своеобразный восковидный, или сальный, вид.
В селезенке амилоид откладывается в лимфатических фолликулах (рис. 2-15, а) или равномерно по всей пульпе. В первом случае амилоидноизмененные фолликулы увеличенной и плотной селезенки на разрезе имеют вид полупрозрачных зерен, напоминающих зерна саго, — «саговая» селезенка. Во втором случае селезенка увеличена, плотная, коричневокрасная, гладкая, имеет сальный блеск на разрезе — «сальная» селезенка. «Саговая» и «сальная» селезенка — последовательные стадии процесса.

102 |
Общая патологическая анатомия |
а |
|
б |
|
|
|
в |
|
г |
|
|
|
Рис. 2-15. Амилоидоз: а — амилоид в фолликулах селезенки («саговая» селезенка); б — амилоид в сосудистых клубочках почек; в — амилоид в стенках сосудов сердца;
г— амилоид в стенках сосудов легких
Впочках амилоид откладывается в стенке сосудов, капиллярных петлях и мезангии клубочков, в базальных мембранах канальцев и строме. Почки становятся плотными, большими и «сальными». По мере нарастания процесса клубочки и пирамиды полностью замещаются амилоидом (рис. 2-15, б), разрастается соединительная ткань и развивается амилоидное сморщивание почек.
Впечени отложение амилоида наблюдают между звездчатыми ретикулоэндотелиоцитами синусоидов, по ходу ретикулярной стромы долек, в стенках сосудов, протоков и в соединительной ткани портальных трактов. По мере накопления амилоида печеночные клетки атрофируются и погибают. При этом печень увеличена, плотная, выглядит сальной.
Вкишечнике амилоид выпадает по ходу ретикулярной стромы слизистой оболочки, в стенках сосудов слизистой оболочки и подслизистого слоя. При значительном амилоидозе железистый аппарат кишечника атрофируется.
Амилоидоз надпочечников, как правило, двусторонний, отложение амилоида встречается в корковом веществе по ходу сосудов и капилляров.
