
- •Вопросы к экзамену по дисциплине «Аналитическая химия.
- •2. Методы аналитической химии. Классификации методов определения. На основании предложенной классификации представьте методы определения железа, каковы их преимущества и недостатки.
- •4. Абсолютные и относительные методы анализа. Процесс градуировки. Стандартные образцы.
- •5. Виды погрешностей и ошибок. Систематические ошибки, их классификация. Устранение систематических ошибок. Рассмотрите на конкретном примере:
- •1) Кислотно-основного титриметрического определения уксусной кислоты в уксусной эссенции;
- •2) Гравиметрического определения хроматов в электролите для хромирования.
- •13. Загрязнение осадков. Явление соосаждения, его роль и причины. Адсорбция. Окклюзия. Правила Панета-Фаянса-Гана. Изоморфное соосаждение. Правило Хлопина. На конкретных примерах.
- •14. Методы отгонки. Вещества, определяемые методом отгонки. Прямые и косвенные методы отгонки. Поглотители для прямого метода отгонки. Методы определения карбонатов в карбонатных породах.
- •23. Титрование в неводных средах. Его необходимость, преимущества и недостатки. Кривая титрования смеси хлороводородной и бензойной кислот в этиловом спирте.
- •31.Броматометрия: стандартные вещества и индикаторы. Броматометрическое определение сурьмы, фенола. КТхлороводородного раствора хлорида сурьмы (III).
- •32 Йодометричопред меди (II). Окислительно-восстановительная способность пары i2/2i-. Kривая титрования йода Na2s203. Факторы, влияющие на ход кт. Способы установления ктт в йодометрии.
- •33. Йодометрическое определение нитрит-ионов, глюкозы, сульфитов. Основные реакции метода йодометрии. Приготовление и стандартизация рабочих растворов.
- •3.Атомно-абсорбционный метод.
- •38. Сравните гравиметрические и титриметрические методы определения меди. Принципы методов, их преимущества и недостатки, возможности усовершенствования.
- •39. Сравните гравиметрические и титриметрические методы определения кальция. Принципы методов, их преимущества и недостатки, возможности усовершенствования.
- •40. Сравните гравиметрические и титриметрические методы определения алюминия. Принципы методов, их преимущества и недостатки, возможности усовершенствования.
33. Йодометрическое определение нитрит-ионов, глюкозы, сульфитов. Основные реакции метода йодометрии. Приготовление и стандартизация рабочих растворов.
Определения нитрит-ионов: Нитрит-ионы напрямую с йодидом калия взаимодействуют медленно и недостаточно стехиометрично.
2NaNO2 + 2KI + 2H2SO4 = Na2SO4 + I2+ 2NO + K2SO4 + 2H2O
2NO2- + 2I- + 4H+=I2+ 2NO+ 2H2O
Поэтому определение проводят с использованием многостадийного процесса.
Реакции:
1)Сначала к задаче содержащей нитрит-ион приливают точно известный объём KMnO4, взятый в избытке:
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
2MnO4- + 5NO2- + 6H+= 2Mn2+ + 5NO3-+ 3H2O
2) Затем избыток KMnO4 взаимодействует с KI:
2KMnO4 + 10KI + 8H2SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
2MnO4- + 10I- + 16H+= 2Mn2+5I2 + 8H2O
3)Выделившийся йод оттитровывают туосульфатом натрия:
I2+2Na2S2O3= 2NaI+Na2S4O6
Ход анализа и его условия:
Анализируемый раствор помещают в колбу на 100,0 мл, разбавляют дистиллированной водой до метки, перемешивают. В коническую колбу отбирают пипеткой 25 мл стандартного раствора KMnO4, прибавляют 5 млH2SO4, вводят пипеткой 20 мл исследуемого раствора и выдерживают 2-3 минуты, затем прибавляют 10 мл 10%-го раствораKI, и еще выдерживают в темном месте 10 мин и титруют растворомNa2S2O3 до соломенно - желтой окраски, приливают раствор крахмала и титруют до обесцвечивания.
Индикатор:крахмал.Переходы окрасок:грязновато-красный (коричневый) - соломенно-желтый - синие-фиолетовый - обесцвеченный.
Формуладля расчета массового содержания нитрита натрия:
W%=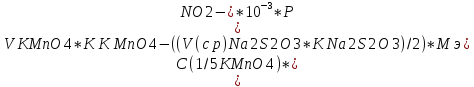
Определения глюкозы:Методика основана на восстановлении сахарами меди 2 до меди 1 из тартратного комплекса.
Реакции
Соль меди и тартрат калия берут в 2-3-х кратном избытке по отношению к глюкозе.
С6H12O6 + 2K2Cu(C4H4O6)2 + 5KOH=C6H11O7+Cu2O+ 4K2C4H4O6+3H2O
После реакции избыток ионов меди восстанавливают йодидом в кислой среде.
2Cu2+ +5I- = 2CuI +[I3-]
Выделившийся йод титруют туосульфатом натрия:
I2+2Na2S2O3= 2NaI+Na2S4O6
Ход анализа и его условия:
Пипеткой отбирают 10 мл задачи в колбу для титрования, из бюретки добавляют 10 мл раствора сульфата меди, пипеткой вводят 3,0 мл тартрата калия и перемешивают. Образовавшийся темно-синий раствор подогревают на плитке, при этом выделяется желтый осадок, переходящий в красный. Раствор охлаждают под струей воды, добавляют 20 мл раствора йодида калия и 10 мл серной кислоты.Титруют раствором тиосульфата натрия до бледно-желтой окраски.Добавляют йод и продолжают титровать до исчезновения синей окраски.
Аналогично проводят контрольный опыт. Для этго из бюретки в колбу для титрования наливают 10 мл сульфата меди, пипеткой вводят раствор 3.0 раствора тартрата калия, 20 мл раствора йодида калия и 10 мл серной кислоты. Полученный раствор титруют до бледно-желтой окраски, затем вводят 305 капель раствора крахмала и титруют до обесцвечивания раствор.
Индикатор: крахмал.Переходы окрасок: соломенно-желтый - синие-фиолетовый - обесцвеченный.
Формула:
W% =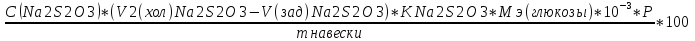
Определение сульфитов
Реакция между йодом и сульфит-ионами протекает сравнительно медленно, особенно в конце титрования, когда концентрация сульфит-ионов становиться незначительной. Поэтому сульфиты определяют йодометрическим способом обратного титрования. К анализируемой пробе добавляем избыток стандартного раствора йода, после того как реакция между йодом и сульфит-ионами пройдет до конца, непрореагировавший йод титруют в присутствии крахмала стандартным раствором тиосульфата до исчезновения синей окраски раствора.
Реакции:
Na2SO3 + I2 + H2O = Na2SO4 + NaI
I2+2Na2S2O3= 2NaI+Na2S4O6
Ход анализа и его условия:
Анализируемый раствор помещают в мерную колбу га 100 мл, разбавляют дистиллированной водой до метки,перемещивают,отбирают аликвоту в коническую колбу,добавляют пипеткой 25 мл раствора I2, колбу закрывают часовым стеклом и дают постоять 5-10 минут. Потом раствор титруют тиосульфатом до слабо-желтой окраски, затем титруемый раствор разбавляют в 2 раза дистиллированной водой, добавляют крахмал и титруют до исчезновения синей окраски.
Индикатор: крахмал.Переходы окрасок: соломенно-желтый - синие-фиолетовый - обесцвеченный.
Формула:
mSO32-, г=C(0.5I2)*(VI2*KI2 – VNa2S2O3*K Na2S2O3)*Mэкв(SO32-)*10-3*P
Основные реакции метода йодометрии:
-йодометрическое определение меди
-йодометрическое определение нитрит-ионов
-йодометрическое определение сульфитов
Индикатор :
Крахмал. В присутствии йодистого калия чувствительность повышается. С увеличением температуры чувствительность крахмала сильно понижается
Приготовление и стандартизация рабочих растворов.
В йодометрии два рабочих раствора: тиосульфот и йод.
Рабочий раствор тиосульфата натрия готовят из кристаллического Na2S2O3*5H2Oс последующим установлением титра через 10-12 дней, так как растворы претерпевают ряд сложных химических превращений,часть которых приводит к увеличению, а часть к уменьшению титра раствора.
Увеличение титра обусловлено действием углекислоты, для предотвращения разложения раствора угольной кислотой соль растворяют в воде(предварительно прокипятив и остудив, защищая от проникновения СО2пробкой с хлоркальцеевой трубкой, заполненной натронной известью).
Уменьшение титра происходит из-за окисления тиосульфата кислородом и вследствие разложения тиосульфата бактериями. Хранят в темном стекле, еженедельно проверяют коэффициент поправки.Для его установления применяют следующие растворы : хромат,пермангонат,йодат,бромат калия.
Пример:
Определение К раствора тиосульфата по раствору хромата калия методом пипетирования. В коническую колбу помещают 10 мл 10% раствора KIи 15 мл серной кислоты прибавляют 20 мл раствора хромата после этого перемешивают и ставят в темное место на 10 минут. После этого добавляют дистиллированную воду и титруют тиосульфатом,до соломенно-желтой окраски,затем приливают крахмал и титруют до обесцвечивания окраски.
Формула :
К = V(хромата)*К(хромата)/V(тиосульфата)
34. Сущность осадительного титрования. Классификация методов. Кривая аргентометрического титрования хлорид-ионов (йодид-ионов). Способы установления конечной точки титрования в методе аргентометрии. Возможность дифференцированного титрования галогенид-ионов.
Осадительное титрование - метод титриметрические определения, основанный на реакциях образования осадков малорастворимых соединений. В этих целях пригодны только некоторые реакции, удовлетворяющие определенным условиям:
1.Реакция должна протекать строго по уравнению и без побочных процессов. 2.Образующийся осадок должен быть практически нерастворимым и выпадать достаточно-быстро, без образования пересыщенных растворов.
3 Определение конечной точки титрования с помощью индикатора.
4. Явления адсорбции (соосаждения) должны быть выражены слабо, чтобы результат определения не искажался.
Классификация методов.
Наименования отдельных методов осаждения происходят от названий применяемых растворов.
1. Аргентометрическое титрование, титрант – раствор АgNО3. Этим методом определяют содержание ионов Сl и Вг в нейтральных или слабощелочных средах. В основе метода лежит реакция образования трудно растворимого галогенида серебра: Аg+ + Аn ¯ → АgАn↓Для определения анионов применяют нитрат серебра, для определения катионов серебра – хлорид натрия. Аргентометрическим методом пользуются главным образом для количественного определения галогенид-ионов и ионов серебра.
2.Тиоцианатометрия(роданометрия) основана на применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и служит для определения следов С1- и Вг~, но уже в сильнощелочных и кислых растворах. Используют ее и для определения содержания серебра в рудах или сплавах. Тиоцианометрическое титрование (роданометрическое), титрант – раствор NН4CNS. В основе метода лежит реакция: Аg+ + CNS ¯ → АgCNS↓Роданометрическим методом пользуются для определения галогенид-ионов и серебра. Для определения катионов Аg+ в качестве стандартного раствора используют тиоцианат аммония, для определения галогенидов и других анионов – нитрат серебра и роданид аммония.
3.Меркурометрическое титрование, титрант – раствор Нg2(NО3)2. Этот метод основан на реакции осаждения раствором Нg2(NО3)2 различных анионов:
2 С1¯ + Нg22+→ Нg2С12↓
Преимущества по сравнению с аргентометрическим методом:
может применяться для титрования в кислой среде;
соли ртути менее дефицитны;
меньшее число ионов оказывает влияние на точность определения.
Главный недостатокзаключается в том, что соли ртути ядовиты.
Поэтому при применении титрования необходимо соблюдать особую осторожность и аккуратность.
Кривая аргентометрического титрования хлорид-ионов (йодид-ионов)
Кривые титрования в аргентометрии обычно строят в координатах pAg - V, где pAg - взятый с обратным знаком логарифм концентрации ионов Ag+, V - объем титранта.
В качестве титранта выступают AgNO3 или KSCN, может быть взят также раствор NaCl. Рассмотрим на примере титрования раствора NaCl стандартным раствором AgNO3:
NaCl+ AgNO3→AgCl↓+NaNO3.
В качестве начальных условий:V(NaCl)=0,1 мл,C(NaCl)=0,1моль/л;объем AgNO3-переменная величина,C(AgNO3)=0,1моль/л, ПР(AgCl)=1,78*10-10, p KS0=9,75.
Для построения кривой осадительного титрования рассчитаем pCl=-lg[Cl-] в различные моменты титрования,а также pAg=-lg[Ag+]=pKS0(AgCl)- pCl после начала прибавления титранта.
Расчет pCl для исходного анализируемого раствора: pCl=-lg0,1=1;
Расчет pCl до ТЭ:
[Cl-]=[C(NaCl)* V(NaCl)- C(AgNO3)*V(AgNO3)]/[ V(NaCl)+ V(AgNO3)],
pCl=-lg[Cl-].
приV(AgNO3)=50мл [Cl-]=0,0333;pAg=8,27, pCl=1,48;
при V(AgNO3)=99мл [Cl-]=0,0005, pAg=6,45, pCl=3,30;
при V(AgNO3)=99,9мл [Cl-]=0,00005, pAg=5,45, pCl=4,30.
Расчет pCl в ТЭ.
В ТЭ теоритически все хлори-ионы оттитрованы, образовалось эквивалентное количество осадка AgCl,который хотя незначительно но растворяется AgCl↓↔Ag++Cl-.
Равновесную концентрацию можно рассчитать из ПР KS0=[Ag+]*[Cl-] поскольку в ТЭ
[Ag+]=[Cl-],то [Cl-]2= KS0(AgCl),
pCl=-lg[Cl-]=-lg KS0(AgCl)/2= pKS0(AgCl)/2=4,875.
Расчет после ТЭ
После ТЭ дальнейшее прибавление тиранта –раствора нитрата серебра-приводик к уменьшению растворимости осадка AgCl за счет влияния избытка вводимых одноименных ионов. Равновесная коцентрация хлорид-ионов уменьшается.
Значение pCl: KS0(AgCl) =[Ag+]*[Cl-], KS0(AgCl)=pAg+pCl, pCl=KS0(AgCl)- pAg=9,75- pAg.
Равновесная концетрация ионов серебра,а следовательно и pAg,определяются избытком прибавленного титранта:
[Ag+]=[C(AgNO3)*V(AgNO3)- C(NaCl)* V(NaCl)]/[ V(NaCl)+ V(AgNO3)].
Зная объем прибавляемого титранта можно найти:[Ag+], pAg,pCl. При V(AgNO3)=100,1мл [Cl-]=3,57*10-6, pAg=4,30, pCl=5,45;
V(AgNO3)=110мл [Cl-]=3,37*10-8, pAg=2,32, pCl=7,43.
До ТЭ f= 50 / 100 = 0,5 ТЭf= 100 /100 = 1 После ТЭf= 101 /100 = 1,01
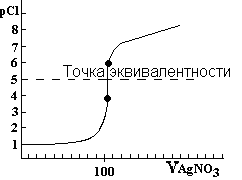
Результаты расчёта pCl-
|
N |
VAgNO3 |
[Cl-] |
pCl- |
PAg+ |
|
1 |
0 |
10-1 |
1 |
- |
|
2 |
90 |
10-2 |
2 |
8 |
|
3 |
99 |
10-3 |
3 |
7 |
|
4 |
99,9 |
10-4 |
4 |
6 |
|
5 |
т.э 100 |
10-5 |
5 |
5 |
|
6 |
100,1 |
10-4Изб[Ag+] |
6 |
4 |
|
7 |
101, |
10-3 |
7 |
3 |
|
8 |
110 |
10-2 |
8 |
2 |
Способы установления конечной точки титрования в методе аргентометрии. Конечная точка титрования может быть установлена различными способами, получившими название по именам ученых, которые их разработали.
В методе Мора (индикатор — хромат калия) выпадение кирпично-красного осадка Ag2CrO4 начинается только после того, как закончится осаждение AgCl (AgBr), так как для достижения его произведения растворимости требуется большая концентрация ионов Ag+.
В методе Фольгарда используют реакцию взаимодействия ионов Ag+ с тиоцианатом, титрование обратное. В этом методе к анализируемому раствору галогенида добавляют избыток титрованного раствора AgNO3 и не вошедшее в реакцию количество Ag+ оттитровывают тиоцианатом калия или аммония в присутствии ионов железа:Ag+ + SCN- = AgSCN ¯
Как только все ионы Ag+ будут связаны, индикатор Fe3+ реагирует с избытком титранта с появлением красного окрашивания:Fe3+ + SCN- <=> Fe(SCN)2+
Метод Фаянса (адсорбционные индикаторы) основан на свойстве осадков солей серебра образовывать коллоидные частицы. В первую очередь на осадке адсорбируются ионы, одноименные с осадком, т.е. до точки эквивалентности в избытке находятся определяемые ионы (Cl- Br-), которые и будут преимущественно адсорбироваться. После точки эквивалентности на осадке будут адсорбироваться избыточные ионы Ag+ и для нейтрализации положительного заряда осадка из раствора будут притягиваться отрицательно заряженные ионы, в том числе анионы индикатора. Ионы индикатора (флуоресцеин, эозин), адсорбируясь, меняют цвет.
Возможность дифференцированного титрования галогенид-ионов.
Титрование сразу нескольких галогенид ионов возможно, на кривой титрования будут отмечаться характерные скачки и осадки будут выпадать в разное время.
Аргентометрия – метод осадительного титрования, который базируется на реакциях образования трудно растворимых солей Аргентума: X- + Ag+ = Ag¯, где X- = Cl-, Br-, I-, CN-, SCN- и др.
Титрант: AgNO3 – вторичный стандартный раствор.Стандартизация: за первичным стандартным раствором натрий хлорида NaCl:AgNO3 + NaCl = AgCl¯ + NaNO3.
Индикатором при стандартизацииесть 5 % калий хромат K2CrО4. Титрование проводят до появления коричнево-красного осадка аргентум хромата: 2AgNO3+ K2CrО4 = Ag2CrО4¯+ 2KNO3.
В зависимости от способа проведения титрования и используемого индикатора методы аргентометрии классифицируют на:
Безиндикаторные:- метод Гей-Люссака- метод до точки просветления
Индикаторные: - метод Мора- метод Фаянса - Фишера - Ходакова- метод Фольгарда
Метод Мора.
Титрант:AgNO3– втор. станд. раствор.
Стандартизацияза перв. станд. раствором натрий хлорида NaCl методом пипетирования:AgNO3+ NaCl = AgCl¯+ NaNO3.
Индикатороместь 5 % калий хромат K2CrО4(до появления коричнево-красного аргентум хромата):2AgNO3+ K2CrО4 = Ag2CrО4¯+ 2KNO3.
Определяемые вещества:хлориды Cl-, бромиды Br-.
Среда:рН~ 6,5-10,3.Применение:количественное определение натрий хлорида, калий хлорида, натрий бромида, калий бромида в субстанция лекарственных веществ.
Ограничения применения:
1.Нельзя титровать кислые растворы: 2CrО42-+ 2H+= Cr2O72-+ H2O.
2.Нельзя титровать в присутствии аммиака и других ионов, молекул, которые могут выступать лигандами по отношению к ионам аргентума в реакциях комплексообразования.
3/Нельзя титровать в присутствии многих катионов (Ba2+, Pb2+, и др.), которые образуют окрашенные осадки с хромат - ионами CrО42-.
4.Нельзя титровать в присутствии восстановителей, которые реагируют с хромат-ионами CrО42-, превращая их в ионы Cr3+.
5.Нельзя титровать в присутствии многих анионов (PO43-, AsО43-, AsО33-, S2-и др.), которые с ионами аргентума образуют окрашенные осадки аргентума.
Метод Фаянса-Фишера-Ходакова
Титрант:AgNO3– втор. станд. раствор.
Стандартизацияза перв. станд. раствором натрий хлорида NaCl методом пипетирования:AgNO3+ NaCl = AgCl¯+ NaNO3.
Индикаторомпри стандартизацииесть 5 % раствор калий хромата K2CrО4 (до появления коричнево-красного осадка аргентум хромата): 2AgNO3+ K2CrО4 = Ag2CrО4¯+ 2KNO3.Среда:рН~ 6,5-10,3 при определении хлоридов и рН~ 2,0-10,3 при определении бромидов и йодидов.Индикаторы метода:- флуоресцеин при определении хлоридов;- эозин при определении бромидов и йодидов.
Условия проведения титрования:
1. Кислотность растворов 2. Концентрация реагирующих растворов 3.Учет адсорбционной способности индикаторов и присутствующих в растворе ионов.4.Титрование вблизи т.э. следует проводить медленно5. Титрование с адсорбционными индикаторами проводят в рассеянном свете.
Применение:количественное определение хлоридов, бромидов, йодидов, тиоцианатов, цианидов.
Метод Фольгарда
Титранты:AgNO3, аммоний или калий тиоцианат NH4SCN, KSCN - вторичные стандартные растворы.
СтандартизацияAgNO3за перв. станд. раствором NaCl методом пипетирования:AgNO3+ NaCl = AgCl¯+ NaNO3.
Индикаторомпри стандартизацииAgNO3 есть 5 % раствор калий хромата K2CrО4 (до появления коричнево-красного осадка аргентум хромата):2AgNO3+ K2CrО4 = Ag2CrО4¯+ 2KNO3.
СтандартизацияNH4SCN, KSCN за стандартным раствором AgNO3: AgNO3+ NH4SCN = AgSCN¯+ NH4NO3.
Индикатором при стандартизацииаммоний или калий тиоцианата являются соли ферума (ІІІ) (например, NH4Fe(SO4)2×12H2O в присутствии нитратной кислоты):Fe3++ SCN-= [Fe(SCN)]2+.
Титруют до появления слабо розовой окраски.
Среда:нитратнокислая.Индикаторы метода: соли ферума (ІІІ) NH4Fe(SO4)2×12H2O в присутствии нитратной кислоты.
Определяемые вещества:галогенид-ионы, цианиды, тиоцианаты, сульфиды, карбонаты, хроматы, оксалаты, арсенаты и др.
Hal- + Ag+(избыток) = AgHal¯
Ag+(остаток) + SCN-= AgSCN¯,
а после точки эквивалентности: Fe3++ SCN-= [Fe(SCN)]2+.(розово-красная окраска)
!!!При определениийодидовиндикатор прибавляют в конце титрования, во избежание параллельной реакции:2Fe3++ 2I-= 2Fe2++ I2.
Преимущества метода Фольгарда– возможность титрования:
· в очень кислых растворах;
· в присутствии многих катионов, которые мешали при определении по методу Мора (катионы бария, плюмбума и др., которые образовывали окрашенные осадки хроматов).
35. Титриметрическое определение серебра в сплавах. Титранты, стандартизация растворов, первичные и вторичные стандарты. Кривая титрования серебра раствором тиоцианата аммония. Способы установления конечной точки титрования.
Метод основан на образовании серебром с роданидом аммония труднорастворимой соли белого цвета. Первая лишняя капля раствора роданида аммония реагирует с железоаммонийными квасцами, образуя роданид железа красного цвета.
Метод основан на растворении навески сплава серебра в азотной кислоте и последующем титровании азотнокислого раствора 0,1 н. раствором роданида аммония в присутствии железо-аммонийных квасцов в качестве индикатора:
![]()
![]()
Рассчитанную навеску сплава отвешивают на часовом стекле сначала на технических, а затем на аналитических весах, помещают ее в фарфоровую чашку и растворяют в умеренно разбавленной азотной кислоты. Во время растворения чашку накрывают часовым стеклом, помещенным стеклянный треугольник. Растворение ведут при нагревании на водяной бане в вытяжном шкафу. После растворения сплава содержимое чашки выпаривают до полного удаления окислов азота, затем разбавляют дистиллированной воды и фильтруют в мерную колбу емкостью.Фильтр тщательно промывают водой. Объем раствора доводят дистиллированной водой до метки и содержимое колбы перемешивают. Следует иметь в виду, что в присутствии продуктов восстановления азотной кислоты (окислов азота и) титрование приводит к искаженным результатам вследствие окисления и образования окрашенного в красный цвет продукта взаимодействия. Поэтому удаление окисидов азота необходимо проводить очень тщательно. Для титрования отбирают пипеткой из мерной колбы аликвотное количество полученного раствора, помещают в коническую колбу, добавляют индикатора и титруют роданидом аммония до появления неисчезающего красного окрашивания. Определение заканчивают тогда, когда получают три сходящихся результата. В присутствии в анализируемом сплаве меди титруемый раствор окрашивается в синий цвет. Поэтому для более точного определения серебра применяют «свидетель». Титрант-роданид аммония. 0,1 М NН4SCN.
Стандартизация раствора
Приготовление стандартизированного раствор тиоцианата аммония.
Раствор NH 4 SCN или KSCN с точно известным титром нельзя приготовить растворением навески, так как эти соли очень гигроскопичны. Поэтому готовят раствор с приблизительной нормальной .концентрацией и устанавливают ее по стандартизированному раствору нитрата серебра. Индикатором служит насыщенный раствор NH 4 Fe ( SO 4 )2 - 12Н2 О. Чтобы предупредить гидролиз соли Fe , к самому индикатору и к анализируемому раствору прибавляют перед титрованием 6 н. азотную кислоту.
Приготовление 100 мл приблизительно 0,05 н. раствора тиоцианата аммония. Эквивалентная масса NH 4 SCN равна его молярной массе, т. е. 76,12 г/моль. Поэтому 0,1 л 0,05 н. раствора должны содержать 76,12.0,05-0,1=0,3806 г NH 4 SCN .
Возьмите на аналитических весах навеску около 0,3—0,4 г, перенесите в колбу вместимостью 100 мл, растворите, доведите объем раствора водой до метки и перемешайте.
Стандартизация раствора тиоцианата аммония по нитрату серебра. Подготовьте бюретку для титрования раствором NH 4 SCN . Ополосните пипетку раствором нитрата серебра и отмерьте 10,00мл его в коническую колбу. Добавьте 1 мл раствора NH 4 Fe ( SO 4 )2 (индикатор) и 3 мл. 6 н. азотной кислоты. Медленно, при непрерывном взбалтывании, приливайте из бюретки раствор NH 4 SCN . Титрование прекратите после появления коричнево-розовой окраски [ Fe ( SCN )]2 +, не исчезающей при энергичном встряхивании.
Повторите титрование 2—3 раза, из сходящихся отсчетов возьмите среднее и вычислите нормальную концентрацию NH 4 SCN .
Допустим, что на титрование 10,00 мл 0,02043 н. раствора нитрата серебра пошло в среднем 4,10 мл раствора NH 4 SCN .
Кривая титрования серебра раствором тиоцианата аммония
Способы установления конечной точки титрования.
36. Сущность меркурометрии. Титранты, стандартизация растворов, первичные и вторичные растворы. Кривая меркурометрического титрования хлорида натрия. Индикаторы. Условия меркурометрического титрования галогенид-ионов.
Меркурометрия основана на реакции
образования малорастворимых соединений
ртути(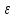 ):Hg2 2++ 2Г-=Hg2X2, где Г-Cl, Br, I, SCN.
):Hg2 2++ 2Г-=Hg2X2, где Г-Cl, Br, I, SCN.
Рабочим раствором является титрованный
раствор нитрата ртути(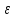 ).
).
Преимущества метода меркурометрического титрования:
Соли являются более нерастворимые, поэтому точность и чувствительность титрования высшие, а скачок титрования на кривой значительно больше.
Возможность определения галогенидов в сильнокислых средах.
Титрант более дешевый.
Возможность проведения титрований с индикатором дифенилкарбазоном в мутных и окрашенных растворах.
Недостатком являетсяиспользование сильно ядовитой соли ртути(1).
Индикаторы:дифенилкарбазон, дифенимкарбазид, которые в конечной точке титрования дают сине-фиолетовое окрашивание осадка или раствора тиоционата железа до исчезновения окраски от избыточной каплиHg2(NO3)2.
Стандартизация: стандартным раствором NaCl:
Определяемые вещества: хлориды и йодиды.
Среда:очень кислая Hg2(NO3)2 + 2NaCl = Hg2Cl2¯ + 2NaNO3
Кривая меркурометрического титрования хлорида натрия.
Рассмотрим титрование 100 мл 0.1 н р-ра NaClраствором 0.1нHg2(NO3)2
2NaCl + Hg2(NO3)2 =2 NaNO3 + Hg2Cl2
До начала титрования концентрация Cl- равна концентрацииNaCl
[Cl-] = C(NaCl) pCl = -lg C(NaCl) = -lg 0.1 = 1
До точки эквивалентности (ТЭ)
[Cl-]
=
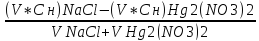 =
=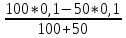 =
0,033
=
0,033
pCl = - lg[Cl-] = 1,48
В ТЭ концентрацию Cl- вычисляют из произведения растворимостиHg2Cl2 = 1,3*10(-19)
[Cl-]
=
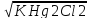 = 3.6*10(-10)
= 3.6*10(-10)
pCl = -0,5 lg K Hg2Cl2 = 9,44
В процессе титрования после ТЭ концентрация Cl- мала и ее рассчитывают изK(Hg2Cl2), с учетом избыточного содержанияHg2 2+ в растворе
[hg2
2+] =
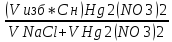 =
=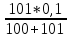 =
0,05
=
0,05
[Cl-]=
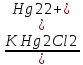 =
=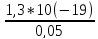 = 2,6*10(-18)
= 2,6*10(-18)
pCl = -lg 2,6*10(-18) = 17.59
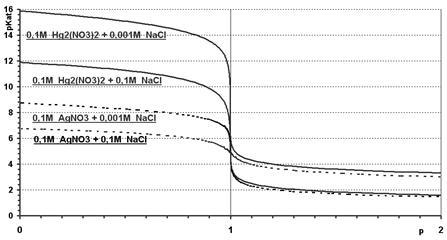
Условия меркурометрического титрования галогенид-ионов.
1)среда анализируемого раствора должна быть кислая, для этого раствор подкисляют азотной кислотой, чтобы предотвратить гидролиз титранта
2)титрование следует проводить при энергичном перемешивании раствора для уменьшения ошибки адсорбции
По методу меркурометрии можно определить хлорид, бромид ионы. Определению не мешают катионы аммония, щелочных и щелочноземельных металлов.
Определению мешают:
А)сульфат-ионы их следует устранять, осаждая избытком бария нитрата
Б)ионы железа(3) их связывают в прочные комплексы, добавляя избыток фторид или фосфат ионов
В) дихромат и перманганат ионы, из необходимо восстановить водорода пероксидом
Г)сульфит и сульфид ионы следует предварительно окислять пероксидом водорода
Методом меркурометрии нельзя определить йодид-ион, так как образующийся осадок Hg2l2 разлагается. Меркурометрический метод анализа имеет преимущества перед аргентометрическим методом:
Галогениды ртути(1) менее растворимы, чем ответствующие соли серебра, поэтому конечная точка титрования в методе меркурометрии фиксируется более четко
Он исключает использование дорогостоящих солей серебра
Основной недостаток меркурометрического метода- соли ртути(1) ядовиты. При работе с ними необходимо соблюдать правила работы с ядовитыми веществами
Основная методическая ошибка всех методов осадительного титрования- при фиксировании конечной точки титровании раствор заведомо перетитровывают
Меркурометрический метод объёмного анализа основан на применении в качестве титрованного раствора солей окисной ртути (меркурии-ионов
37. Современные инструментальные методы анализа. Классификация методов. Их преимущества и недостатки. Методы анализа, основанные на взаимодействии вещества с электромагнитным излучением. Методы анализа, основанные на измерении электрических и магнитных свойств вещества.
Инструментальными методами являются физические и физико-химические методы анализа. Они отличаются большой чувствительностью и быстротой выполнения аналитических определений. При выполнении анализа во многих случаях отпадает необходимость отделения определяемых компонентов от других составных частей анализируемого вещества.
Классические химические и физико-химические методы анализа основаны на той или иной химической реакции. В физических методах анализа химические реакции отсутствуют или имеют второстепенное значение. Характерная особенность физических методов анализа заключается в том, что в них непосредственно измеряют какие-либо физические параметры системы, связанные с количеством определяемого элемента, без предварительного проведения химической реакции.
Общим для физических и физико-химических методов анализа является применение более или менее сложной аппаратуры для измерения оптических, электрических и других свойств вещества. В связи с этим названные методы часто объединяют под общим названием – инструментальныеметоды.
Классификация физических и физикохимических методов анализа. Эта классификация основана на учете измеряемых физических и физико-химических свойств вещества или изучаемой системе.
Оптические методы основаны на измерении оптических свойств веществ.
Хроматографические методыоснованы на использовании способности различных веществ к избирательной сорбции.
Электрохимичекие методыоснованы на измерении электрохимических свойств систем.
Радиометрические методыоснованы на изимерении радиоактивных свойств вещества.
Термические методыоснованы на измерении тепловых эффектов соответствующих процессов.
Масс-спектроскопическиеоснованы на изучении ионизированных фрагментов веществ.
Общие достоинтсва и недостатки физических и физико-химических методов анализа.
Достоинства:
а)низкий предел обнаружения(1-10-9мкг)и малая предельная концетрация(до 10-12г/мл)определяемого вещества.
б)быстрота анализа
в)высокая чувствительность
г) высокая селективность методов.
д) Малая продолжительность проведения анализов, возможность их автоматизации и компьютеризации.
К недостаткам
а) воспроизводимость результатов оказывается хуже, чем при использовании классических химических методов количественного анализа - таких, как гравиметрия и титриметрия.
б) Погрешности определений с использованием физических и физико-химических методов анализа часто составляют около ±5% (а в ряде случаев - до ±20%), в то время как в классическом химическом анализе (гравиметрия, титриметрия) они обычно не превышают±(0,1-0,5)%. в) Сложность применяемой аппаратуры, ее высокая стоимость.
Методы анализа, основанные на взаимодействии вещества с электромагнитным излучением.
Спектроскопические методы- методы анализа, основанные на взаимодействии вещества с электромагнитным излучением.
1.Пламенно-фотометрический метод.
Анализируемый раствор распыляют в пламени газовой горелки. Под влиянием температуры атомы переходят в возбужденное состояние. Обратный переход электронов на основной энергетический уровень сопровождается излучением, длина волны которого зависит от того, атомы какого элемента находились в пламени. Интенсивность излучения при определенных условиях пропорциональна количеству атомов элемента в пламени, а длина волны излучения характеризует качественный состав пробы.
Пламенно-фотометрический метод чаще всего применяют для количественного определения легко возбуждающихся атомов щелочных метало и щелочно-земельных элементов.
2.Атомно-эмиссионный спектральный анализ– физический метод определения химического состава вещества по его спектру, испускаемому возбужденными атомами и молекулами.
Излучение представляет собой сложную смесь световых колебаний самых разнообразных длин волн. Это излучение – эмиссионный спектр – разлагают на составные части специальным прибором – спектрографом. Сравнение положения и интенсивности отдельных линий спектра с линиями соответствующего эталона с точно известным содержанием элемента дает возможность определять качественный и количественный состав.
К числу важнейших особенностей эмиссионного спектрального анализа относится высокая чувствительность определения (10-8г), высокая скорость, универсальность.
