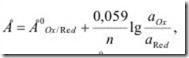- •Развитие физико химических методов анализа. Их достоинства
- •Хроматография, классификация хроматографических методов.
- •Ионообменная хроматография. Сущность метода
- •Характеристика ионитов в ионообменной хроматографии. Емкость ионитов
- •Распределительная хроматография, применение.
- •Бумажная и тонкослойная хроматография. Применение.
- •Осадочная хроматография
- •Адсорбционная газовая хроматография. Основные узлы хроматографа
- •Параметры хроматографического пика. Критерии разделения.
- •Детекторы, используемые в адсорбционной газовой хроматографии
- •Методы абсорбционной спектроскопии. Их сущность
- •Фотометрический метод анализа
- •Законы поглощения излучения.
- •Аппаратурное устройство в фотометрическом методе анализа(нету)
- •Методы определения концентрации веществ в фотометрическом методе анализа.
- •Оптимальные условия фотометрического определения веществ
- •Растворы сравнения.
- •Классификация электрохимических методов анализа
-
Оптимальные условия фотометрического определения веществ
по тетр: 1)аналит.длина волны выб. на максимуме, 2)оптиче. плотность(абсорбция), 3)толщина светополглощающ. слоя,4)чувствительность и точность метода.
Традиционно при прогнозировании возможностей фотометрического определения следов элементов для быстрой сравнительной оценки чувствительности фотометрических реагентов пользуются следующими теоретически рассчитываемыми характеристиками условной чувствительности:
смин — минимальная молярная концентрация элемента в растворе, поддающаяся фотометрическому определению;
m — определяемый минимум;
φ — индекс чувствительности по Сенделу
а — удельное поглощение — условный коэффициент, широко используемый Марченко
Оценочные расчеты смин можно провести на основе уравнения:
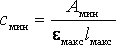
-
Растворы сравнения.
(холостая проба)
Оптич. Плотность =0, в качестве исп: 1)дистил.вода, 2)смесь реагентов без опред.вещ-ва, 3)растворитель,4)р-р с изв.концентр.в диф.методе.
Растворы сравнения (нулевые растворы)
Измерение оптической плотности стандартного и исследуемого окрашенных растворов всегда производят по отношению к раствору сравнения (нулевому раствору). В качестве раствора сравнения можно использовать аликвотную часть исследуемого раствора, содержащего все добавляемые компоненты, кроме реагента, образующего с определяемым ионом окрашенное соединение. В том случае, когда сам реагент имеет окраску, раствор сравнения приготавливают следующим образом: к небольшому количеству дистиллированной воды прибавляют реагент и все компоненты (кроме определяемого) в тех же количествах, что и при приготовлении окрашенных растворов определяемого вещества. Затем раствор доводят водой до требуемого объема и перемешивают. Если добавляемый реагент и все остальные компоненты раствора сравнения бесцветны и, следовательно, не поглощают лучей в видимой области спектра, то в качестве раствора сравнения можно использовать дистиллированную воду.
При небольшом избытке реагента оптические плотности растворов окрашенного комплекса и чистого реагента целесообразнее измерять отдельно по отношению к чистому растворителю и затем косвенным приемом определить оптическую плотность DА, обусловленную поглощением только анализируемого комплекса.
-
Классификация электрохимических методов анализа
Программа спецкурса
|
Электрохимические методы обнаружения и определения, их роль в аналитической химии. Основные электрические параметры, взаимосвязь между ними и аналитическим сигналом. Электрохимические реакции и их особенности. Влияние двойного электрического слоя на параметры электродного процесса. Возможность использования явлений в двойном электрическом слое в аналитических целях. Отличие электрохимической реакции от химической. Электрохимическая цепь. Перенапряжение. Поляризация и виды поляризующих напряжений. Эквивалентные схемы электролизной ячейки и их связь с электрохимическими методами. Классификации методов. Равновесные и неравновесные явления в растворах электролитов. Диффузия, миграция, изменения состава исследуемого раствора. Кондуктометрия и диэлектрометрия. Перенос электрического заряда и проводимость. Прямая кондуктометрия и кондуктометрическое титрование. Связь коэффициента диффузии с электрической подвижностью иона. Возникновение диффузионного потенциала. Перенос электрического заряда и проводимость при постоянном токе. Удельная и эквивалентная электропроводность, их связь с концентрацией электролита. Электропроводность в воде, водно-органических и неводных средах. Особенности прямых и титриметрических методов кондуктометрии и диэлектрометрии при переменном токе низкой и высокой частоты. Основные теоретические зависимости. Эквивалентные электрические схемы. Практическое применение кондуктометрических и диэлектрометрических методов. Вольтамперометрические (полярографические) методы Основные закономерности диффузионной кинетики. Линейная и сферическая диффузия – стационарная и нестационарная. Хроноамперометрия, хронопотенциометрия и хроновольтамперометрия. Основные теоретические зависимости. Взаимосвязь параметров с полезным сигналом. Общность методов при использовании понятия кинетического параметра. Кривые поляризации. Обратимые и необратимые электродные процессы. Фарадеевские и нефарадеевские токи. Аналитический сигнал и помеха. Критерии диффузионного контроля аналитических процессов. Влияние помех на полезный сигнал. Миграционные, конвекционные (конвективные), емкостные токи. Максимумы на вольтамперных кривых, их использование в анализе. Влияние на поляризационные кривые предшествующих и последующих химических реакций (кинетические и каталитические электрохимические процессы), адсорбционные процессы. Теория и аналитическое применение. Постоянно-токовые инверсионные электрохимические методы вольтамперометрии и хронопотенциометрии. Импульсные методы и методы переменно-токовой вольтамперометрии первого и второго порядка: прямые и инверсионные методы. Применение электрохимических методов для исследования электродных процессов. Использование полученной информации при разработке высокочувствительных и селективных методик электрохимического анализа. Амперометрические варианты вольтамперометрии. Амперометрия с одним и двумя поляризованными электродами. Вращающийся и вибрирующий твердые электроды. Зависимость величины диффузионного тока от концентрации деполяризатора для вращающегося дискового электрода. Применение дисковых электродов в электрохимических исследованиях и химическом анализе. Потенциометрические методы Потенциометрия в отсутствие тока и с использованием поляризованных электродов (потенциометрия при контролируемом постоянном токе). Электрохимические цепи с переносом и без переноса. Электродные системы. Диффузионный потенциал и измерение ЭДС. Прямая потенциометрия – рН-метрия и ионометрия. Различия в механизме переноса для твердых и жидкофазных мембран, параметры селективности. Унифицированная модель уравнения мембранного потенциала. Классификац ия ио носелективных электродов и их практическое применение. Измерения в водных и неводных средах. Потенциометрическое титрование с одним и двумя поляризованными электродами. Титрование обратимых и необратимых редокс-систем. Титрование в неводных средах. Потенциал полунейтрализации как химико-аналитическая характеристика электролитов. Выбор растворителя. Способы обнаружения конечной точки титрования. Требования, предъявляемые к индикаторным реакциям, при дифференцированном титровании нескольких компонентов смеси. Выбор величины тока и вида поляризации электродов в потенциометрии при постоянном токе. Метод непрерывного титрования (проточная потенциометрия). Кулонометрические методы Теоретические основы кулонометрических методов анализа и их классификация. Потенциостатическая и амперостатическая (гальваностатическая) кулонометрия, условия выполнения этих вариантов кулонометрического метода. Эффективность тока (выход по току) и ее определение. Методы обнаружения момента завершения электрохимической и химической реакции. Определение количества электричества, прошедшего через ячейку в процессе электролиза. Преимущества и ограничения кулонометрических методов анализа. Определение электроактивных и электронеактивных компонентов. Способы генерирования кулонометрических титрантов. Инверсионная кулонометрия твердых фаз, кулонометрия с разверткой потенциала и непрерывным изменением тока, субстехиометрическая и дифференциальная прецизионная кулонометрия, непрерывный кулонометрический анализ. Развитие и совершенствование электрохимических методов Использование ЭВМ и микропроцессорной техники для автоматизации вольтамперометрических измерений. Измерения аналитического сигнала в стационарных условиях и в потоке. Принципы электрохимического детектирования вещества и условия его осуществления. Электрохимические датчики, детекторы и устройства. Сенсоры. Принципы конструирования электроаналитической аппаратуры.
Потенциометрический метод , основанный на измерении электродвижущих сил (э.д..с) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико-химических величин . В потенциометрии обычно применяют гальванический элемент, включающий два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса ) или в два различных по составу раствора , имеющих между собой жидкостной контакт (цепь с переносом). Электрод, потенциал которого зависит от активности (концентрации) определенных ионов в растворе , называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод , потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения. В потенциометрии используют два основных класса индикаторных электродов: 1. Электроды, на межфазных границах которых протекают реакции с участием электронов. Такие электроды называют электронообменными. Их функционирование основано на зависимости равновесного потенциала от состава и концентрации исследуемого раствора , описываемой уравнением Нернста:
где Е – равновесный потенциал; Е0 – стандартный потенциал, равный равновесному, если активности всех участвующих в электрохимической реакции компонентов равны единице; n – число электронов, участвующих в полуреакции. В основном это активные металлические электроды I рода (серебряный , медный , кадмиевый и др.) и инертные электроды (платиновый , золотой). 2. Электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными или ионообменными, а также ионоселективными (ИСЭ). Потенциал системы, состоящей из внешнего электрода сравнения и ИСЭ, погруженных в исследуемый раствор, описывается модифицированным уравнением Нернста (уравнение Никольского-Эйзенмана):
где const – константа, зависящая от значений стандартных потенциалов внутреннего и внешнего электродов сравнения и от природы мембраны ИСЭ; ai и zi, ak и zk – активности и заряды основного (потенциалопределяющего) и постороннего ионов соответственно; ki/kпот– потенциометрический коэффициент селективности ИСЭ по отношению к потенциалопределяющему иону (i) в присутствии постороннего иона (k). Классификация потенциометрических методов анализа. Различают прямую потенциометрию (ионометрию ) – непосредственное измерение равновесного потенциала и нахождение активности ионов в растворе , и косвенную – потенциометрическое титрование – регистрация изменения потенциала в процессе химической реакции между определяемым веществом и титрантом. В потенциометрическом титровании используют реакции основных типов: кислотно-основные , окислительно-восстановительные и комплексообразования, а также прцессы осаждения. Индикаторный электрод выбирают в зависимости от типа химической реакции и природы потенциалопределяющих ионов.
Прямая потенциометрия основана на точном измерении величины равновесного электродного потенциала и нахождению по уравнению Нернста активности потенциалопределяющего иона в растворе. Прямая потенциометрия на основе металлических электродов кроме аналитических целей широко применяется для определения таких важнейших характеристик, как коэффициенты активности электролитов, энтальпия, энтропия и свободная энергия реакций, константы различных равновесий ионизации, комплексообразования, произведение растворимости, число электронов, участвующих в электрохимической реакции. Метод прямой потенциометрии основан на точном измерении величины электродного потенциала и нахождении по уравнению Нернста активности потенциалопределяющего иона в растворе. Долгое время прямая потенциометрия находила ограниченное применение, в аналитической химии, а именно только для определения рН растворов. Метод прямой потенциометрии обладает некоторыми важными достоинствами. В процессе измерения компоненты анализируемого раствора не разлагаются. Метод позволяет проводить определение из маленького объема, дает возможность работать с относительно разбавленными растворами. Полученные результаты легко регистрируются автоматически, что позволяет использовать прямую потенциометрию для контроля технологических процессов и биологических систем. Следует различать метод прямой потенциометрии и метод потенциометрического титрования. Во втором методе определяемое вещество титруют подходящим рабочим раствором, измеряя в процессе титрования потенциал какого-либо электрода. Этот метод относится к химическим методам анализа, так как он основан на проведении химической реакции в растворе. В методе же прямой потенциометрии химическую реакцию не проводят: измеряют потенциал электрода, погруженного в испытуемый раствор, и затем по соответствующему уравнению вычисляют концентрацию определяемых ионов. Наиболее распространенный метод прямой потенциометрии - определение рН раствором посредством стеклянного или какого-либо другого электрода.
Потенциометрическое титрование основано на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым компонентом и титрантом. Конечную точку титрования (к.т.т.) находят по скачку потенциала, отвечающему моменту завершения реакции.Потенциометрическая индикация к.т.т., как и визуальная, преследует чисто прикладную цель – количественное определение содержания анализируемого вещества. Но по сравнению с последней потенциометрический метод обладает рядом несомненных преимуществ: 1) как инструментальный метод исключает субъективные ошибки, связанные с визуальным установлением к.т.т .; 2) более чувствителен , т.е. при той же величине погрешности можно снизить нижний предел определяемых концентраций; 3) позволяет осуществлять титрование в мутных и окрашенных средах; 4) дает возможность при определенных условиях дифференцированно (последовательно) определять компоненты из одной пробы; 5) легко поддается автоматизации процесса титрования. К недостаткам потенциометрического титрования можно отнести не всегда быстрое установление потенциала после добавления титранта и необходимость во многих случаях проводить при титровании большое количество отсчетов. Виды потенциометрического титрования . Подобно титриметрии с визуальным обнаружением к.т .т ., в потенциометрии могут быть использованы все четыре типа химических реакций: кислотно-основные , осаждения, комплексообразования и окисления- восстановления. К химическим реакциям , применяемым в потенциометрическом титровании, предъявляют те же требования, что и в обычном титриметрическом методе. Методы потенциометрического титрования. В области к.т.т. происходит замена электрохимической (индикаторной) реакции на другую, что сопровождается скачком потенциала. Исходя из различной степени поляризации электродов и характера обратимости исследуемых систем , можно рекомендовать преимущественное применение в каждом конкретном случае одного из двух методов потенциометрического титрования: - для определения компонентов обратимых систем успешно применяется классическая потенциометрия в отсутствии тока в цепи; - для необратимых систем (или когда в испытуемом растворе присутствует лишь один компонент обратимой системы в отсутствии сопряженной формы) более приемлема потенциометрия с контролируемым током. Кислотно-основное титрование. В кислотно-основном титровании в качестве индикаторного обычно используют стеклянный электрод, как правило, входящий в комплект серийно выпускаемых промышленностью pH-метров. Потенциометрический метод позволяет провести количественное определение компонентов в смеси кислот, если константы диссоциации различаются не менее чем на три порядка. Например, при титровании смеси, содержащей хлороводородную (HCl) и уксусную кислоты, на кривой титрования обнаруживается два скачка. Первый свидетельствует об окончании титрования HCl, второй скачок наблюдается при оттитровывании уксусной кислоты. Также несколько скачков имеют кривые титрования многоосновных кислот, константы диссоциации которых существенно различаются (хромовая, фосфорная и др.).Широкие возможности анализа многокомпонентных смесей без разделения открывает применение неводных растворителей. Например, определение содержания хлороводородной и монохлоруксусной кислот в смеси титрованием водного раствора является сложной задачей в связи с трудностью обнаружения двух скачков титрования. При титровании в ацетоне оба скачка выражены достаточно четко и содержание каждой кислоты в смеси может быть рассчитано. Комплексонометрическое титрование. Потенциометрическое титрование катионов комплексоном III (ЭДТА) можно проводить с использованием в качестве индикаторного электрода соответствующего металла: титрование солей меди с медным электродом, солей цинка с цинковым и т.д. или подходящего ионоселективного электрода. Однако, многие металлические индикаторные электроды необратимы, а число ионоселективных электродов невелико.Для комплексонометрических титрований может быть использован универсальный электрод Hg|HgY2- или Au(Hg)|HgY2- где Au(Hg) - амальгамированное золото; HgY2- - комплекс ртути с анионом этилендиаминтетрауксусной кислоты. С помощью ртутного электрода этого типа могут быть оттитрованы любые ионы, которые образуют с Y4- комплексы с константой устойчивости, не превышающей константу устойчивости ртутного комплекса. Это, например, ионы магния (Mg2+), кальция (Ca2+), кобальта (Co2+), никеля (Ni2+), меди (Cu2+), цинка (Zn2+) и др.
Потенциометрический метод, основанный на измерении электро- движущих сил (ЭДС) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико-химических величин. В потенциометрии обычно применяют галь- ванический элемент, включающий два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два раз- личных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом). Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения, в качестве которого используют насыщенный каломельный и хлорсеребряный электроды. В потенциометрическом методе анализа используют два основных класса электродов: 1. Электронообменные электроды, на межфазных границах которых протекают реакции с участием электронов. 2. Мембранные или ионообменные, их называют также ионоселек-тивными электроды, на межфазных границах которых протекают ионо-обменные реакции. Различают два вида потенциометрических измерений: 1) прямая по- тенциометрия – определение концентрации ионов, в частности [H+], с по- мощью уравнения Нернста по ЭДС гальванического элемента. Самое из- вестное приложение этого вида – рН-метрия; 2) потенциометрическое титрование основано на использовании измерений электродных потенциалов для нахождения точки эквивалентности в различных реакциях. Аппаратура для проведения прямой потенциометрии и потенциометрического титрования одна и та же. В схему потенциометрических измерений входят индикаторный электрод, электрод сравнения и потенциало- измеряющий прибор. В качестве последних используют различные рН-метры. Перед измерением рН проводят настройку приборов по буфер- ным растворам. Потенциометрический анализ широко применяют для непосредст- венного определения активности ионов, находящихся в растворе (прямая потенциометрия – ионометрия), а также для индикации точки эквивалент- ности при титровании по изменению потенциала индикаторного электро- да в ходе титрования (потенциометрическое титрование). При потенцио- метрическом титровании могут быть использованы следующие типы хи- мических реакций, в ходе которых изменяется концентрация потенциало- пределяющих ионов: реакции кислотно-основного взаимодействия, реакция окисления-восстановления, реакция осаждения и комплексообразования. Результаты определения методом потенциометрического титрования более точны, чем при использовании прямой потенциометрии, так как в этом случае вблизи точки эквивалентности небольшому изменению концентрации соответствует большое изменение потенциала индикаторного электрода. В ходе титрования измеряют и записывают ЭДС ячейки после добавления каждой порции титранта. Вначале титрант добавляют не- большими порциями, при приближении к конечной точке (резкое изменение потенциала при добавлении небольшой порции реагента) порции уменьшают. Для определения конечной точки потенциометрического титрования можно использовать различные способы. Наиболее простой способ состоит в построении кривой титрования – графика зависимости потенциала электрода от объёма титранта. Другой способ состоит в расчёте изменения потенциала на единицу изменения объёма реагента pH V Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит[уточнить] от концентрации ионов Н+в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция: 2Н+ + 2e− = H2 то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции. ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых другихионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Методы эмиссионного спектрального анализа основаны на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Методы эмиссионного спектрального анализа используются во многих областях науки и техники и в различных отраслях народного хозяйства. Этим методом выполняется значительная часть анализов в металлургической промышленности. Анализируется исходное сырье и готовая продукция. Особое значение имеет спектрально-аналитический контроль за ходом плавки, на основании которого вносятся оперативные изменения в ход технологического процесса, например по содержанию легирующих и других добавок. Визуальный спектральный анализ оказался очень удобным методом сортировки вторичного сырья металлургического производства, позволяя за несколько минут установить тип сплава или марку стали, что необходимо при составлении или корректировке шихты. Методы эмиссионного спектрального анализа основаны на измерении длины волны, интенсивности и других характеристик света, излучаемого газообразными атомами вещества. Возникновение спектрального анализа как метода определения химического состава вещества относится к 1860 г., когда была опубликована работа Кирхгофа и Бунзена: Химический анализ с помощью наблюдения спектра. Теория эмиссионной спектроскопии была разработана значительно позднее. Метод эмиссионного спектрального анализа может быть успешно применен при анализе сплавов с целью идентификации данного сплава и обнаружения в нем составляющих элементов. Проведение анализа без разрушения анализируемого образца выгодно отличает спектральный метод качественного анализа от других методов. Метод эмиссионного спектрального анализа широко применяется для определения ртути в цветных и редких металлах. Для определения ртути в металлах с чувствительностью 1 - 10 - 5 % в большинстве случаев используют угольные электроды обычной формы. Чаще всего определяют ртуть по линии 2536 5 А. В табл. 22 дана общая характеристика методов определения ртути в некоторых металлах с использованием отечественных спектрографов ИСП-22 и ИСП-28. В основе метода лежит термическая возгонка ртути из образцов металла.
Турбидиметрия -метод количественного химического анализа. Принцип метода основан на измерении интенсивности света определённой длины волны, прошедшего через кювету содержащую коллоидный раствор, чаще всего через суспензию, образованную частицами определяемого вещества. Метод очень похож на метод нефелометрии, однако в отличие от него, аналитическим сигналом служит интенсивность не рассеянного света, а прошедшего. Турбидиметрическое титрование — определение концентрации вещества в растворе по максимуму помутнения на кривой титрования раствора каким-либо коагулянтом. Для турбидиметрических измерений можно использовать любой фотометр или спектрофотометр. Применение
Из-за малой точности турбидиметрия используется только для определения компонентов, для которых нет удовлетворительных фотометрических и других методов анализа.
Нефелометрия — метод исследования и анализа вещества по интенсивности светового потока, рассеиваемого взвешенными частицами данного вещества. Интенсивность рассеянного светового потока зависит от множества факторов, в частности от концентрации частиц в анализируемой пробе. Большое значение при нефелометрии имеетобъём частиц, рассеивающих свет. Важное требование к реакциям, применяемым при нефелометрии, заключается в том, что продукт реакции должен быть практически нерастворим и представлять собой суспензию (взвесь). Для удержания твёрдых частиц во взвешенном состоянии применяются различные стабилизаторы (например, желатин), предотвращающие коагуляцию частиц. Для измерения интенсивности рассеянного света используются специальные приборы — нефелометры. Их действие основано на уравнивании двух световых потоков: одного от рассеивающей взвеси, другого от матового или молочного стеклянного рассеивателя прибора. Один из вариантов нефелометрии — нефелометрическое титрование, в котором растворанализируемого вещества титруют раствором осадителя. В процессе титрования интенсивность рассеянного света увеличивается пропорционально количеству образующихся частиц. В точке эквивалентности рост помутнения прекращается. По излому кривой титрования находят объём затраченного на реакцию осадителя. Погрешность при этом составляет от 5 до 10 %. Применение Нефелометрия используется преимущественно для определения хлоридов (в виде взвеси AgCl), сульфатов (в виде взвеси BaSO4) при анализе различных материалов, например руд,минералов. Нефелометрию также применяют для определения размеров и формы диспергированных частиц, молекулярной массы полимеров, изучения коагуляции.
Рефракто́метр —
прибор, измеряющий показатель
преломления света в среде.
Рефрактометрия -
это метод исследования веществ,
основанный на определении показателя
(коэффициента) преломления (рефракции)
и некоторых его функций. Рефрактометрия
(рефрактометрический метод) применяется
для идентификации химических
соединений, количественного и
структурного анализа, определения
физико-химических параметров веществ.
Показатель преломления n представляет
собой отношение скоростей света в
граничащих средах. Для жидкостей и
твердых тел n обычно определяют
относительно воздуха, а для газов —
относительно вакуума. Значения n
зависят от длины волны λ света и
температуры, которые указывают
соответственно в подстрочном и
надстрочном индексах. Например,
показатель преломления при 20 °C
для D-линии спектра натрия (λ = 589
нм) — В идеальных системах (образующихся без изменения объема и поляризуемости компонентов) зависимость показателя преломления от состава близка к линейной, если состав выражен в объемных долях (процентах) n=n1V1+n2V2 , где n, n1 ,n2 — показатели преломления смеси и компонентов, V1 и V2 — объемные доли компонентов (V1 + V2 = 1). Для рефрактометрии растворов в широких диапазонах концентраций пользуются таблицами или эмпирическими формулами, важнейшие из которых (для растворов сахарозы, этанола и др.) утверждаются международными соглашениями и лежат в основе построения шкал специализированных рефрактометров для анализа промышленной и сельскохозяйственной продукции. Рефрактометры применяются в:
На всех стадиях любого производства осуществляется технический контроль – т.е. проводятся работы по контролю качества продукции в ходе технологического процесса с целью предотвращения брака и обеспечения выпуска продукции, соответствующей ТУ и ГОСТ. Технический анализ делится на общий – анализ веществ, встречающихся на всех предприятиях (H2O, топливо, смазочные материалы) и специальный – анализ всех веществ, встречающихся только на данном предприятии (сырьё, полу продукты, отходы производства, конечный продукт).С этой целью ежедневно тысячи химиков-аналитиков выполняют миллионы анализов, согласно соответствующим Методика анализа – подробное описание выполнения аналитических реакций с указанием условий их выполнения. Её задачей является овладение навыками эксперимента и сущностью аналитических реакций. Методы аналитической химии основаны на различных принципах.
|