
Вьюник. Лекция № 10
.pdf
Молекула Молекулярнi орбiталi Енергетичнi дiаграми
Енергетичнi дiаграми
Двохатомнi гомоядернi молекули
|
|
АО |
МО |
АО |
|
|
АО |
МО |
|
АО |
||||||||
|
|
|
|
σ |
розр |
|
|
|
|
|
|
σ |
розр |
|
|
|
||
E |
|
|
|
z |
|
|
E |
|
|
|
z |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
2p |
πxр |
πyр |
2p |
|
|
2p |
πxр |
πyр |
|
2p |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
σ zзв |
|
|
|
||
|
|
|
|
πxзв |
πyзв |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ zзв |
|
|
|
|
|
|
πxзв |
πyзв |
|
|
|
|||
|
|
|
|
σ розр |
|
|
|
|
|
|
σ |
розр |
|
|
|
|||
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
2s |
|
|
|
|
2s |
|
|
2s |
|
|
|
2s |
||||
|
|
|
|
|
|
|
|
|
|
|
|
σ sзв |
|
|
|
|||
|
|
|
|
σ sзв |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
При значнiй рiзницi енергiї атомних ор- |
При енергетичнiй близькостi 2S та 2P |
|||||||||||||||||
бiталей 2S та 2P O2, F2, (Ne2) |
|
|
орбiталей B2, C2, N2 |
|
|
|
|
|||||||||||
Схема розмiщення АО та МО на енергетичнiй дiаграмi для елементiв 2-го перiоду.
11/23
Молекула |
Молекулярнi орбiталi |
Енергетичнi дiаграми |
Енергетичнi дiаграми
Двохатомнi гомоядернi молекули
Порядок розподiлу e¯по МО: Електрони розподiляються по МО у вiдповiдностi з енергiєю орбiталей, за принципом Паулi i правилом Гунда.
Електронна формула молекули F2:
[(σ1звs)2(σ1рs)2(σ2звs)2(σ2рs)2(σzзв)2(πyзв)2(πxзв)2(πyр)2(πxр)2]
Звичайно в електронних формулах i схемах (на дiаграмах) обмежуються тiльки врахуванням валентних електронiв. Отже в електроннiй формулi фтору буде 14e¯ замiсть 18 e¯.
Електронна формула молекули азоту. (10¯e):
[(σ2звs)2(σ2рs)2(πyзв)2)(πxзв)2(σzзв)2]
Енергiя, довжина та порядок зв‘язку молекул елементiв 2- го перiоду:
12/23

Молекула Молекулярнi орбiталi Енергетичнi дiаграми
Енергетичнi дiаграми
Двохатомнi гомоядернi молекули
MO |
|
|
B2 |
|
|
|
C2 |
|
|
N2 |
|
|
N2+ |
|||||||||||||||||||
σzр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
πр |
,πр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
y |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σзв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
πзв |
,πзв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
y |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σsр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σзв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
1 |
|
|
2 |
|
|
|
3 |
|
|
|
2.5 |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
◦ |
1.59 |
|
1.31 |
|
|
1.10 |
|
|
1.12 |
|
|
||||||||||||||||||||
d,A |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Eдис,Кдж/моль |
288.4 |
|
627 |
|
|
947 |
|
|
828 |
|
|
|||||||||||||||||||||
13/23

Молекула Молекулярнi орбiталi Енергетичнi дiаграми
Енергетичнi дiаграми
Двохатомнi гомоядернi молекули
MO |
|
|
O + |
|
|
|
|
O |
2 |
|
|
|
|
|
|
O – |
|
|
O 2 – |
|
|
|
F |
2 |
|
|
|
|
(Ne) |
2 |
|
|||||||||||||||||||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
σр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
πyр,πxр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
πзв |
,πзв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
y |
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σзв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σзв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
2,5 |
|
|
2 |
|
|
|
|
|
1.5 |
|
|
|
1 |
|
|
|
1 |
|
|
|
0 |
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
◦ |
1.12 |
|
|
1.21 |
|
|
1.26 |
|
|
1.48 |
|
|
1.42 |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
d,A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
Eдис,Кдж/моль |
629 |
|
|
494 |
|
|
394 |
|
|
210 |
|
|
151 |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
14/23

Молекула Молекулярнi орбiталi Енергетичнi дiаграми
Енергетичнi дiаграми
Двохатомнi гомоядернi молекули
D, кДж/моль |
|
|
|
|
|
|
0 |
Be2 |
|
|
|
|
Ne2 |
|
|
|
|
|
|
|
200 |
|
|
|
|
|
F2 |
|
|
B2 |
|
|
|
|
400 |
|
|
|
|
|
|
|
|
|
|
|
O2 |
|
600 |
|
|
C2 |
|
|
|
800 |
|
|
|
|
|
|
|
|
|
|
N2 |
|
|
1000 |
|
|
|
|
|
|
4 |
6 |
8 |
10 |
12 |
14 |
16 |
Число валентних електронів
15/23
Молекула |
Молекулярнi орбiталi |
Енергетичнi дiаграми |
Енергетичнi дiаграми
Магнiтнi властивостi молекул
Магнiтнi властивостi молекул. Характер розподiлу e¯по МО дозволяє пояснити багато властивостей молекул, в тому числi i магнiтнi властивостi.
За магнiтними властивостями розрiзняють парата дiамагнiтнi речовини.
Парамагнiтними є речовини, якi мають неспаренi електрони.
У дiамагнiтних речовин усi e¯ спаренi.
Молекула O2 має два неспаренi e¯- парамагнiтна речовина. Молекула F2 не має неспарених e¯ - дiамагнiтна.
МВЗ не пояснює парамагнiтнi властивостi O2. ММО пояснює забарвлення речовин.
Парамагнiтнi речовини втягуються в магнiтне поле, а дiамагнiтнi ним виштовхуються.
16/23
Молекула |
Молекулярнi орбiталi |
Енергетичнi дiаграми |
Енергетичнi дiаграми
Двохатомнi гетероядернi молекули
Двохатомнi гетероядернi молекули можна описати МО-ЛКАО так же , як i гомоядернi. Рiзниця лише в тому, що в гетероядерних молекулах мова iде про рiзнi атоми, тому енергiя АО та їх вiдносний вклад в формування МО також рiзнi.
Для гетероядерних молекул c1 =6c2 c3 =6c4. ММО враховує поляризацiю хiмiчного зв‘язку c2 > c1.
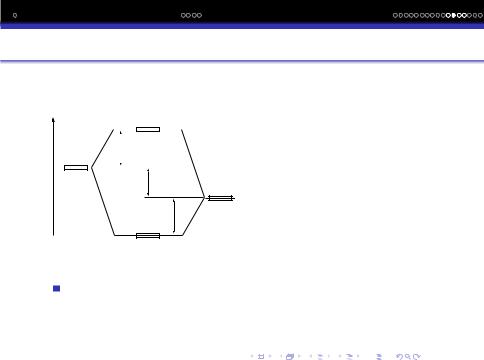
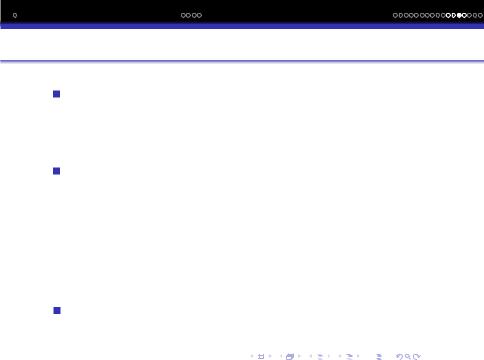
Дiаграма енергетичних рiвнiв гетероядерних молекул 2-го перiоду аналогiчна приведенiй для гомоядерних молекул 2- го перiоду:
17/23
Молекула |
Молекулярнi орбiталi |
Енергетичнi дiаграми |
Енергетичнi дiаграми
Двохатомнi гетероядернi молекули
|
АО |
|
|
МО |
|
АО |
|
E |
|
|
|
|
Ψ% |
|
|
|
|
|
|
|
|
||
|
ψA |
a |
|
|
|
||
|
|
|
|
|
|
|
|
bψB
a
Ψ+
В зв‘язуючу орбiталь бiльший внесок вносить орбiталь бiльш ЕН атома, а в розпушуючу менш ЕН.
18/23
Молекула Молекулярнi орбiталi Енергетичнi дiаграми
Енергетичнi дiаграми
Двохатомнi гетероядернi молекули
Молекула CO, iони CN – , NO + – iзоелектроннi молекулi N2, усi вони мають по 10 валентних e¯. Однакова електронна будова обумовлює схожiсть фiзичних i хiмiчних властивостей оксиду карбону (II) i азоту.
Проте є мiж цими речовинами i рiзниця, яка пояснюється участю рiзного числа електронiв, зокрема з боку оксигену -6e¯,а з боку карбону-4e¯.
Електрон на зв‘язуючих орбiталях бiльшу частину часу проводить бiля ядра бiльш ЕН атома, а на розпушуючiй МО - навкруги ядра менш ЕН атома.
Рiзниця в ЕН визначає полярнiсть зв‘язку.
Величина b є мiрою iонностi зв‘язку, а величина a – мiрою її ковалентностi.
19/23
Молекула |
Молекулярнi орбiталi |
Енергетичнi дiаграми |
Енергетичнi дiаграми
Двохатомнi гетероядернi молекули
ММО дуже широко застосовується для опису рiзних молекулярних систем. Цей метод дає найбiльш загальний пiдхiд до опису усiх хiмiчних сполук (системи з нелокалiзованими зв‘язками, комплекснi сполуки). Цей метод в теоретичнiй хiмiї є домiнуючим.
20/23
