- •Содержание
- •Экономическая часть
- •Тип дипломной научно-исследовательской работы
- •Расчет затрат на выполнение научно-исследовательской работы
- •Расчет затрат на материалы и реактивы
- •Расчет затрат на электроэнергию
- •Расчет затрат на заработную плату работников, участвующих в исследовании
- •Накладные расходы
- •Смета затрат на выполнение дипломной работы
- •Взаимосвязь исследования с предыдущими работами подобного направления
Реферат
В состав ВКР входят:
Пояснительная записка содержит 63 с., 18 рисунков, 7 таблиц, 53 источника;
Презентация 25 слайдов.
ГИДРОХИМИЧЕСКИЙ МЕТОД СИНТЕЗА, КВАНТОВЫЕ ТОЧКИ, СУЛЬФИД СВИНЦА, СУЛЬФИД КАДМИЯ, ТВЕРДЫЙ РАСТВОР, ФОТОННАЯ КОРРЕЛЯЦИОННАЯ СПЕКТРОСКОПИЯ.
Объектом исследования в настоящей работе являлись квантовые точки CdS, PbS и твердого раствора CdS-PbS, полученные гидрохимическим осаждением.
Целью данной выпускной квалификационной работы является получение коллоидных квантовых точек CdS, PbS и в системе CdS-PbS методом гидрохимического синтеза из водных сред, а также исследование их размеров частиц и исследование зависимости люминесценции от размеров.
Достижение указанной цели требует оптимизации реакционной смеси, изучения состава, структуры, размеров частиц и свойств синтезированных коллоидных растворов.
Для комплексного исследования квантовых точек был использован метод фотонной корреляционной спектроскопии. Экспериментальные данные обработаны с применением компьютерной техники и проанализированы.
Содержание
Реферат 3
1.ЛИТЕРАТРНЫЙ ОБЗОР 7
1.1. Понятие «квантовая точка» 7
1.2.Применение квантовых точек 9
1.2.1.Материалы для лазеров 10
1.2.2. Материалы для светодиодов 11
1.2.3.Материалы для солнечных батарей 11
1.2.4.Материалы для полевых транзисторов 13
1.2.5.Использование в качестве биометок 14
1.3. Методы поучения квантовых точек 15
1.4.Свойства квантовых точек 18
1.5.Методы определения размеров частиц 21
1.5.1.Спектрофотометр Photocor Compact 21
2.Методика эксперимента 25
2.1.Гидрохимический метод синтеза 25
2.2.Химические реактивы 27
2.3.Утилизация отработанных растворов 27
2.4.Методика измерения на анализаторе частиц Photocor Compact 28
2.4.1.Основы метода динамического рассеяния света (фотонной корреляционной спектроскопии) 28
3.Экспериментальная часть 30
3.1.Синтез квантовых точек на основе сульфида кадмия 30
3.1.1.Влияние концентрации соли кадмия на размеры частиц КТ CdS 32
3.2.Синтез квантовых точек на основе сульфида свинца 33
3.2.1.Влияние концентрации соли свинца на размеры частиц КТ PbS 34
3.3.Синтез квантовых точек на основе твердого раствора CdS-PbS 35
4.Безопасность жизнедеятельности 39
4.1.Введение в раздел безопасность жизнедеятельности 39
4.2.Вредные и опасные производственные факторы в лаборатории 40
4.2.1.Вредные вещества 40
4.2.2.Параметры микроклимата 42
4.2.3.Вентиляция 43
4.2.4.Шум 44
4.2.5.Освещенность 45
4.2.6.Электробезопасность 46
4.2.7.Пожаробезопасность 47
4.2.8.Чрезвычайные ситуации 48
Выводы по разделу БЖД 49
5.2.4. Расчёт затрат на услуги сторонних организаций 55
Общие выводы 59
Библиографический список 60
Введение
Квантовая точка — фрагмент проводника или полупроводника, носители заряда (электроны или дырки) которого ограничены в пространстве по всем трём измерениям. Размер квантовой точки должен быть настолько мал, чтобы квантовые эффекты были существенными. Это достигается, если кинетическая энергия электрона заметно больше всех других энергетических масштабов: в первую очередь больше температуры, выраженной в энергетических единицах.
Квантовые точки в зависимости от размера и химического состава обладают фотолюминесценцией в видимом и ближнем инфракрасном диапазонах. Благодаря высокой однородности по размерам (более 95%) предлагаемые нанокристаллы обладают узкими спектрами испускания (полуширина пика флуоресценции 20-30 нм), что обеспечивает феноменальную чистоту цвета.
Особый интерес представляют фотолюминесцирующие квантовые точки, в которых поглощение фотона рождает электрон-дырочные пары, а рекомбинация электронов и дырок вызывает флуоресценцию. Такие квантовые точки обладают узким и симметричным пиком флуоресценции, положение которого определяется их размером. Так, в зависимости от размера и состава, КТ могут иметь флуоресценцию в УФ, видимой или ИК-области спектра.
ЛИТЕРАТРНЫЙ ОБЗОР
Понятие «квантовая точка»
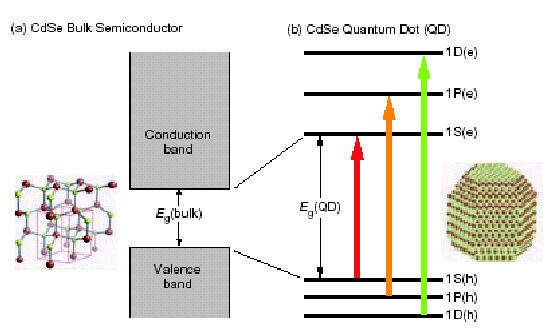
Коллоидные квантовые точки – полупроводниковые нанокристаллы с размером в диапазоне 2-10 нанометров, состоящие из 103 - 105 атомов, созданные на основе неорганических полупроводниковых материалов, покрытые монослоем стабилизатора («шубой» из органических молекул, рис.1). Квантовые точки по своим размерам больше традиционных для химии молекулярных кластеров (~ 1 нм при содержании не больше 100 атомов). Коллоидные квантовые точки объединяют физические и химические свойства молекул с оптоэлектронными свойствами полупроводников [1].
|
|
|
(а) (б)
Рис.1.1 (а) Квантовая точка, покрытой “шубой” стабилизатора, (б) трансформация зонной структуры полупроводника при уменьшении размера.
Квантово-размерные
эффекты играют ключевую роль в
оптоэлектронных свойствах квантовых
точек [2]. Энергетический спектр квантовой
точки принципиально отличается от
объемного полупроводника. Электрон в
нанокристалле ведет себя как в трехмерной
потенциальной “яме”. Имеется несколько
стационарных уровней энергии для
электрона и дырки с характерным
расстоянием между ними
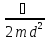 , где d – размер нанокристалла (квантовой
точки) (рис.1б). Таким образом, энергетический
спектр квантовой точки зависит от ее
размера. Аналогично переходу между
уровнями энергии в атоме, при переходе
носителей заряда между энергетическими
уровнями в квантовой точке может
излучаться или поглощаться фотон.
Частотами переходов, т.е. длиной волны
поглощения или люминесценции, легко
управлять, меняя размеры квантовой
точки (рис.2). Поэтому квантовые точки
иногда называют «искусственными
атомами». В терминах полупроводниковых
материалов это можно назвать возможностью
контроля эффективной ширины запрещенной
зоны.
, где d – размер нанокристалла (квантовой
точки) (рис.1б). Таким образом, энергетический
спектр квантовой точки зависит от ее
размера. Аналогично переходу между
уровнями энергии в атоме, при переходе
носителей заряда между энергетическими
уровнями в квантовой точке может
излучаться или поглощаться фотон.
Частотами переходов, т.е. длиной волны
поглощения или люминесценции, легко
управлять, меняя размеры квантовой
точки (рис.2). Поэтому квантовые точки
иногда называют «искусственными
атомами». В терминах полупроводниковых
материалов это можно назвать возможностью
контроля эффективной ширины запрещенной
зоны.
Есть еще одно принципиальное свойство, отличающее коллоидные квантовые точки от традиционных полупроводниковых материалов – возможность существования в виде растворов, или точнее в виде золей. Это свойство обеспечивает широту возможностей манипулирования такими объектами и делает их привлекательными для технологий.
Зависимость энергетического спектра от размера дает огромный потенциал для практического применения квантовых точек. Квантовые точки могут найти применения в оптоэлектрических системах, таких как светоизлучающие диоды и плоские светоизлучающие панели, лазеры, ячейки солнечных батарей и фотоэлектрических преобразователей, как биологические маркеры, т.е. везде, где требуются варьируемые, перестраиваемые по длине волны оптические свойства [1]. На рис. 2 изображен пример люминесценции образцов квантовых точек CdS:

Рис.1.2 Люминесценция образцов квантовых точек CdS с размером в диапазоне 2.0-5.5 нм, приготовленных в виде золей. Вверху – без подсветки, внизу – подсветка ультрафиолетовым излучением.
Применение квантовых точек
Квантовые точки имеют большой потенциал практического применения. В первую очередь это связано с возможностью контролировать варьировать эффективную ширину запрещенной зоны при изменении размера. При этом будут изменяться оптические свойства системы: длина волны люминесценции, область поглощения. Другой практически важной особенностью квантовых точек является способность существовать в виде золей (растворов). Это позволяет легко получать покрытия из пленок квантовых точек дешевыми методами, например spin-coating, или наносить квантовые точки с помощью струйной печати на любые поверхности. Все эти технологии позволяют избежать при создании устройств на основе квантовых точек дорогих вакуумных технологий, традиционных для микроэлектронной техники. Также за счет растворных технологий возможно возможно вводить квантовые точки в подходящие матрицы и создавать композитные материалы. Аналогом может являться ситуация с органическими люминесцентными материалами, которые используются для создания светоизлучающих устройств, что привело к буму в технологии светодиодов и возникновению так называемых OLED [3].
Материалы для лазеров
Возможность варьирования длины волны люминесценции принципиальное преимущество для создания новых лазерных сред. В существующих лазерах длина волны люминесценции является фундаментальной характеристикой среды и возможности ее варьирования ограничены (лазеры с перестраиваемой длиной волны используют свойства
резонаторов и более сложные эффекты). Другое преимущество квантовых точек – высокая фотостойкость по сравнению с органическими красителями. Квантовые точки демонстрируют поведение неорганических систем. Возможность создания лазерных сред на основе квантовых точек CdSe была продемонстрирована научной группой под руководством Виктора Климова [3] в Лос-Аламосской национальной лаборатории, США. В дальнейшем показана возможность вынужденного излучения для квантовых точек на основе других полупроводниковых материалов, например PbSe. Основной трудностью является малое время жизни возбужденного состояния в квантовых точках и побочный процесс рекомбинации, что требует высокой интенсивности накачки [4]. На настоящий момент наблюдался как процесс вынужденной генерации, так и создан прототип тонкопленочного лазера при использовании подложки с дифракционной решеткой.
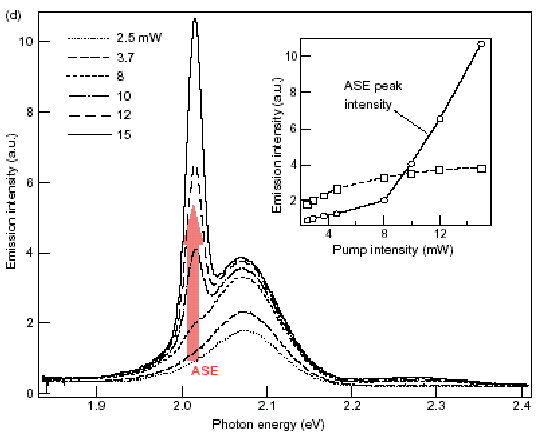
Рис.1.3. Использование квантовых точек в лазерах.
Материалы для светодиодов
Возможность варьирования длины волны люминесценции и легкость создания тонких слоев на основе квантовых точек представляют большие возможности для создания светоизлучающих устройств с электрическим возбуждением – светодиодов. Более того, особый интерес представляет создание панелей плоских экранов, что весьма актуально для современной электроники. Использование струйной печати привело бы к прорыву в
технологии OLED.
Для создания светоизлучающего диода монослой квантовых точек помещается между слоями, имеющими проводимость р- и п- типов. В этом качестве могут выступать проводящие полимерные материалы, которые относительно хорошо разработаны в связи с технологией OLED, и легко могут быть сопряжены с квантовыми точками [5]. Разработкой технологии создания светоизлучающих устройств занимается научная группа под руководством M.Bulovic (MIT).
Говоря о светодиодах, нельзя не упомянуть о “белых” светодиодах, которые могут стать альтернативой стандартным лампам накаливания. Квантовые точки могут быть использованы для светокорректировки полупроводниковых светодиодов. В таких системах используется оптическая накачка слоя, содержащего квантовые точки, при помощи полупроводникового синего светодиода. Преимуществом квантовых точек в данном случае являются высокий квантовый выход, большая фотостойкость, и возможность составлять многокомпонентный набор из квантовый точек с различными длинами эмиссии, чтобы получить более близкий к “белому” спектр излучения [1].
Материалы для солнечных батарей
Создание солнечных батарей является одной из перспективных областей применения коллоидных квантовых точек. На настоящий момент наиболее высоким коэффициентом преобразования (до 25%) обладают традиционные батареи на кремнии. Однако они достаточно дороги и существующие технологии не позволяют создавать батареи большой площади (либо это является слишком дорогим производством). В 1992 г. M.Gratzel [6] предложил подход к созданию солнечных батарей, основанный на использовании 30 материалов с большой удельной поверхностью (например, нанокристаллический TiO2). Активация к видимому диапазону спектра достигается добавлением фотосенсибилизатора (некоторые органические красители). Квантовые точки могут прекрасно выступать в роли фотосенсибилизатора, поскольку позволяют управлять положением полосы поглощения. Другими немаловажными достоинствами являются высокий коэффициент экстинкции (возможность поглощения значительной доли фотонов в тонком слое) и высокая фотостабильность, присущая неорганическому ядру [1].
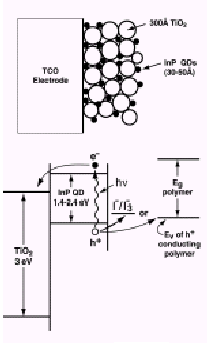
Рис.1.4. Использование квантовых точек в солнечных батареях.
Поглощенный квантовой точкой фотон приводит к образованию фотовозбужденных электрона и дырки, которые могут переходить в электрон- и дырочно-транспортные слои, как схематично показано на рисунке. В качестве таких транспортных слоев могут выступать проводящие полимеры n- и p-типов проводимости, в случае электрон транспортного слоя по аналогии с элементом Gratzel возможно использование пористых слоев оксидов металлов. Подобные солнечные батареи имеют немаловажное достоинство, как возможность создания гибких элементов при нанесении слоев на полимерные подложки, а также относительную дешевизну и простоту изготовления. Публикации о возможном применении квантовых точек для солнечных батарей можно найти в работа P.Alivisatos и A.Nozic [7].
Материалы для полевых транзисторов
Использование массивов квантовых точек в качестве проводящих слоев в микроэлектронике весьма перспективно, поскольку возможно использовать простые и дешевые “растворные” технологии нанесения. Однако возможность применения ограничена на настоящий момент чрезвычайно высоким (~1012 Ом*см) сопротивлением слоев из квантовых точек [8]. Одной из причин является большое (конечно по микроскопическим меркам) расстояние между индивидуальными квантовыми точками, которое составляет при использовании стандартных стабилизаторов типа триоктилфосфин оксида или олеиновой кислоты от 1 до 2 нм, что слишком велико для эффективного туннелирования носителей заряда. Однако при использовании в качестве стабилизаторов более короткоцепочечных молекул возможно уменьшить межчастичные расстояния до уровня, приемлемого для туннелирования носителей заряда (~0.2 нм при использовании пиридина или гидразина.
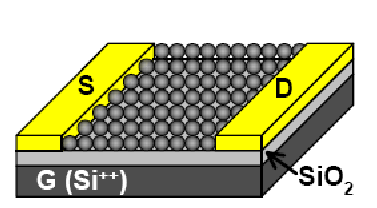
Рис.1.5. Использование квантовых точек в полевых транзисторах.
В 2005 г. К.Мюрреем и Д.Талапиным сообщено о создании тонкопленочного полевого транзистора на основе квантовых точек PbSe с использованием молекул гидразина для пассивации поверхности [9]. Как показано, для создания проводящих слоев перспективными являются халькогениды свинца вследствие высокой диэлектрической проницаемости и высокой плотности состояний в зоне проводимости.
Использование в качестве биометок
Создание флуоресцентных меток на основе квантовых точек является весьма перспективным. Можно выделить следующие преимущества квантовых точек перед органическими красителями: возможность контроля длины волны люминесценции, высокий коэффициент экстинкции, растворимость в широком диапазоне растворителей, стабильность люминесценции к действию окружающей среду, высокая фотостабильность. Также можно отметить возможность химической (или более того биологической) модификации поверхности квантовых точек, позволяющей осуществить селективное связывание с биологическими объектами [10]. На правом рисунке показано окрашивание элементов клетки при помощи водорастворимых квантовых точек, люминесцирующих в видимом диапазоне. На рисунке 1.6 представлен пример использования неразрушающего метода оптической томографии. Фотография получена в ближнем ИК-диапазоне при использовании квантовых точек с люминесценцией в диапазоне 800-900 нм (окно прозрачности крови теплокровных), введенных в мышь.
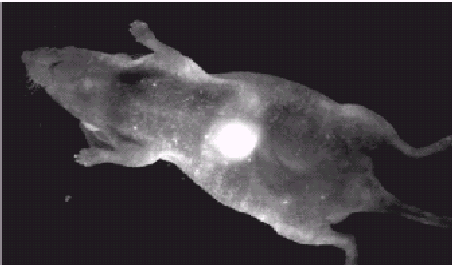
Рис.1.6 Использование квантовых точек в качестве биометок.
Методы поучения квантовых точек
В настоящее время разработаны методы получения наноматериалов как в виде нанопорошков, так и в виде включений в пористые или монолитные матрицы. При этом в качестве нанофазы могут выступать ферро- и ферримагнетики, металлы, полупроводники, диэлектрики и т.д. Все методы получения наноматериалов можно разделить на две большие группы по типу формирования наноструктур: методы “Bottom-up” характеризуются ростом наночастиц или сборкой наночастиц из отдельных атомов; а методы “Top-down” основаны на “дроблении” частиц до наноразмеров (рис. 1.7).
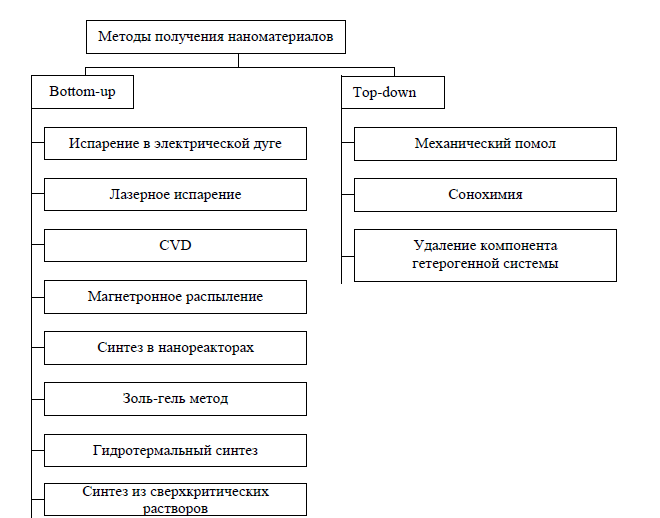
Рис.1.7. Методы получения наноматериалов.
Другая классификация предполагает деление методов синтеза по способу получения и стабилизации наночастиц. К первой группе относят т.н.
высокоэнергетические методы, основанные на быстрой конденсации паров в
условиях, исключающих агрегацию и рост образующихся частиц. Основные
различия между методами этой группы состоят в способе испарения и стабилизации наночастиц. Испарение может проводиться плазменным возбуждением (plasma-ark), с помощью лазерного излучения (laser ablation), в
вольтовой дуге (carbon ark) или термическим воздействием. Конденсация осуществляется в присутствии ПАВ, адсорбция которого на поверхности частиц замедляет рост (vapor trapping), или на холодной подложке, когда рост
частиц ограничен скоростью диффузии. В некоторых случаях конденсацию
ведут в присутствии инертного компонента, что позволяет направленно получать нанокомпозитные материалы с различной микроструктурой. Если
компоненты взаимно нерастворимы, размер частиц получаемых композитов можно варьировать с помощью термической обработки.
Ко второй группе относят механохимические методы (ball-milling), позволяющие получать наносистемы при помоле взаимонерастворимых компонентов в планетарных мельницах или при распаде твердых растворов с
образованием новых фаз под действием механических напряжений. Третья группа методов основана на использовании пространственно-ограниченных систем – нанореакторов (мицелл, капель, пленок и т.д.). К числу таких методов относится синтез в обращенных мицеллах, в пленках Лэнгмюра-Блоджетт, адсорбционных слоях или твердофазных нанореакторах. Очевидно, что размер образующихся при этом частиц не может превосходить
размера соответствующего нанореактора, и поэтому указанные методы позволяют получать монодисперсные системы. Кроме того, использование
коллоидных нанореакторов позволяет получать наночастицы различной формы и анизотропии (в том числе и малоразмерные), а также частицы с покрытиями.
Этот метод используется для получения практически всех классов наноструктур – от однокомпонентных металлических до многокомпонентных оксидных. Сюда же можно отнести методы, основанные на формировании в растворах ультрамикродисперсных и коллоидных частиц при поликонденсации в присутствии поверхностно-активных веществ, предотвращающих агрегацию. Важно, что именно этот метод, основанный на комплиментарности формируемой структуры исходному шаблону используется живой природой для размножения и функционирования живых систем (например, синтез белков, репликация ДНК, РНК и т.д.) В четвертую группу входят химические методы получения высокопористых и мелкодисперсных структур (Rieke metals, никель Ренея), основанные на удалении одного из компонентов микрогетерогенной системы в результате химической реакции или анодного растворения. К числу этих методов можно отнести также традиционный способ получения нанокомпозитов путем закалки стеклянной или солевой матрицы с растворенным веществом, в результате чего происходит выделение нановключений этого вещества в матрице (метод кристаллизации стекла). При этом введение активного компонента в матрицу может осуществляться двумя способами: добавлением его в расплав с последующей закалкой и непосредственным введением в твердую матрицу с помощью ионной имплантации [11].
Свойства квантовых точек
Уникальные оптические свойства квантовых точек (КТ) делают их перспективным материалом для применения в самых различных областях. В частности, ведутся разработки по использованию КТ в светоизлучающих диодах, дисплеях [12, 13], лазерах [14-15], солнечных батареях [16-18]. Кроме того, они могут быть сконъюгированы с биомолекулами за счёт ковалентного связывания между группами лигандов, покрывающих КТ, и функциональными группами биомолекул [19]. В таком виде они применяются в качестве флуоресцентных меток в самых разных приложениях биоанализа – от иммунохимических тест-методов до визуализации тканей и отслеживания лекарственных веществ в организме [20-21]. Применение КТ в биоанализе на сегодняшний день является одной из перспективных областей применения люминесцирующих нанокристаллов. Такие уникальные характеристики КТ, как зависимость цвета эмиссии от размера, высокая фотостабильность, широкие спектры поглощения делают их идеальными флуорофорами для сверхчувствительной, многоцветной детекции биологических объектов и медицинской диагностики, требующей регистрации нескольких параметров одновременно [22,23].
Полупроводниковые КТ представляют собой нанокристаллы, размеры которых по всем трём направлениям меньше радиуса экситона Бора для данного материала [20,21]. В таких объектах наблюдается размерный эффект: оптические свойства, в частности ширина запрещенной зоны (а, соответственно, и длина волны испускания) и коэффициент экстинкции, зависят от размеров наночастиц и их формы [24] Вследствие столь значительного пространственного ограничения, КТ обладают уникальными оптическими и химическими характеристиками [21,24]:
Высокая фотостабильность, которая позволяет многократно увеличивать мощность возбуждаемого излучения и длительно наблюдать за поведением флуоресцентной метки в реальном времени [20,23].
Широкий спектр поглощения – благодаря чему КТ с разным диаметром могут быть одновременно возбуждены источником света с длиной волны 400 нм (или другой), при этом длина волны эмиссии этих образцов изменяется в диапазоне 490 – 590 нм (цвет флуоресценции от голубого до оранжево-красного) [24].
Симметричный и узкий (ширина пика на полувысоте не превышает 30 нм) пик флуоресценции КТ упрощает процесс получения разноцветных меток [20,21].
Яркость свечения КТ настолько высока, что они оказываются детектируемыми как единичные объекты с помощью флуоресцентного микроскопа [24,25].
Для использования КТ в биоанализе к ним предъявляют требования, связанные с водорастворимостью и биосовместимостью (поскольку неорганическое ядро в воде не растворимо), а также с четким распределением частиц по размерам, их стабильностью при хранении. Для придания КТ водорастворимых свойств существует несколько подходов при синтезе: либо синтезируют КТ непосредственно в водной фазе [26]; либо полученные в органических растворителях КТ затем переводят в водные растворы путем модификации лигандного слоя, покрывающего КТ [22,25,27].
Синтез в водных растворах позволяет получить гидрофильные КТ, однако по ряду характеристик, таких как квантовый выход флуоресценции, распределение частиц по размерам и стабильность во времени, они существенно уступают полупроводниковым КТ, полученным в органических фазах [26]. Таким образом, для применения в качестве биометок КТ чаще всего синтезируют при высоких температурах в органических растворителях по методике, впервые применённой в 1993 г. научной группой Муррея и др. [28]. Основной принцип синтеза – впрыскивание растворов прекурсоров металла Cd и халькогена Se в нагретый до высоких температур координационный растворитель. С увеличением времени процесса происходит смещение спектра поглощения в длинноволновую область, что свидетельствует о росте кристаллов CdSe.
Ядра CdSe имеют невысокую яркость флуоресценции – их квантовый выход (КВ), как правило, не превышает 5%. Для повышения КВ и фотостабильности, флуоресцирующие ядра CdSe покрывают слоем более широкозонного полупроводника со схожими структурой и составом, который пассивирует поверхность ядра, тем самым значительно повышая КВ флуоресценции [21,23]. Схожая кристаллическая структура оболочки и ядра – необходимое условие, иначе не будет происходить равномерного наращивания, а разница в структурах может приводить к дефектам на границе фаз. Для покрытия ядер селенида кадмия используют более широкозонные полупроводники, такие как сульфид цинка, сульфид кадмия, селенид цинка. Однако сульфид цинка, как правило, наращивают только на небольших ядрах селенида кадмия (при d (CdSe) < 3 нм). Согласно [29], наращивание оболочки ZnS на ядрах CdSe большего диаметра затруднительно из-за большой разницы в параметрах кристаллических решёток CdSe и ZnS. Поэтому при наращивании ZnS непосредственно на ядрах CdSe диаметром более ~3 нм между ядром и сульфидом цинка помещают промежуточный слой – наращивают оболочку селенида цинка или сульфида кадмия, которые имеют промежуточные между CdSe и ZnS параметры кристаллической решётки и величину запрещённой зоны [30].
Выделяют два основных подхода для перевода гидрофобных КТ в водные растворы: метод замены лигандов и покрытие амфифильными молекулами [21,22,25]. Кроме того, часто отдельной категорией выделяют покрытие КТ оболочкой оксида кремния [31].
Методы определения размеров частиц
Вышеперечисленные свойства коллоидных квантовых точек проявляются при наличии размерного эффекта, следовательно, необходимо провести измерения размеров частиц.
В данной ВКР измерения проводились на приборе Photocor Compact, установленном на кафедре физической и коллоидной химии УрФУ, а также на установке Zetasizer Nano Z в институте химии твердого тела УрО РАН.
Спектрофотометр Photocor Compact
Схема лабораторного спектрометра Photocor Compact представлена на рис.1.8:
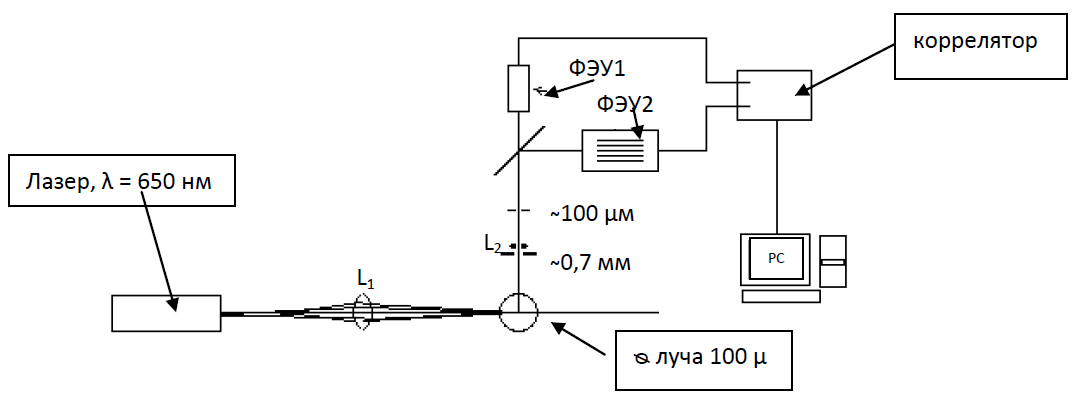
Рис.1.8. Схема спектрометра Photocor Compact.
В приборе используется термостабилизированный диодный лазер с длинной волны λ = 653,6 нм. Луч лазера проходит через фокусирующую линзу L1, с фокусным расстоянием 90 мм, собирается на исследуемом образце, где рассеивается на микроскопических флуктуациях наночастиц. Рассеянный свет измеряется под прямым углом, проходит через диафрагму d = 0,7 мм, линзой L2 фокусируется на второй диафрагме 100 мкм, затем делится пополам полупрозрачным зеркалом и попадает на два ФЭУ. Для сохранения когерентности сбора, точечная диафрагма перед ФЭУ должна иметь размер порядка первой зоны Френеля. При меньших размерах уменьшается отношение сигнал шум, при увеличении размера уменьшается когерентность и амплитуда корреляционной функции уменьшается. В спектрометре Photocor-Compact используются два ФЭУ, измеряется функция взаимной корреляции их сигналов, это позволяет убрать шумы ФЭУ, поскольку они не коррелированны, а функция взаимной корреляции сигналов с ФЭУ будет эквивалентна корреляционной функции рассеянного света. Используется многоканальный (288 каналов) коррелятор, сигналы с которого считываются компьютером. С помощью него осуществляется управление прибором, процессом измерения и обработка результатов измерения.
Полученные растворы измерялись на корреляционном спектрометре. С помощью программного обеспечения Photocor Software можно наблюдать за ходом измерений и управлять коррелятором. При измерениях используется разбиение на части суммарного времени измерения, получившиеся корреляционные функции и интенсивности рассеяния анализируются, и если средняя интенсивность на каком-то отрезке времени больше чем в остальных, измерения за этот отрезок игнорируются, остальные усредняются. Это позволяет убрать искажения корреляционно функции редкими частицами пыли (размерами несколько микрон).
На рис.1.9 представлено программное обеспечение корреляционного спектрометра Photocor Software:
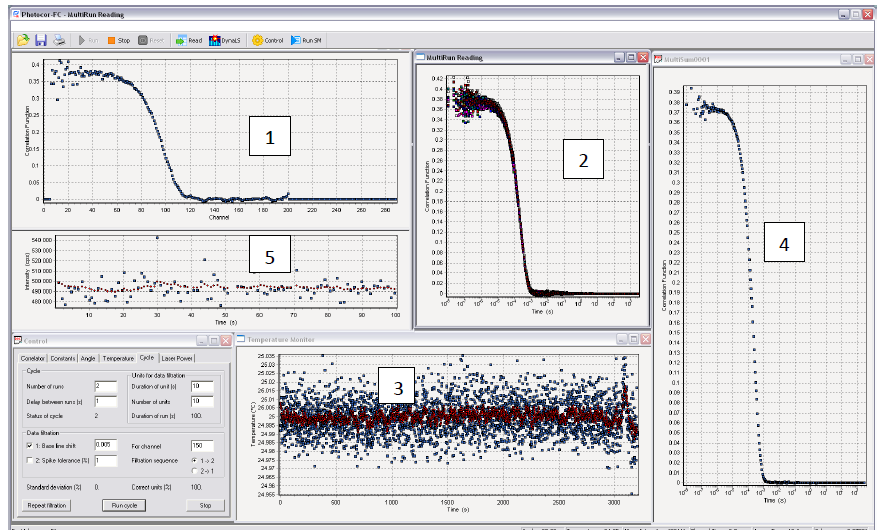
Рис.1.9 программное обеспечение корреляционного спектрометра Photocor Software.
Графики 1,2,4 – измеренные корреляционные функции в логарифмическом масштабе: 1 – к. ф., измеряющаяся в данный момент времени, 2 – измеренные функции, 4 – отображается суммарная корреляционная функция; 3 график – температуры образца; 5 график – интенсивности рассеяния.
Программа позволяет изменять интенсивность лазера, температуру (3), время проведения одного измерения и количество измерений. От набора этих параметров, в том числе, зависит точность измерения.
Накопленная корреляционная функция обрабатывалась программой DynaLS, ее программное обеспечение представлено на рис.1.10:
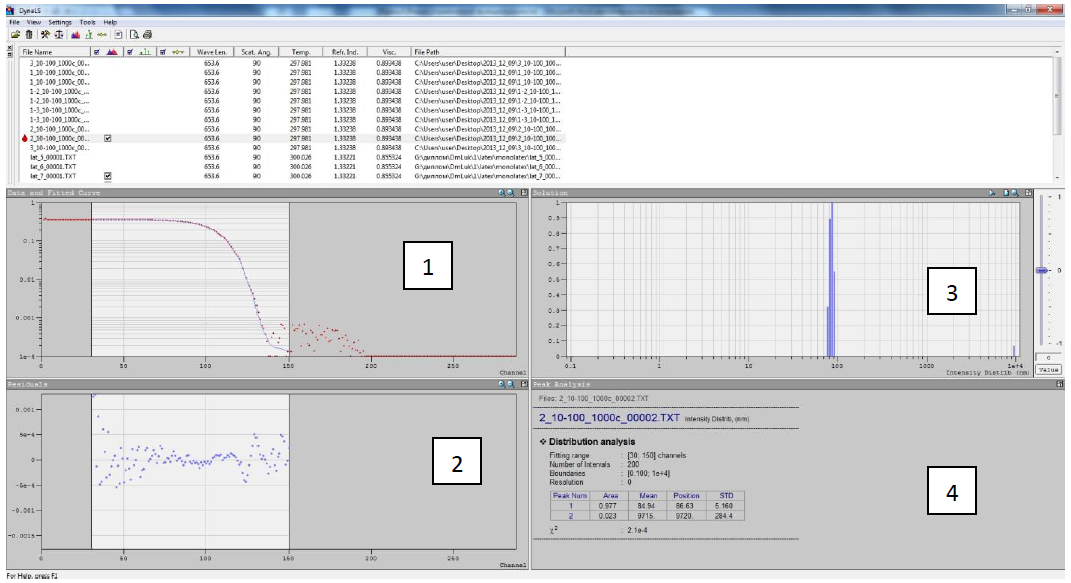
Рис. 1.10. Программное обеспечение для обработки корреляционных функций, DynaLC.
1
– измеренная корреляционная функция,
аппроксимируемая теоретической; 2 –
разница между полученной теоретической
и измеренной экспоненциальной функциями;
3 – полученное распределение по размерам,
найденное путем аппроксимации
теоретической функцией экспериментальной;
4 – таблица результатов. В таблице:
первая колонка – количество найденных
решений; вторая – «площадь» этих решений;
третья – среднее значение; четвертая
– максимальное значение; последняя –
разброс решения (погрешность). Так же
приводится критерий
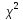 который
показывает насколько хорошо теоретическая
кривая совпадает с экспериментальной
[32].
который
показывает насколько хорошо теоретическая
кривая совпадает с экспериментальной
[32].
Методика эксперимента
Гидрохимический метод синтеза
Особую привлекательность и широкие перспективы, с точки зрения конечных результатов, имеет химическое осаждение из водных растворов [33]. Гидрохимический метод осаждения отличается высокой производительностью и экономичностью, простотой технологического оформления, возможностью нанесения частиц на поверхность сложной формы и различной природы, а также легирования слоя органическими ионами или молекулами, не допускающими высокотемпературный нагрев, и возможностью «мягкохимического» синтеза. Последнее позволяет рассматривать данный метод, как наиболее перспективный для получения метастабильных по своей природе соединений халькогенидов металлов сложной структуры. Гидрохимический синтез является перспективным методом изготовления квантовых точек сульфидов металлов, потенциально способным обеспечить широкое разнообразие их характеристик. Синтез ведется в реакционной ванне, содержащей соль металла, щелочь, халькогенизатор и комплексообразующий агент.
Помимо основных реагентов, образующих твердую фазу, в раствор вводятся лиганды, способные связывать ионы металла в прочные комплексы. Щелочная среда необходима для разложения халькогенизатора. Роль комплексообразующих агентов при гидрохимическом синтезе очень важна, так как его введение значительно уменьшает концентрацию свободных ионов металла в растворе и, следовательно, замедляет процесс синтеза, предотвращает быстрое выпадение твердой фазы в осадок, обеспечивая образование и рост квантовых точек. Прочность образования комплексных ионов металла, а также физико-химическая природа лиганда оказывает определяющее влияние на процесс гидрохимического синтеза.
В качестве щелочи пользуется КОН, NaOH, NH4OH или этилендиамин. Различные виды халькогенизаторов также оказывают определенное влияние на гидрохимическое осаждение и на наличие побочных продуктов синтеза. В зависимости от вида халькогенизатора в основе синтеза лежат две химические реакции:
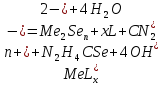 (2.1)
(2.1)
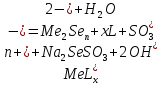 ,
(2.2)
,
(2.2)
Где
 комплексный ион металла.
комплексный ион металла.
Критерием образования нерастворимой фазы халькогенида металла является пересыщение, которое определяется как отношение ионного произведения ионов, образующих квантовые точки, к произведению растворимости твердой фазы. На начальных этапах процесса образование зародышей в растворе и размер частиц увеличиваются достаточно быстро, что связано с высокими концентрациями ионов в реакционной смеси. По мере того, как раствор истощается относительно этих ионов, скорость формирования твердой фазы снижается до достижения в системе равновесия.
Порядок сливания реагентов для приготовлений рабочего раствора строго фиксировав. Необходимость этого вызвана тем, что процесс осаждения халькогенидов является гетерогенным, и скорость его зависит от начальных условий образования новой фазы.
Рабочий раствор готовится смешением рассчитанных объемов исходных веществ. Синтез квантовых точек осуществляется в реакторе из стекла объемом, 50 мл. Вначале в реактор вносят расчетный объем соли кадмия, затем вводится цитрат натрия и добавляется дистиллированная вода. После раствор подщелачивается, и к нему приливают тиомочевину. Для стабилизации синтеза в реакционную смесь вводится расчетный объем трилона Б. Активация полученных квантовых точек производится в ультрафиолетовом свете.
Данный метод разработан на кафедре физической и коллоидной химии УрФУ и преимущественно использовался для получения тонких пленок халькогенидов металлов и твердых растворов на их основе. Однако исследования, проведенные в данной работе, показали его применимость для синтеза квантовых точек на основе сульфидов металлов и твердых растворов на их основе.
Химические реактивы
Для гидрохимического синтеза квантовых точек CdS, PbS, CdxPb1-xS,
использовались следующие химические реактивы:
хлорид кадмия CdCl2 , ч, 1 М;
ацетат свинца РЬ(СН3СОО)2 • ЗН20 , ч, 1 М;
тиомочевина (NH2)2CS, ч, 1,5 М;
цитрат натрия Na3C6H5O7, 1 М;
гидроксид натрия NaOH, чда, 5 М;
ПАВ Праестол 655 ВС;
ПАВ АТМ 10-16 (Алкил С10-16 триметиламмоний хлорид [R-N(CH3)3]Cl, R=C10-C16);
Динатриевая соль этилендиаминтетрауксусной кислоты
C10H14O8N2Na2• 2Н2 0,1 М.
Определение ККМ стабилизаторов проводилось с помощью кондуктометра АНИОН.
Утилизация отработанных растворов
Профильтрованный раствор после гидрохимического осаждения, содержащего растворимые соли кадмия, свинца, комплексообразователи и тиомочевину, нагревали до 353 К, добавляли в него сульфат меди (105 г на 1 л реакционной смеси, прибавляли по I г до появления фиолетового окрашивания), нагревали до кипения и выдерживали в течение 10 минут. После этого смесь оставляли при комнатной температуре на 30—40 минут и отфильтровывали выпавший осадок, который затем соединяли с осадком, отфильтрованным на предыдущей стадии. Фильтрат, содержащий комплексные соединения с концентрацией ниже предельно допустимой разбавляли водопроводной водой и сливали в городскую канализацию.
Методика измерения на анализаторе частиц Photocor Compact
Анализатор размера частиц Photocor Compact и предназначен для измерения размеров частиц, коэффициента диффузии и молекулярного веса полимеров. Прибор предназначен для традиционных физико-химических исследований, а также для новых применений в нанотехнологии, биохимии и биофизике [32].
Принцип работы анализатора размеров частиц основан на явлении динамического рассеяния света (метод фотонной корреляционной спектроскопии). Измерение корреляционной функции флуктуаций интенсивности рассеянного света и интегральной интенсивности рассеяния позволяет находить размер дисперсных частиц в жидкости и молекулярный вес полимерных молекул. Диапазон измеряемых размеров находится в пределах от долей нм до 6 мкм.
Основы метода динамического рассеяния света (фотонной корреляционной спектроскопии)
Коррелятор Photocor-FC - это универсальный прибор для измерения временных корреляционных функций. Кросскорреляционная функция G12 двух сигналов l1(t) и l2(t) (например, интенсивности рассеяния света) описывает связь (подобие) двух сигналов во временной области и определена следующим образом:
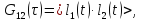 (2.3)
(2.3)
где
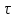 — время задержки. Угловые скобки означают
усреднение по времениt.
Функция
автокорреляции описывает корреляцию
между сигналом I1(t)
и
задержанной версией этого же сигнала
12(t+
— время задержки. Угловые скобки означают
усреднение по времениt.
Функция
автокорреляции описывает корреляцию
между сигналом I1(t)
и
задержанной версией этого же сигнала
12(t+ ):
):
 (2.3)
(2.3)
В соответствии с определением корреляционной функции алгоритм работы коррелятора включает в себя выполнение следующих операций:
задержка сигнала МО на время т
умножение сигнала I1(t) на задержанную версию
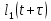
интегрирование произведения I1(t)
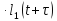
Коррелятор Photocor-FC разработан специально для анализа сигналов фотонной корреляционной спектроскопии (ФКС). Сущность работы метода ФКС заключается в следующем: при прохождении лазерного луча через исследуемую жидкость, содержащую взвешенные дисперсные частицы, часть света рассеивается на флуктуациях концентрации числа частиц. Эти частицы совершают броуновское движение, которое может быть описано уравнением диффузии. Из решения этого уравнения получается выражение, связывающее полуширину спектра рассеянного света Г (или характерное время релаксации флуктуации Тс) с коэффициентом диффузии D:
 (2.4)
(2.4)
Где q – модуль волнового вектора флуктуации, на которых рассеивается свет. Коэффициент диффузии D связан с гидродинамическим радиусом частиц R уравением Эйнштейна-Стокса:
 (2.5)
(2.5)
где
k
– константа Больцмана, T-абсолютная
температура,
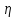 -
сдвиговая вязкость растворителя.
-
сдвиговая вязкость растворителя.
Экспериментальная часть
Синтез квантовых точек на основе сульфида кадмия
Исследование квантовых точек CdS, наряду с КТ PbS является основным направлением данной ВКР. Это, прежде всего, связано с тем, что свойства данного материала при гидрохимическом синтезе хорошо изучены и, в то же время, он мало применяется для синтеза КТ. Была проведена серия опытов по получению квантовых точек в реакционной смеси следующего состава, моль/л: [CdCl2] =0.01; [Na3Cit] = 0.2; [NaOH] = 0.12; [ТМ] = 0.3. При этом последовательность сливания реактивов строго определена: к раствору хлорида кадмия добавляется раствор цитрата натрия, смесь тщательно перемешивается до растворения образовавшегося осадка и разбавляется дистиллированной водой. Далее раствор подщелачивается гидроксидом натрия и к нему приливается тиомочевина, с этого момента начинается отсчет времени реакции. Последним, в качестве стабилизирующей добавки, добавляется наиболее подходящий стабилизатор, в данном случае – трилон Б (0,1М). Необходимый объем был определен экспериментально. Опыты осуществлялись при температуре 298 К, активация проводилась в УФ свете.
Объемы добавляемых реагентов были рассчитаны по закону эквивалентов с использованием значений начальных концентраций исходных веществ. Реакционный сосуд был выбран объемом 50 мл.
Механизм реакции схож с механизмом формирования тонких пленок, но в отличие от него для синтеза КТ используется более щелочная среда (pH=13,0) и стабилизатор трилон Б, который замедляет реакцию, за счет обволакивания частиц CdS, и позволяет получать частицы малого размера (от 3 нм).
В начальный момент времени раствор прозрачный, через минуту начинать отсвечивать желтым цветом. При активации в ультрафиолетовом свете раствор ярко-зеленый. При подборе оптимальных концентраций, а так же стабилизаторов (в данном случае трилон Б), раствор сохраняет размеры до 1 часа, после чего образуются агломераты и начинает выпадать осадок.
Измерения проводились на анализаторе размеров частиц Photocor Compact, обработка результатов осуществлялась с помощью программы DynaLS, которая анализирует корреляционную функцию и пересчитывает на средний радиус частиц в растворе. На рис. 3.1 и 3.2 представлены интерфейс программы DynaLS, а также результаты обработки корреляционной функции измерения размеров частиц КТ CdS:
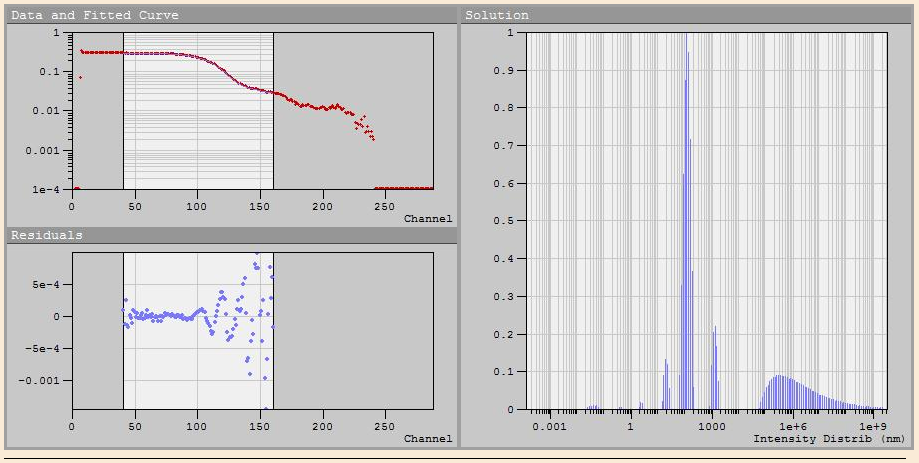
Рис.3.1. Интерфейс программы DynaLS при снятии корреляционной функции раствора КТ CdS.
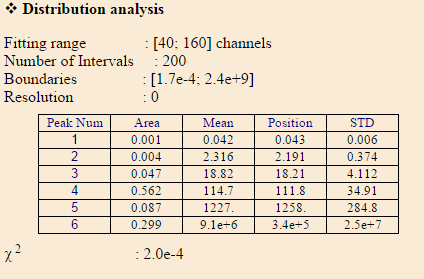
Рис.3.2. Результаты обработки корреляционной функции раствора КТ CdS.
По рис. 3.2 видно, что на в растворе присутствуют частицы радиусом 2 нм (пик №2), а также большие агломераты. Пики с 4 по 6 отображаются с ошибкой, так как в растворе присутствует не только броуновское движение частиц.
Влияние концентрации соли кадмия на размеры частиц КТ CdS
Для достижения размерного эффекта квантовых точек следует подобрать оптимальные концентрации исходных реагентов. В данном случае важную роль играет концентрация соли кадмия, следовательно нужно рассмотреть изменеия размеров частиц CdS при варьировании концентрации CdCl2.
В результате изменения концентрации соли кадмия были получены следующие зависимости:
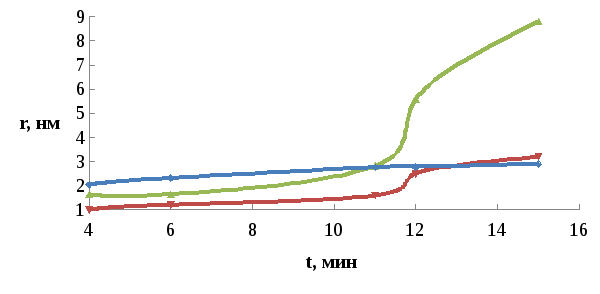
1
Рис.3.3. Влияние концентрации соли кадмия на размер частиц КТ CdS при [CdCl2]=0.005М (1), [CdCl2]=0.01М (2), [CdCl2]=0.02М.
По рис.11 видно, что при изменении концентрации CdCl2 имеет место незначительное изменение размеров частиц CdS. Но в результате эксперимента было доказано, что необходимо держаться в оптимальном диапазоне концентраций, где образуются частицы, способные создавать размерный эффект.
Синтез квантовых точек на основе сульфида свинца
Еще одним интересным направлением данной ВКР являлось исследование квантовых точек на основе сульфида свинца. Свойства этого материала при гидрохимическом синтезе, также как и CdS, хорошо изучены, кроме того сульфид свинца менее токсичен, что расширяет область его применения в медицине. Для синтеза КТ PbS использовались следующие реактивы, моль/л: [РЬАс2] = 0.05; [Na3Cit] = 0.2; [NaOH] = 0.12; [ТМ] = 0.3. Порядок сливания такой же, как и для рецептуры CdS: к раствору ацетата добавляется раствор цитрата натрия, смесь тщательно перемешивается до растворения образовавшегося осадка и разбавляется дистиллированной водой. Далее раствор подщелачивается гидроксидом натрия и к нему приливается тиомочевина, с этого момента начинается отсчет времени реакции. Последним, в качестве стабилизирующей добавки, добавляется ПАВ праестол. Опыты осуществлялись при температуре 298 К, активация проводилась в УФ свете.
В начальный момент времени реакционная смесь прозрачна, но спустя 30 минут она начинает медленно мутнеть, раствор становится светло-бежевым. После добавления праестола и перемешивания раствор не меняет цвета. На 3минуте раствор приобретает желто-зеленое яркое свечение в УФ свете, пропуская, как в случае с CdS, зеленую часть спектра.
Измерения проводились на анализаторе размеров Photocor Compact. Корреляционная функция и результаты измерения приведены на рис. 3.4 и 3.5 соответственно:
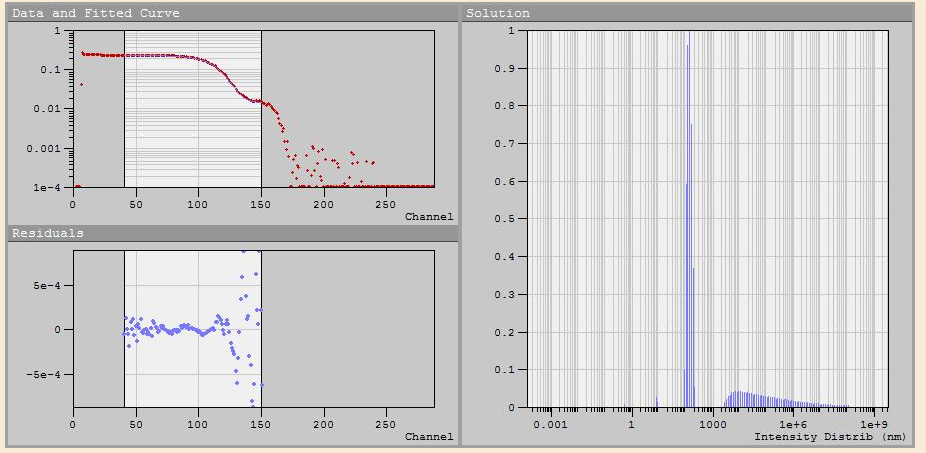
Рис.3.4. Интерфейс программы DynaLS при снятии корреляционной функции раствора КТ PbS.

Рис. 3.5. Результаты обработки корреляционной функции раствора КТ PbS.
По рис. 13 видно, что в растворе присутствуют частицы радиусом 7.5 нм, а также агломераты радиусом 133,2 нм. Пики под номерами 2 и 3 отображаются с ошибкой, по причине присутствия в растворе не только броуновского движения, но и течения реакции.
Влияние концентрации соли свинца на размеры частиц КТ PbS
Как и в случае синтеза коллоидных растворов CdS, так и при синтезе растворов PbS следует подбирать концентрации исходных реагентов для достижения размерного эффекта. Рассмотрим влияние концентрации соли свинца на размеры КТ PbS.
В результате изменения концентрации соли свинца были получены следующие зависимости:
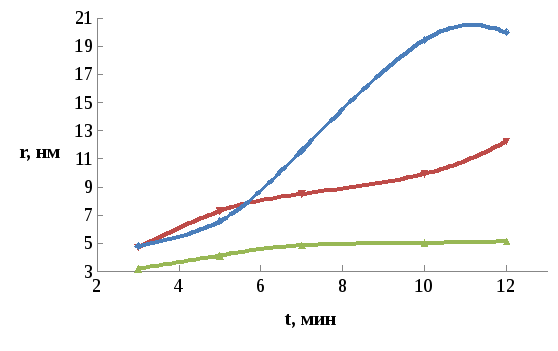
3
Рис. 3.6. Влияние концентрации соли свинца на размер частиц КТ PbS при [РЬАс2]=0.05М (1), [РЬАс2]=0.01М (2), [РЬАс2]=0.02М.
По рис. 14 видно, что при оптимальной концентрации соли свинца (0.05 М) размеры частиц не склонны к постоянному росту, в то время как при концентрации соли свинца равной 0.01 и 0.02 М имеет место практически линейный рост размеров частиц. Следовательно изменение исходной концентрации соли свинца значительно влияет на размерный эффект растворов КТ PbS.
Синтез квантовых точек на основе твердого раствора CdS-PbS
Синтез квантовых точек на основе твердых растворов замещения является чрезвычайно перспективным, так как позволяет в широких пределах варьировать их состав и функциональные свойства. Квантовые точки на основе твердых растворов замещения халькогенидов металлов могут значительно расширить сферы их применения. Особенно это относится к относительно устойчивым за счет кинетических затруднений пересыщенным твердым растворам. В литературе описание экспериментов по синтезу квантовых точек на основе твердых растворов халькогенидов металлов нами не обнаружено.
В настоящей работе впервые сделана попытка синтеза и исследования квантовых точек на основе пересыщенных твердых растворов замещения CdS–PbS со стороны сульфида свинца. С целью определения свойств материала была проведена серия опытов по получению квантовых точек в реакционной смеси следующего состава, моль/л: [CdCl2] = 0,01; [РЬАс2] = 0,05; [Na3Cit] = 0,2; [NH4OH] = 4; [ТМ] = 0,3. Данная рецептура позволяет получать пересыщенные твердые растворы замещения с содержанием сульфида кадмия в их составе от 6 до 8 мольных %.
При этом последовательность сливания реактивов строго определена: в первом сосуде к раствору ацетата свинца добавляется цитрат натрия, при этом образуется белый осадок, который легко растворяется, смесь тщательно перемешивается и разбавляется дистиллированной водой. Во втором сосуде к раствору хлорида кадмия добавляется водный раствор аммиака. Далее растворы смешиваются и к ним приливается тиомочевина, с этого момента начинается отсчет времени реакции. Последним, в качестве стабилизирующей добавки, добавляется ПАВ праестол. Опыты осуществлялись при температуре 298 К, активация проводилась в УФ свете.
После добавления праестола раствор больше не меняет цвет, в видимой области отсвечивает коричневым цветом. При этом раствор остается прозрачным. При активации УФ светом раствор начинает люминисцировать ярко-желтым светом, а по прошествии 5 минут – ярко-зеленым.
Через несколько часов начинает выпадать осадок и на стенках реактора образуется серая пленка.
Исследования размеров частиц проводились на приборе Photocor Compact. Интерфейс программы DynaLS c корреляционной функцией и результаты ее обработки приведены на рис. 3.7 и 3.8 соответственно:
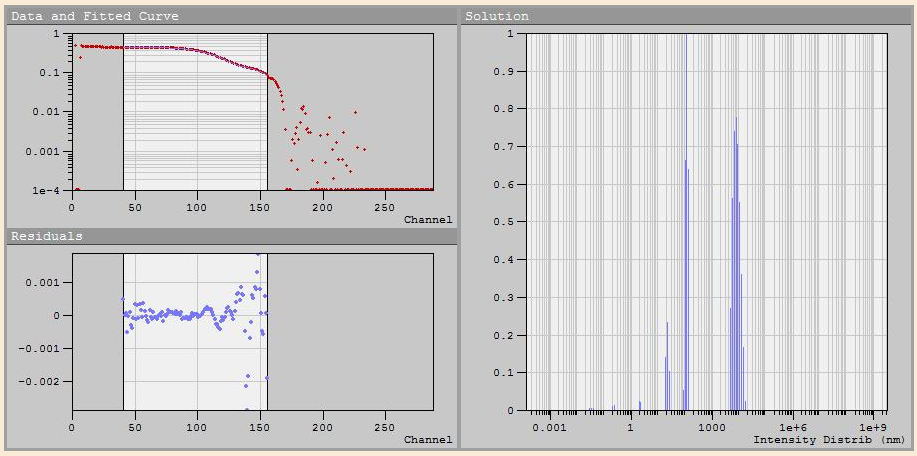
Рис.3.7. Интерфейс программы DynaLS при снятии корреляционной функции раствора КТ на основе ТРЗ CdS-PbS.
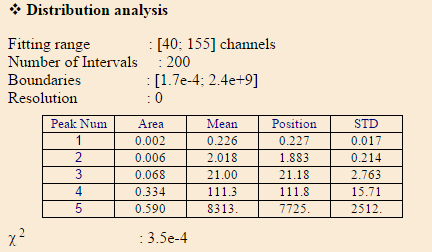
Рис. 3.8. Рис. 3.5. Результаты обработки корреляционной функции раствора КТ на основе ТРЗ CdS-PbS.
По рис. 3.8. видно, что в растворе присутствуют частицы радиусом 1.8 нм (пик №2), а также агломераты радиусом 21.18 нм. Пику № 1 соответствует зарождение новой фазы в растворе. Это значит, что реакция продолжает идти. Вследствие этого пики № 4 и 5 отображаются с ошибкой, так как присутствуют другие типы движения частиц, кроме броуновского.
Анализируя полученные данные можно с уверенностью сказать, что гидрохимический метод синтеза квантовых точек перспективен для их получения. Основная сложность заключается в подборе стабилизатора для разных исходных реагентов. В данном случае для коллоидных растворов ТРЗ на основе CdS-PbS и КТ на основе сульфида свинца лучше всего подходит ПАВ праестол, в то время как для КТ на основе сульфида кадмия – трилон Б.
Безопасность жизнедеятельности
Введение в раздел безопасность жизнедеятельности
Безопасность жизнедеятельности (БЖД) – это область научно-технических знаний, изучающая опасность и нежелательные последствия их воздействия на человека и объекты среды обитания, закономерности их проявления и способы защиты от них [34].
Цель БЖД – снижение риска возникновения, а также защита от любых видов опасностей (природных, техногенных, экологических, антропогенных), угрожающих людям в быту, на производстве, на транспорте, в условиях ЧС.
Основополагающая формула БЖД – это предупреждение и упреждение потенциальной опасности, существующей при взаимодействии человека со средой обитания.
Таким образом БЖД решает следующие основные задачи:
идентификация (распознавание и количественная оценка) вида негативных воздействий окружающей среды;
защита от опасностей или предупреждение воздействия тех или иных негативных факторов на человека и окружающую среду, на основе сопоставления затрат и выгод;
ликвидация отрицательных последствий воздействия опасных и вредных факторов;
создание нормального, то есть комфортного состояния среды обитания человека.
В жизни современного человека все большее место занимают проблемы, связанные с безопасностью жизнедеятельности. К опасным и вредным факторам естественного происхождения прибавились многочисленные негативные факторы антропогенного происхождения (шум, вибрация, электромагнитные излучения и др.). Возникновение данной науки — объективная потребность современного общества.
Вредные и опасные производственные факторы в лаборатории
Согласно ГОСТ 12.0.002-80 ССБТ [35] вредный производственный фактор – фактор, воздействие которого на работающего в определенных условиях может привести к заболеванию, снижению работоспособности и (или) отрицательному влиянию на здоровье потомства. В определенных условиях вредный фактор может стать опасным.
Опасный производственный фактор – фактор, воздействие которого на работающего в определенных условиях приводит к травме, острому отравлению или другому внезапному резкому ухудшению здоровья, или смерти.
По ГОСТ 12.0.003-74 [36] все опасные и вредные производственные факторы подразделяются по природе действия на следующие группы: физические; химические; биологические; психофизиологические. В лаборатории, где проводились исследования, присутствуют физические и химические СанПиН 2.2.4.548-96 [37].
Вредные вещества
Вредное вещество – вещество, которое при контакте с организмом человека может вызывать травмы, заболевания или отклонения в состоянии здоровья, обнаруживаемые современными методами как в процессе контакта с ним, так и в отдаленные сроки жизни настоящего и последующих поколений. Согласно ГОСТ 12.1.007-76 ССБТ [38] вредные вещества по степени воздействия на организм подразделяются на четыре класса опасности:
I – вещества чрезвычайно опасные;
II – вещества высокоопасные;
III – вещества умеренно опасные;
IV – вещества малоопасные.
Под предельно допустимой концентрацией (ПДК) понимается такая концентрация химических элементов и их соединений в окружающей среде, которая при повседневном влиянии в течение длительного времени на организм человека не вызывает патологических изменений или заболеваний, устанавливаемых современными методами исследований в любые сроки жизни настоящего и последующего поколений.
При проведении работ в лаборатории оксидных систем используются вредные вещества, указанные в табл. 4.1, для уменьшения концентрации их паров в воздухе включается вытяжная вентиляция, что уменьшает содержание вредных веществ до безопасного уровня согласно ГОСТ 12.1.005-88 ССБТ [39].
Таблица 4.1 – ПДК вредных веществ в воздухе рабочей зоны
|
Вещество |
ПДК мг/м3 |
Класс опасности |
|
Кадмий и его неорганические соединения |
0,05/0,01 |
I |
|
Свинец и его неорганические соединения |
0,01/0,005 |
I |
|
Тиокарбамид |
0,3 |
II |
|
Этилендиаминтетрауксусной кислоты динатриевая соль |
2 |
III |
|
Гидроксид натрия |
0,5 |
II |
|
АлкилC10—16амины+ |
1 |
II |
|
Олеиновая кислота |
0,5/0,1 |
II |
|
Цитрат натрия |
5 |
III |
где: + — соединения, при работе с которыми требуется специальная защита кожи и глаз;
Кадмий вне зависимости от типа соединения накапливается в печени и почках, вызывая их поражения. Снижает активность пищеварительных ферментов.
Свинец при накоплении в организме оказывает неблагоприятные неврологическое, гематологическое, эндокринное, канцерогенное воздействия. Нарушает работу почек.
Тиокарбамид вызывает раздражение кожи, токсичен для сердечно-сосудистой иммунной систем, а также репродуктивных органов.
Трилон Б может вызвать раздражение кожных покровов, слизистых оболочек глаз и дыхательных путей.
Гидроксид натрия оказывает разъедающее действие на глаза, кожу и дыхательные пути. Разъедающее действие при проглатывании. Вдыхание аэрозоля вызывает отек легких.
Олеиновая кислота ядовита. Обладает слабым наркотическим действием. Возможны острые и хронические отравления с изменением крови и кроветворных органов, органов пищеварительной системы, отёк легких.
Синтез порошков производится в вентиляционных шкафах, вследствие чего концентрация любых частиц в воздухе рабочего пространства (любого размера и природы), не входящих в состав воздуха, стремится к нулю. Помимо этого, используются средства индивидуальной защиты: спец одежда; для защиты органов дыхания – респираторы и ватно-марлевые повязки; для защиты органов зрения – защитные очки; для защиты кожи рук – латексные перчатки.
Параметры микроклимата
Микроклимат - это комплекс физических факторов внутренней среды помещений, оказывающий влияние на тепловой обмен организма и здоровье человека. К микроклиматическим показателям относятся температура, влажность и скорость движения воздуха, температура поверхностей ограждающих конструкций, предметов, оборудования, а также некоторые их производные: градиент температуры воздуха по вертикали и горизонтали помещения, интенсивность теплового излучения от внутренних поверхностей.
СанПиН 2.2.4.548-96 [40] устанавливает оптимальные и допустимые величины температуры, относительной влажности и скорости движения воздуха для рабочей зоны производственных помещений в зависимости от тяжести выполняемых работ, сезонов года с учетом избыточного тепла. По степени влияния на самочувствие человека и его работоспособность микроклиматические условия подразделяются на оптимальные, допустимые, вредные и опасные.
Согласно СанПиН 2.2.4.548-96 условия в лаборатории относятся к категории работ Iб (работы с интенсивностью энергозатрат 140-174 Вт), производимые сидя, стоя или связанные с ходьбой и сопровождающиеся некоторым физическим напряжением.
Площадь, приходящаяся на одного рабочего, факт/норм, м2 – 5/4,5
Объем, приходящийся на одного работающего, факт/норм, м2 – 24/15
Величины показателей микроклимата приведены в таблице 4.2.
В рабочей лаборатории отклонения от оптимальных показателей микроклимата не наблюдается. Поддержание параметров микроклимата обеспечивается системами отопления и вентиляции.
Вентиляция
Вентиляция – обмен воздуха в помещениях для удаления избытков тепла, влаги, вредных и других веществ с целью обеспечения допустимых метеорологических условий и чистоты воздуха в обслуживаемой или рабочей зоне, согласно ГОСТ 12.4.021-75 ССБТ [41].
В лаборатории кафедры «Физической и коллоидной химии» вентиляция осуществляется естественным (через окна и двери) и механическими путями (вытяжные шкафы, подчиняющиеся правилам санитарной, экологической и пожарной безопасности).
Так как вся работа с вредными веществами проходит в вытяжном шкафу, рассчитаем его вентиляцию. Для ориентировочных расчетов количества необходимого воздуха принимают по кратности воздухообмена (Кр) по формуле 2.1:
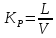 ,
,
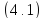
где V – объем помещения, м3;
L – общая производительность, м3/ч.
Кратность воздухообмена показывает, сколько раз в час меняется воздух в помещении. Величина Кр обычно составляет 1-10. Но для вентиляции вытяжного шкафа этот показатель намного выше. Площадь, занимаемая шкафом, составляет 1,12м2 (длина 1,6 м, ширина 0,7 м, высота (H) 2,0 м). Тогда объем одного шкафа с учетом воздухоканала (1,5) равен:
V= 1,12 ∙ 2+ 1,5=3,74 м3
Так как лаборатория оборудована 4 вытяжными шкафами, то общий объем составит 15м3.
Из паспортных данных находим, что для вытяжки используется вентилятор OSTBERG марки RFE 140 SKU производительностью – 320 м3/ч, напряженностью 230В. Зная его производительность, легко определить кратность воздухообмена по формуле 4.1:
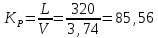 ч
-1
ч
-1
Коэффициент кратности воздухообмена 1 вытяжного шкафа равен 85,56.
Шум
Шум – беспорядочные колебания различной физической природы, отличающиеся сложностью временной и спектральной структуры, одна из форм физического загрязнения окружающей среды, адаптация к которому физически невозможна. Шум, превышающий определенный уровень способствует увеличению выделения гормонов.
Допустимый уровень шума — это уровень, который не вызывает у человека значительного беспокойства и существенных изменений показателей функционального состояния систем и анализаторов, чувствительных к шуму.
Допустимые уровни звукового давления в зависимости от частоты звука принимаются в соответствии с ГОСТ 12.1.003-83 ССБТ [42], представлены в таблице 4.3.
Таблица 4.3 – Допустимые уровни звукового давления в октавных полосах частот и эквивалентные уровни шума на рабочих местах
|
Рабочие места |
Октавные полосы со среднегеометрическими частотами (Гц) в уровнях звукового давления (дБ) |
Эквивалент уровня шума, дБА | |||||||||
|
31,5 |
63 |
125 |
250 |
500 |
1000 |
2000 |
4000 |
8000 |
50 | ||
|
Помещение лабораторий для проведения экспериментальных работ |
86 |
71 |
61 |
54 |
49 |
45 |
42 |
40 |
38 | ||
Защита от шума, согласно СНиП 23-03-2003 [43], должна обеспечиваться разработкой шумобезопасной техники, применением средств и методов коллективной зашиты, применением средств и методов коллективной защиты, применением средств индивидуальной защиты, которые подробно классифицируются в ГОСТ 12.1.003-83 ССБТ.
Источником постоянного шума в лаборатории являются работающие вытяжные шкафы. Уровень шума оценивается около 45 дБ, т.е. не превышает установленные нормативы.
Освещенность
Освещённость – световая величина, равная отношению светового потока, падающего на малый участок поверхности, к его площади. Освещение регламентируется в соответствии с СП 52.13330.2011 [44].
Производственное освещение бывает:
естественным (обусловлено прямыми солнечными лучами и рассеянным светом небосвода, меняется в зависимости от географической широты, времени суток, степени облачности, прозрачности атмосферы, времени года, осадков и т.д.);
искусственным (создаётся искусственными источниками света). Применяется при отсутствии или недостатке естественного освещения. Рациональное искусственное освещение должно обеспечивать нормальные условия для работы при допустимом расходе средств, материалов и электроэнергии;
при недостаточности естественного освещения используется совмещенное (комбинированное) освещение. Последнее представляет собой освещение, при котором в светлое время суток используется одновременно естественный и искусственный свет.
В химической лаборатории естественное освещение осуществляется за счет одного бокового окна. Естественного света недостаточно, поэтому используется искусственное освещение. Оно осуществляется 8 лампами OSRAM L 30. Оптимальное освещение лаборатории достигается при смешанном освещении.
Электробезопасность
Согласно ГОСТ 12.1.009-76 ССБТ [45], электробезопасность – система организационных и технических мероприятий и средств, обеспечивающих защиту людей от вредного и опасного воздействия электрического тока, электрической дуги, электромагнитного поля и статического электричества.
В химической лаборатории источником поражения электрическим током является электрическое оборудование – дистиллятор, термостат, электрические плитки, электронные весы, электророзетки. Общие требования безопасности электрического оборудования, в том числе встроенных вычислительных устройств, устанавливает ГОСТ Р 52319-2005 [46].
Электрический ток, проходя через организм человека, оказывает на него следующие типы воздействий: термическое, электролитическое, механическое, биологическое. Для обеспечения защиты от поражения электрическим током в электроустановках должны применяться технические способы и средства защиты согласно ГОСТ 12.1.030-81 ССБТ [47].
В соответствии с правилами устройства электроустановок ПУЭ [48] все помещения в отношении опасности поражения людей электрическим током делят на три категории: без повышенной опасности; с повышенной опасностью; особоопасные.
Помещение лаборатории относится к категории – без повышенной опасности. Для обеспечения защиты от поражения электрическим током в электроустановках должны применяться технические способы и средства защиты.
Пожаробезопасность
Согласно ГОСТ 12.1.004-91 ССБТ [49], пожар – это неконтролируемый процесс горения, характеризующийся социальным и/или экономическим ущербом в результате воздействия на людей и/или материальные ценности факторов термического разложения и/или горения, развивающийся вне специального очага, а так же применяемых огнетушащих веществ.
Причинами возможного возникновения пожара в лаборатории являются нарушение техники безопасности, неисправность электрооборудования, электропроводки и т.д.
В соответствии с НПБ 105-03 [50] помещение относится к категории «В1», т.е. пожароопасному, где находятся горючие и трудногорючие жидкости, трудногорючие вещества и материалы, пластик, способные только гореть. Согласно СНиП 21-01-97 [51] здание имеет II степень огнестойкости.
В случае возникновения пожара предусматриваются эвакуационные пути, которые должны обеспечивать безопасную эвакуацию людей. Высота горизонтальных участков путей эвакуации должна быть не менее 2м, ширина горизонтальных участков путей эвакуации должна быть не менее 1,0м. Пути эвакуации освещены.
В лаборатории соблюдены все правила пожаробезопасности в соответствии с существующими нормативами.
Чрезвычайные ситуации
Согласно ГОСТ Р 22.0.05-97 [52] чрезвычайная ситуация (ЧС) - неожиданная, внезапно возникшая обстановка на определенной территории или объекте экономики в результате аварии, катастрофы техногенного характера, которые могут привести к человеческим жертвам, ущербу здоровью людей или окружающей среде, материальным потерям и нарушению условий жизнедеятельности людей.
В химической лаборатории возможны следующие причины ЧС:
нарушение техники безопасности;
возгорание электроприборов;
нарушение изоляции электрооборудования;
В связи с возможными причинами ЧС в лаборатории составлена таблица 4.4 возможных чрезвычайных ситуаций.
Способами защиты от возможных ЧС являются регулярные инструктажи по технике безопасности и поведению в ЧС; регулярная проверка электропроводки; наличие плана эвакуации.
Таблица 4.4 – Возможные чрезвычайные ситуации в лаборатории
|
Возможная чрезвычайная ситуация |
Причина возникновения |
Меры по устранению ЧС |
|
Поражение электрическим током |
- нарушение техники безопасности по работе с электрическим током; - нарушение целостности изоляции, в следствии старение изолирующих материалов. |
Отключить электроэнергию общим рубильником; вызвать пострадавшему скорую помощь; при необходимости оказать первую помощь; сообщить о инциденте сотруднику ответственному за технику, для установления причины ЧС. |
|
Пожар в помещении лаборатории. |
- нарушение техники пожарной безопасности; - короткое замыкание; |
Обесточить действующие в лаборатории оборудование; вызвать пожарную команду, приступить к тушению пожара огнетушителями; сообщить о инциденте сотруднику ответственному за технику, для установления причины ЧС. |
Выводы по разделу БЖД
В разделе безопасность жизнедеятельности рассмотрены следующие факторы:
параметры микроклимата соответствуют нормативным документам и создают комфортные условия в химической лаборатории;
концентрация вредных веществ в воздухе лаборатории при получении халькогенидных пленок удовлетворяют гигиеническим нормативам. В лаборатории имеются все необходимые индивидуальные и коллективные средства защиты от влияния вредных веществ;
проведенный расчет вентиляционной системы вытяжного шкафа, на базе вентилятора OSTBERG марки RFE 140 SKU, производительностью –320 м3/ч, напряженностью –230В обеспечивает возможность сведения к минимуму вредного воздействия на человека химических реагентов и по расчетным данным, обеспечивает достаточную кратность воздухообмена – 86;
шум на рабочем месте соответствует стандартным нормам;
достаточная освещенность лаборатории реализуется преимущественно за счет искусственного освещения;
по опасности поражения электрическим током химическая лаборатория относится к помещениям без повышенной опасности, все токоведущие части используемых приборов изолированы и заземлены.
Рассмотрена так же пожароопасность данного лабораторного помещения. В данном случае его можно отнести к категории "В1", степень огнестойкости равна II.
Для предотвращения ЧС в УрФУ регулярно проводится инструктаж с лицами, ответственными за обеспечение безопасности персонала и учащихся. В качестве примера ЧС было рассмотрено поражение электрическим током при неисправном электрооборудовании.