
9738_Metodichka_virusologiya
.pdf% подрібненого промитого агару. Суміш кип’ятять до повного розчинення агару, помішуючи її. Потім гарячий розчин фільтрують через ватяно-марлевий фільтр і стерилізують протягом 5 хв при температурі 115 °С у колбах, закритих ватними пробками.
М’ясо-пептонний желатин. До 1 л м’ясо-пептонного бульйону додають 100―150 г желатину і залишають для розбухання, підігрівають до повного розчинення желатину. Встановлюють слабколужну реакцію і кип’ятять протягом 5 хв. Далі розчин охолоджують до 40―50 °С, додають змішаний з водою білок курячого яйця і знову підігрівають. При цьому білки випадають в осад і середовище стає прозорим. Його фільтрують гарячим і стерилізують текучою парою (метод тиндалізації).
Бобовий агар. 100 г білої квасолі або бобів заливають 1 л води і обережно кип’ятять, уникаючи розтріскування бобів і перетворювання крохмалю на клейстер. Гарячий відвар фільтрують і додають 2% агару. Агар розплавлюють в автоклаві, осаджують колоїдні частинки. Одержане середовище фільтрують і стерилізують так само, як і при виготовленні інших агарових середовищ.
Картопляне поживне середовище. З неушкоджених бульб картоплі вирізають плоскі шматочки, поверхню яких натирають крейдою для нейтралізації кислої реакції клітинного соку, і розкладають їх у чашки Петрі на зволожений фільтрувальний папір. У разі застосування пробірок краще вирізувати із бульб циліндричні шматочки за допомогою коркового свердла. Чашки і пробірки з картопляним середовищем стерилізують в автоклаві протягом 10 хв при тискові 0,5 атм. На цьому середовищі добре вирощуються картопляна паличка та інші гетеротрофні мікроорганізми.
Сусло-агар. До пивного сусла додають 2% очищеного агару. Середовище розварюють в автоклаві з відкритим вентилем і використовують для вирощування молочнокислих бактерій і дріжджів.
Щоб приготувати поживне середовище із молока, збиране молоко розливають у пробірки приблизно по 10 мл, закривають ватними тампонами і стерилізують методом тиндалізації. В молочному середовищі містяться всі поживні речовини, необхідні для гетеротрофних мікроорганізмів.
Сухий поживний агар. У навчальних мікробіологічних лабораторіях найчастіше виготовляються поживні середовища з порошку сухого поживного агару або інших видів сухих поживних середовищ (залежно від мети занять), що випускаються мікробіологічною промисловістю. Для цього беруть 5 г порошку сухого поживного агару на 100 мл холодної дистильованої води, старанно розмішують і нагрівають, помішуючи, до повного розчинення агару. Якщо розчин мутний, його фільтрують, а потім розливають у пробірки і стерилізують в автоклаві протягом 20 хв при 120 °С.
РОЗЛИВАННЯ ПОЖИВНИХ СЕРЕДОВИЩ.
Для проведення лабораторних занять у навчальних лабораторіях поживні середовища виготовляють, як правило, про запас і зберігають у великих колбах. Перед або на початку заняття середовища розливають у пробірки або чашки Петрі (залежно від мети занять). Тверді поживні середовища перед розливанням необхідно розплавити в автоклаві з відкритим вентилем або на водяній бані.
Після розплавлення середовище розливають у чашки Петрі, пробірки або інший посуд (залежно від мети роботи), дотримуючись умов стерильності. Для цього на полум’ї спиртівки або газового пальника обпалюють горла колб, пробірок, корки тощо. Посуд із середовищем піддають стерилізації. Поживне середовище розливають у боксовій кімнаті.
Контрольні питання
1.Для чого призначені поживні середовища?
2.Як розрізняють середовища за походженням, консистенцією, призначенням?
3.Які вимоги до поживних середовищ?
4.Які поживні середовища ви знаєте? Умови приготування поживних середовищ.
ЛАБОРАТОРНА РОБОТА № 4
Тема: Культивування, посів, зберігання і препарати мікроорганізмів
Мета: Ознайомитисьз методиками посіву, пересівутакультивування мікроорганізмів. Матеріали та обладнання: 1) термостат; 2) чашки Петрі; 3) конічні колби (0,2-0,5 л); 4)
електроплитка; 5) бактеріологічні петлі та препарувальні голки, 6) фільтрувальний папір; 7) стерильні пробірки; 8) МЛА, 9) чисті культури на МПА; 10) спиртівки; 11) вода водопровідна, 11) мікроскоп, 12) предметні та накривні скельця, 13) препарувальні голки, 14) мікробіологічна петля; 15) термошафа, 16) холодильник.
План
1.Культивування і техніка посіву.
2.Способи зберігання мікроорганізмів.
3.Методи приготування препаратів мікроорганізмів.
1. КУЛЬТИВУВАННЯ І ТЕХНІКА ПОСІВУ МІКРООРГАНІЗМІВ
Культура ― мікроорганізми, які розвиваються на поживному середовищі. Культивування (лат. cultus ― вирощування) ― це вирощування мікроорганізмів на
поживних середовищах.
Серед мікробних культур розрізняють:
-чисті культури;
-елективні культури.
Чистою культурою називають мікроорганізми одного виду, що походить з однієї клітини або спори.
Елективні культури (культури нагромадження) одержують на елективних середовищах. Для цих культур використовують середовища, склад яких найкраще задовольняє потреби певної групи мікроорганізмів.
Посів – це внесення клітин мікроорганізмів чи якого-небудь досліджуваного матеріалу (зразки ґрунту, проби води) в стерильне поживне середовище для отримання чистої чи нагромаджуючої культури мікроорганізмів.
Пересівання ― пасируванням (лат. passus ― чергування) ― перенесення культури мікроорганізмів на свіже стерильне середовище.
Якщо в досліджуваному матеріалі містяться різні види мікроорганізмів, для одержання чистої культури або ізольованих колоній цих мікробів в мікробіології застосовують: метод розведень, метод виділення чистої культури з окремої колонії, метод виділення чистої культури з однієї клітини та інші.
Посів (або пересів) завжди проводять поблизу пальника (спиртівки).
Звичайно мікроорганізми вирощують при певній постійній температурі в термостатах або термостатних кімнатах.
Інкубація ― культивування мікроорганізмів при певній температурі. Вирощують мікроорганізми в скляному посуді: пробірках, колбах, чашках Петрі.
В пробірках мікроорганізми культивують як в рідких, так і на щільних середовищах. Рідким середовищем для аеробних культур заповнюють звичайно 1/3 пробірки, для аеробних ― 2/3. Після стерилізації пробірки з незагуслим середовищем розкладають на рівній поверхні столу під нахилом для отримання скошеноїповерхні агару.
Щільне середовище, яке загусло при вертикальному положенні пробірки, називають «стовпчиком». Стовпчики, які займають 1/3―1/2 пробірки, використовують для посіву культури уколом.
Пробірки із середовищами і культурами при роботі слід встановлювати в штативах; пробірки з культурами при інкубації або зберіганні― в картонній коробці.
Мікроорганізми в колбах культивують тільки на рідких поживних середовищах. Для аеробних мікроорганізмів середовище наливають тонким шаром, для анаеробних колбу
заповнюють на 2/3. В чашках Петрі мікроорганізми культивують лише на щільних середовищах.
ЗАВДАННЯ:
І. Ознайомитись з чистими і накопичувальними культурами мікроорганізмів, інструментарієм, необхідним для посіву і пересіву культур. Розглянути скошені середовища, стовпчики; культури, вирощені в пробірках, чашках Петрі, колбах. Вміти відмітити колонії мікроорганізмів.
II. Ознайомлення з технікою посіву мікроорганізмів.
Посів культури:
1.посів у чашку Петрі;
2.посів на косий агар у пробірках; - посів штрихом; - посів уколом;
3.із пробірки в пробірку.
Посів у чашку Петрі
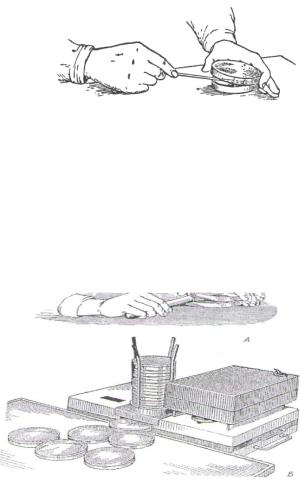
Хід роботи: Перед посівом на тверде поживне середовище його спочатку готують: розливають, розплавленим і охолодженим до 50 °С. Стерильні чашки Петрі виставляють на рівну поверхню, обпалюють на спиртівці отвір пробірки з середовищем, піднявши кришку чашки з одного боку, наливають поживне середовище, обережно закривають чашку кришкою і заливають до застигання агару (рис. 12).
Рис. 12. Розливка поживного середовища в чашки Петрі:
А – ручка; Б – автоматична за допомогою універсального приладу-автомата конструкції Ю.Е. Бартошевича і А.І. Чепурного
Піднявши край чашки, проводять посів петлею або шпателем (рис. 13) і закривають чашку. Підписують і розміщують її у термостаті догори дном, щоб крапельки води, які утворюються з пари на кришці чашки, не потрапили на поверхню середовища і не розмивали ізольовані колонії. Ставлять чашки у термостат для вирощування протягом 2―7 діб, залежно від швидкості росту культури.
Рис. 13. Посів на пластинку МПА в чашці Петрі
Посів на косий агар у пробірках штрихом.
Висівають мікроорганізми в щільне скошене середовище. Лівою рукою горизонтально тримають пробірку з середовищем (рис. 14). Правою рукою беруть петлю, обпалюють її на полум’ї спиртівки, охолоджують і вводять у посудину з досліджуваним матеріалом. Виймають пробку з пробірки, обпалюють отвір пробірки на спиртівці, вводять петлю з
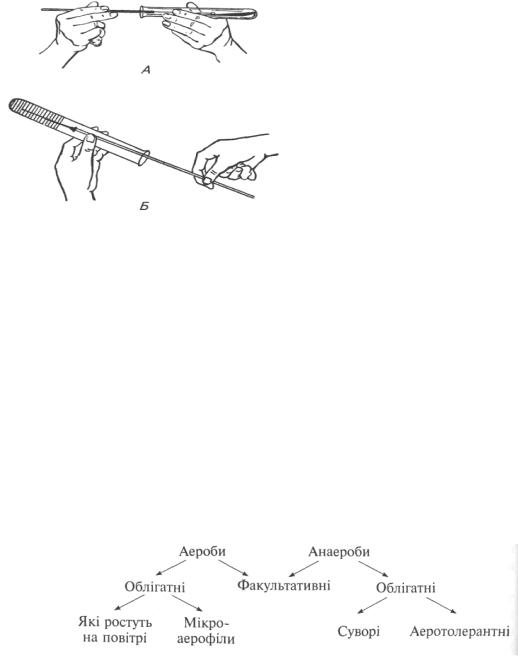
культурою в пробірку легким рухом проводять пряму або зигзагоподібними рухами розсівають культуру по поверхні косого агару, від стінки пробірки до іншої стінки пробірки. Виймають петлю, знову обпалюють край пробірки (і пробку), закривають пробірку і ставлять у термостат.
Посів уколом у стовпчик поживного середовища
Висівають мікроорганізми в щільне скошене середовище, застосовують для вирощування анаеробів, для виявлення характерних ознак бактерій або з метою тривалого зберігання культур (рис. 14). Для цього стерильною голкою беруть чисту культуру із колонії, обпалюють край пробірки, і тримаючи її дном догори, голкою роблять прокол до дна пробірки. Виймають петлю, знову обпалюють край пробірки (і пробку), закривають пробірку і ставлять у термостат.
Рис. 14. Методи посіву мікроорганізмів: А ― на косий агар у пробірках штрихом; Б ― уколом у стовпчик МПА
Посіві мікроорганізмів із пробірки в пробірку
При посіві клітин мікроорганізмів із пробірки в пробірку обидві пробірки (одну з культурою, іншу із стерильним поживним середовищем) беруть в ліву руку. Одну пробірку зажимають між вказівним і середнім пальцями. Другу ― між середнім і безіменним пальцями. Вона повинна лежати паралельно першій.
Пробірку необхідно утримувати під нахилом, щоб гарантувати стерильність культури. Якщо їх тримати вертикально, то можливе попадання інших клітин мікроорганізмів.
В полум’ї спиртівки ретельно обпалюють бактеріологічну петлю, держачи її в правій руці. Мізинцем правої руки виймають із другої пробірки ватну пробку і зажимають її між мізинцем і долонею, пробку першої пробірки зажимають між безіменним і середнім пальцями правої руки.
Петлю вводять в пробірку з культурою. Платинова петля охолоджується дуже швидко. Легким дотиком її до колонії мікроорганізмів беруть невелику кількість мікробної маси і переносять в другу пробірку.
Пробки перед тим, як закрити пробірки, обпалюють в полум’ї. Зручніше спочатку закрити першу пробірку, потім другу.
Стосовно кисню мікроорганізми можуть бути поділені на такі фізіологічні групи:
0блігатні аероби ― мікроорганізми для росту яких необхідним є молекулярний кисень. До них належить більшість прокаріотів.
0блігатні анаероби ― мікроорганізми, у яких катаболітичні та анаболітичні процеси відбуваються без участі О2. До цієї групи належать маслянокислі, метаноутворюючі, сульфатредукуючі та інші бактерії. Між цими двома групами існують проміжні форми.
Культивування аеробів і анаеробів на поживних середовищах здійснюють різними методами. Вибір того чи іншого метода насамперед залежить від типу живлення і дихання мікроорганізмів.
Аеробні бактерії найчастіше вирощують за допомогою культивування їх на поверхні твердих і рідких середовищ.
Анаеробні мікроорганізми при вирощуванні потребують видалення кисню з поживного середовища.
Методи видаленні кисню при вирощуванні анаеробів поділяються на:
-фізичний;
-хімічний;
-біологічний.
1. Фізичний метод при застосуванні високих температур, тобто поживне середовище перед посівом анаеробних культур кип’ятять протягом 15―20 хв для видалення з нього повітря. Після цього середовище швидко охолоджують і одразу ж проводять посів.
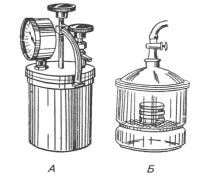
Культивування анаеробів здійснюють також і в анаеростатах та вакуумексикаторах, з яких можна викачувати за допомогою насосів повітря, або заповнювати їх індиферентним газом (азот, водень). Ступінь розрідження в анаеростатах (рис. 15) визначають за допомогою вакуумметра.
Рис. 15. Металевий мікроанаеробостат (А), Скляний вакуумексикатор (Б)
2.Хімічний метод ― полягає у додаванні до середовища редукуючих речовин: піровиноградну кислоту, глюкозу, цистеїн, аскорбінову кислоту тощо. Пробірки з поживним середовищем заливають вазеліновою олією.
3.Біологічний метод ― ґрунтуються на спільному культивуванні анаеробів з аеробами. З твердого поживного середовища у чашці Петрі стерильним скальпелем посередині вирізують смужку. На одну половину чашки висівають анаеробну культуру ―
Clostridium pasteurianum, на другу ― Serratia marcescens, яка є облігатним аеробом. Чашку заливають парафіном або заклеюють пластиліном і ставлять у термостат на вирощування. Після того як використаний кисень, починається ріст клостридія.
При виділенні чистих культур різних організмів (бактерій тощо) виконуються основні операції:
1)посів досліджуваного матеріалу;
2)виділення чистої культури;
3)визначення (ідентифікація) цієї культури.
Визначення чистоти культури мікроорганізмів проводять різними методами:
1.Візуальний полягає у виявленні характеру росту культури на поверхні косого агару поживного середовища. Якщо штрих на поверхні є однорідним, то культура вважається чистою.
2.Мікроскопування ― вибирають колонію з однорідним характером росту, чітко ізольовану від інших. З цієї колонії виготовляють фіксований препарат і вивчають його під мікроскопом за допомогою імерсійної системи. Якщо в полі зору всі клітини виявляться
морфологічно однорідними, то культура є чистою.
3. При пересіві на кілька поживних середовищах спостерігається однаковий характер росту колоній, тоді можна вважати, що виділена культура є чистою.
2. СПОСОБИ ЗБЕРІГАННЯ МІКРООРГАНІЗМІВ.
При тривалому зберіганні мікроорганізмів в лабораторних умовах можуть змінитись окремі їх фізіологічно-біохімічні або морфологічні особливості.
Способи зберігання:
1.пасирування ― за допомогою пересівів;
2.на поживному середовищі в холодильнику;
3.під шаром стерильного вазелінового масла;
4.в ампулах з рідким азотом;
5.ліофілізація ― висушування культури мікроорганізмів із замороженого стану;
6.сублімація ― зволоження культури мікроорганізмів із замороженого стану;
7.в стерильному ґрунті чи середовищі (спорові).
Пасирування (субкультивування) ― традиційний метод зберігання, пересів на свіже поживне середовища інтервал залежить від виду мікроорганізму, середовища і умов зберігання. Деякі види мікроорганізмів вимагають частих пересівів, інші можна не пересівати більше місяця. Не можна допускати пересихання середовища. Пробірки з культурою обгортають папером і зберігають в умовах, коли процеси життєдіяльності доведені до мінімуму, наприклад, в холодильнику при 5―8 оС.
Умови зберігання культур:
1.чистота культури;
2.періодичні пересіви;
3.необхідне поживне середовище;
4.холодне місце.
3. МЕТОДИ ПРИГОТУВАННЯ ПРЕПАРАТІВ МІКРООРГАНІЗМІВ.
Для вивчення мікроорганізмів за допомогою світлового мікроскопа виготовляють мікропрепарат з досліджуваного матеріалу (суспензії мікробних культур, культури вирощені на твердих живильних середовищах тощо).
Хід роботи:
Готують мікропрепарати на предметних скельцях розмірами 76x26 мм, завтовшки 1,2―1,4 мм. Окрім предметних скелець, для приготування препаратів живих мікробів необхідні й накривні (розмірами 14x14 або 18x18 мм). Товщина накривних скелець не повинна перевищувати 0,15―0,17 мм.
Предметні та накривні скельця повинні бути старанно очищені й знежирені так, щоб крапля води рівномірно розтікалася по їхній поверхні. Найкраще знежирювати скельця хромовою сумішшю (біхромат калію ― 50 г; сірчана кислота ― 100 г; вода ― 1000 мл), після чого їх промивають водою, кип’ятять у 1―2 %-му розчині соди протягом 15 хв., знову промивають дистильованою водою, висушують і зберігають у суміші спирту з ефіром у банках з притертими корками.
Перед виготовленням препарату предметне скельце старанно протирають марлею або стерилізують його на полум’ї спиртівки і після охолодження наносять краплину суспензії мікробної культури або виготовляють мазок.
ФІКСОВАНІ ПРЕПАРАТИ МІКРООРГАНІЗМІВ
Найчастіше вивчення морфології мікроорганізмів пов’язане з приготуванням зафарбованих препаратів (мазків). Для цього спочатку з чистих культур мікробів або із досліджуваного матеріалу готують мазок, висушують фільтрувальним папером і оглядають препарат під мікроскопом з імерсійним маслом. Для попередження забруднення культур мікроорганізмів під час приготування препаратів для мікроскопії необхідно дотримуватись при роботі стерильності.
Виготовлення мазка.
1.Для приготування мазка із культури мікробів, вирощених на рідкому живильному середовищі, спочатку беруть у праву руку бактеріологічну петлю (тримають як олівець) проводять її фламбування (прокалюють) в полум’ї пальника. Потім, не випускаючи петлі із правої руки, беруть у ліву руку пробірку чи колбу із мікроорганізмами. Над запаленим пальником її відкривають (безіменним пальцем і мізинцем правої руки захвачують і виймають із пробірки (колби) ватно-марлевий корок, тримаючи його у такому положенні під час усіх наступних маніпуляцій. Вийнявши корок, обпалюють край отвору пробірки (колби) над полум’ям пальника (стерилізують), вводять в неї через полум’я стерильну петлю, охолоджують її на стінці пробірки (колби), набирають краплю середовища на петлю. Потім її виймають, а пробірку (колбу) закривають, обпалюючи край і корок, ставлять у штатив на стіл. Краплю взятого середовища наносять петлею на середину знежиреного предметного скла і круговими рухами розтирають по склу (готують мазок). Площа мазка повинна бути в діаметрі 1,5―2 см. Чим тонший мазок, тим він якісніший. Петлю прокалюють у полум’ї пальника і ставлять у штатив (рис. 2).
2.Для приготування мазка із мікроорганізмів, вирощених на твердому живильному середовищі, спочатку на чисте обезжирене предметне скло наносять краплю стерильної води стерильною петлею, потім беруть у ліву руку пробірку чи колбу із культурою мікробів і тримають так, щоб добре було видно поверхню живильного середовища із колоніями мікроорганізмів. Фламбують (прокалюють) петлю у полум’ї пальника і дотримуючись тих же правил стерильності, відкриваючи колбу, виймають корок, обпалюють край отвору над полум’ям пальника, вводять через полум’я стерильну петлю, охолоджують її на стінці всередині пробірки (колби) і набирають на петлю невелику кількість мікробної маси із твердого живильного середовища. Петлю виймають, а пробірку над полум’ям закривають корком (обпалюючи край пробірки і корка) і ставлять у штатив або на стіл. Петлю із культурою мікробів вносять у краплину води на предметне скло і коловими рухами розтирають по склу (готують мазок). Петлю прокалюють у полум’ї пальника і ставлять в штатив.
Фіксація мазка. Фіксація ― обробка живого об’єкту, яка дає можливість швидко перервати його життєві процеси, в той же час зберегти його тонку структуру. Фіксація мазка мікроорганізмів дає можливість зробити мікроорганізми більш чутливішими до фарби.
Мета фіксації ― вбити мікроби, прикріпити їх до скла і поліпшити їх наступне фарбування.
Фіксацію мазка проводять двома способами:
-висушуванням над полум’ям спиртівки;
-за допомогою хімічних сполук ― фіксуючими рідинами.
Висушування мазка. На предметне скельце наносять мікробіологічною петлею невеличку кількість досліджуваного матеріалу і розмазують його по склу тоненьким шаром. Приготовлений мазок із колонії мікроорганізмів, вирощених на рідкому або твердому живильному середовищі, висушують на повітрі або в струмі теплого повітря. Для цього предметне скло мазком догори тримають за повздовжні ребра високо над полум’ям пальника (на висоті 15―20 см). Скельце з виготовленим мазком розміщують на спеціальному штативі зі скляних трубочок (рис. 16) і висушують при кімнатній температурі.
Рис. 16. Штатив для предметних скелець
При фіксації мазка мікроорганізмів за допомогою хімічних сполук на мазок наливають фіксатор або препарат цілком занурюють у посудину з фіксуючою рідиною і витримують
певний час. Наприклад, фіксацію мазка етиловим спиртом чи сумішшю Никифорова проводять протягом 10―15 хв.
Хімічні фіксуючі речовинами ― етиловим або метиловим спиртом, ацетоном, а також їхніми сумішами. Необхідно пам’ятати, що під час надмірного перегрівання або фіксації вологого препарату мазок псується: відбувається денатурація і звертання білка, порушується морфологія і структура бактерій. При недостатній фіксацій мікроби не вбиваються, що робить препарат небезпечним, і не приклеюються до скла, а під час подальшої обробки легко змиваються з нього.
Фарбування мазка. Зафіксований препарат відмивають, якщо фіксатором була рідина, і фарбують. Для цього препарат розміщують на штативі, і на мазок наносять кілька крапель розчину фарби, наприклад, метиленову синьку, генціан фіолетовий, еозин, фуксин (простий спосіб фарбування) та інші. Залежно від фарби і мети досліду тривалість фарбування становить від 1 до 5 хв. Фуксином червоним (сафранином) мазок фарбують ― 2 хв., метиленовим синім ― 5 хв. Після цього препарат промивають дистильованою водою, потім обережно підсушують його фільтрувальним папером (накладають на мазок зверху, не протираючи) і сушать на повітрі або високо над полум’ям пальника і вивчають під мікроскопом, спочатку з об’єктивом сухої системи 8х, а потім на сухий мазок наносять краплю імерсійної сполуки і переводять на об’єктив 90х. Крім простих існують і складні диференціальні методи фарбування (за Грамом тощо).
ВИГОТОВЛЕННЯ ПРЕПАРАТІВ ЖИВИХ МІКРООРГАНІЗМІВ
На препаратах убитих мікроорганізмів під впливом висушування, фіксації та фарбування частково змінюються їхні морфологічні та інші ознаки. Цих недоліків позбавлені препарати живих мікроорганізмів. До того ж на живих препаратах можна спостерігати за рухом, розмноженням мікробів тощо.
Препарати готують за допомогою мікробіологічної (бактеріологічної) петлі. Це тонкий дріт із платини або хромнікелю, який встановлено в спеціальний держак. Під час вивчення мікроорганізмів у живому стані використовується по-різному приготовлені препарати в незафарбованому стані:
«роздавлена крапля»;
«висяча крапля»;
препаратах «відбитків».
Для виготовлення препарату «роздавлена крапля» на середину стерильного предметного скла наносять бактеріологічною петлею краплю суспензії досліджуваної мікробної культури. Якщо мікроби ростуть на твердому поживному середовищі, то перед тим предметне скло змочують краплиною стерильної води, а тоді вже вносять бактеріальну масу. Потім накривне скло ставлять на край краплі і обережно опускають на неї, щоб не залишились пухирців повітря. Якщо мікроорганізми вирощені на рідкому живильному середовищі, то препарат готують без води.
Препарат «висяча крапля» виготовляють на спеціальному предметному скельці з луночкою. Краї луночки обмазують вазеліном.
На середину накривного скельця наносять бактеріологічною петлею невеличку краплю досліджуваного матеріалу, скельце швидко перевертають крапелькою вниз і накривають ним лунку так, щоб крапля була в центрі заглиблення і не торкалася його дна
(рис. 17).
Рис. 17. Виготовлення препарату«висяча крапля»
Препарат «відбитків» найчастіше виготовляють з мікроорганізмів, які ростуть на агарових пластинках у чашках Петрі. Скальпелем вирізують шматочок агарової пластинки з колонією досліджуваних мікробів і вміщують його на предметне скло колонією догори. Зверху скляною паличкою або петлею легенько притискують чисте накривне скельце. Потім накривне скло обережно знімають відбитком донизу кладуть на друге предметне скло в краплю води або метиленової синьки і роздивляються під мікроскопом при збільшенні 40х. Виготовлений у такий спосіб препарат вивчають під мікроскопом у сухій та імерсійній системах.
Фарбування живих мікрорган6ізмів. Застосовуючи низькі концентрації фарб, можна також фарбувати різні мікроорганізми і на живих препаратах, що дає змогу краще визначати їхню справжню форму і розміри. З цією метою найчастіше використовують метиленову синьку, нейтральрот та деякі інші малоотруйні фарби в розведенні 1:1000, 1:10000, 1:100000. На предметному склі за допомогою петлі змішують краплю мікробної культури з краплиною розчину фарби, накривають накривним скельцем і вивчають під мікроскопом.
Фарби та їх приготування. Фарбування має на меті зробити мікроорганізми більш помітними у досліджуваному матеріалі, а також полегшити вивчення їх будови.
Для фарбування мікробних клітин використовують анілінові фарби різних кольорів, які діляться на дві групи:
1)основні або ядерні барвники;
2)кислі або цитоплазматичні.
Основні барвники частіше використовують умікробіології. Види фарбування бувають:
―прості;
―складні (диференціальні).
Простий метод ― коли для фарбування використовується лише одна фарба.
При складному методі мазок фарбують декількома фарбами і додатково обробляють різними речовинами ― спиртом, кислотою (наприклад, фарбування за Грамом).
Час фарбування (експозиція) наводиться в методиках: для фуксина червоного ― 2 хв, сафранина ― 2 хв, метиленового синього ― 5 хв.
Для зберігання і приготування розчинів фарб готують насичені спиртові розчини. Приготування робочого розчину фарби беруть 10мл спиртового розчину і 90мл дистильованої води.
Контрольні питання
1.Які культури називаються чистими та накопичувальними елективними?
2.Яким чином здійснюється посів і пересів мікроорганізмів?
3.Як здійснити посів мікроорганізмів уколом і штрихом?
4.Назвати способи зберігання мікроорганізмів.
5.Які є препарати живих та неживих мікроорганізмів?
6.Назвіть послідовність приготування фіксованих препаратів?
7.Назвіть методи дослідження мікроорганізмів у живому стані.
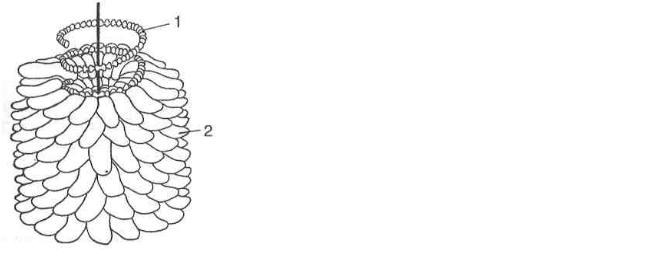
ЛАБОРАТОРНА РОБОТА № 5
Тема: Морфологія мікроорганізмів
Мета: Вивчити особливостібудови мікроорганізмів.
Матеріали та обладнання: 1)Біологічні мікроскопи XSM ― 10, XSM ― 20, 2) предметні та накривні скельця, 3) культура мікроорганізмів
План
1.Морфологія вірусів
2.Морфологія бактерій.
3.Морфологія актиноміцетів.
4.Морфологія грибів.
5.Морфологія найпростіших.
І. МОРФОЛОГІЯ ВІРУСІВ
Вірус (лат. virus ― отрута). Віруси можна побачити лише при електронному мікроскопуванні (рис. 18). Це облігатний паразит, який живе і розвивається тільки в живій клітині.
Вріони ― зрілі форми вірусів, які знаходяться в клітині господаря, мають крім нуклеїнової кислоти (РНК чи ДНК) білкову оболонку (капсид).
Віроїди ― віруси які складаються з нуклеїнової кислоти і не мають капсида.
Форми віріонів визначаються будовою білкової оболонки, в середині якої міститься нуклеїнова кислота (ДНК або РНК). Інфекційність вірусу пов’язана тільки з нуклеїновою кислотою. Оболонку віріонів називають капсидом, а структуру, яка містить нуклеїнову кислоту і капсид, ― нуклеокапсидом.
Капсиди вірусів утворені з білкових субодиниць, що повторюються в структурі та хімічній будові віріона. Майже всі віруси за структурою капсиду (типом симетрії) поділяються натри великі групи: спіральні, поліедричні, що являють собою ікосаедри ― правильні багатогранники, і віруси з комбінованим типом симетрії.
Віруси зі спіральною симетрією. Вірус тютюнової мозаїки (ВТМ) є типовим представником таких вірусів. ВТМ має форму порожнього циліндра діаметром 15 нм і завдовжки 300 нм. Віріон ВТМ містить одноланцюгову РНК, його капсид складається з однакових, розміщених спірально, білкових субодиниць. У кожній спіралі на три витки припадає 29 субодиниць. Загалом віріон містить 2130 (±2 %) ідентичних білкових субодиниць. Спіральний тип симетрії характерний не тільки для фітопатогенних вірусів, його знайдено і у вірусів, що вражають тварин і бактерії.
Рис. 18. Модель будови вірусу тютюнової мозаїки:
1 ― нуклеїнова кислота; 2 ― білкові субодиниці капсиду
Віруси з кубічною симетрією (ізометричні віруси). Із кристалографії відомо, що існують три типи фігур з кубічною симетрією: тетраедр (осі симетрії 2:3, найменша кількість структурних одиниць 12), октаедр (осі симетрії 4:3:2, число структурних одиниць 24) та ікосаедр, або двадцятигранник (осі симетрії 5:3:2, кількість субодиниць 60) (рис. 19).
