
- •Процессы синтеза, созревания, транспорта и деградации белков
- •Виды рибосом. Строение рибосомы, малая и большая субъединицы. Состав субъединиц – рибосомальные рнк, рибосомальные белки.
- •Функциональные центры рибосомы (а-сайт, р-сайт, птф-сайт, м-сайт, е-сайт).
- •Элонгация.
- •Компартментализация процессов, специфические структуры мРнк («кэп», полиА-хвост), многочисленность факторов трансляции. Полисома.
- •Транспорт
- •Деградация
-
Процессы синтеза, созревания, транспорта и деградации белков
Рибосома. – рибонуклеопротеиновые частицы (РНК + белок) / r-белки / рибосомальные белки. У прокариот рассеяны по всей цитоплазме, у эукариот локализованы в цитоплазе. В клетках с интенсивным синтезом белка часть рибосом прикреплены к ЭПР, часть свободны. На свободных рибосомах осуществляется синтез белка для внутриклеточных нужд, поэтому их больше в эмбриональных и быстроразмножающихся клетках. Все рибосомы цитоплазматического матрикса образуются в ядрышках эукариотических клеток. Эукариоты имеют специальные митохондриальные и хлоропластные рибосомы, они образуются в органеллах.
Виды рибосом. Строение рибосомы, малая и большая субъединицы. Состав субъединиц – рибосомальные рнк, рибосомальные белки.
Полные рибосомные частицы и их субъединицы обозначаются в соответствии с коэффициентом седиминтации, выраженном в единицах Сведберга.
Всем прокариотам свойственны 70S рибосомы. Соотношение белка к РНК – 2:1. Состоит из двух субъединиц: 50S и 30S. Каждая содержит рРНК и определенное число небольших белков. У E.coli малая субъединица состоит из 1 рРНК (16S) и 21 рибосомального белка (S1, S2, S3 и тд.). Большая субъединица содержит 2 рРНК (23S, 5S) и 31белок (L1, L2, L3 и тд.). Полная рибосома имеет ассиметричное строение. На малой 4 отдела: гоовка, шейка, тело и основание/платформа. У большой хорошо различим центральный выступ\протурбанец, в кот. находится 5S рРНК, основной массив, в кот. находится белок L7, и бороздка м/д ними, в кот. находится пептидилтрансферазный сайт. М\д большой и малой субъединицей образуется полость, в кот. открывается большинство активных сайтов рибосомы.
Эукариоты имеют 80S рибосомы. Имеют больше рРНК и белков. Их соотношение 1:1. Состоят из малой (40S) и большой (60S) субъединицы. Малая содержит 18S рРНК и 33 рибосомальных белка. Большая – 3 цепи рРНК (5S, 5.8S, 28S) и 45-50 белков.
Рибосомы органелл отличаются от цитомпазматических. Содержат 70% РНК и напоминают бактериальные рибосомы.
Функциональные центры рибосомы (а-сайт, р-сайт, птф-сайт, м-сайт, е-сайт).
Рибосома – кооперативная структура, кот. зависит от взаимодействия своих активных сайтов. Сайт А – участвует в связывании очередной аминоацил-тРНК, в нем находится кодон мРНК, кот. диктует рибосоме тип входящей аминоацил-тРНК/следующую аминокислоту растущего полипептида. Сайт Р – участок связывание пептидил-тРНК – растущий петтид, кот. связан своим С-концом с тРНК, кот. принесла последний аминокислотный остаток к рибосоме. Сайт Е – участок выхода тРНК из рибосомы. Деацелированная тРНК удерживается сайтом Е короткое время. У эукариот нет этого сайта, из Р-сайта уходит сразу в цитоплазму. Каталитический сайт пептидилтрансферазы – находится на границе А и Р-сайтов, катализирует образование пептидной связи. ГТФ-азный центр – место посадки ГТФ, содействует запуску гидролиза АТФ
Биосинтез рибосомы, этапы процессинга рРНК. Химические модификации рРНК. Особенности строения и созревания рибосомы эукариот.
Процессинг рРНК: нарезание первичного транскрипта, метилирование, сплайсинг. У эукариот все рРНК синтезируются как часть одного транскрипта. Он нарезается с помощью экзо и эндонуклеаз на зрелые рРНК. Предшественник содержит 18, 5.8, 28S рРНК и называется 45S РНК. Процессинг рРНК требует участия мяРНК. У некоторых организмов в составе предшественника 28S РНК находятся вставки/интраны, кот. удаляются в результате процессинга и фрагменты РНК сшиваются в результате сплайсинга.
У прокариот предшественник рРНК содержит 16, 23, 5S рРНК + несколько предшественников тРНК. 3 и 5’ концы сближены за счет комплиментарно прилегающих пар оснований. Такая структура разрезается РНКазойIII. Оставшиеся рибонуклеотиды отрезаются экзонуклеазами/подравнивание.
Малые ядрышковые РНК (мякРНК).
Малые ядерные РНК - особые РНК эукариот. Некоторые из них участвуют в процессинге, входя в сложный комплекс - сплайсингосому. Они способствуют вырезанию интронов из пре-мРНК и последующему сшиванию концов экзонов. Такие мяРНК называются U-PHK из-за необычайно большого количества в них урацила и его модифицированных форм. МяРНК функционируют в комплексе с белками, образуя малые ядерные рибонуклеопротеины (мяРНП).
Транспортная РНК.
1. На З'-конце молекулы всегда находятся четыре неспаренных нуклеотида, причем три из них - это обязательно ССА. 5' и З'-концы молекулы РНК образуют акцепторный стебель, благодаря комплиментарному спариванию 7 нуклеотидов.
2. У всех молекул имеется шпилька ТψС, обозначаемая так потому что она содержит два необычных остатка: риботимидин (Т) и псевдоуриднн (ψ), Тринуклеотид TψC всегда расположен в одном и том же месте петли. Сама шпилко состоит из 5 спаренных оснований, включая пару GC, кот. находится перед петлей.
3. В антикодоновой шпильке стебель всегда представлен семью спаренными основаниями. Триплет, комплементарный родственному кодону – антнкодон - находится в петле, состоящей из семи неспареных нуклеотидов.
4. Еще одна шпилька состоит из стебля длиной три-четыре пары нуклеотидов и петли варьирующего размера, часто содержащей урацил в восстановленной форме -дигидроурацил (Д-петля).
Процесс трансляции. Стадии синтеза белка. Аминоацил-тТРНК-синтетазы (АРСазы), строение, функции. Претрансферное и посттрансферное редактирование ошибочного синтеза аминоацил-тРНК. Этап инициации трансляции. Рамка считывания. Универсальный код. Старт-кодон, первая аминокислота. Факторы инициации. RBS-участки мРНК, последовательность Шайна-Дальгарно. трансляционно-инициаторные районы. Факторы элонгации. Элонгационный цикл. Терминация, стоп-кодоны. Факторы терминации. Особенности процесса трансляции у эукариот.
Трансляция — это перевод информации, заложенной в последовательности нуклеотидов мРНК, в последовательность аминокислотных остатков полипептидных цепей. В ходе трансляции синтезируются все белки клетки. Сначала происходит активирование аминокислот и присоединение их к соответствующим тРНК. Затем протекает сборка полипептидной цепи на рибосомах, что иногда называют собственно трансляцией. Как и другие матричные процессы, трансляция протекает в три этапа: инициация, элонгация, терминация.
Активирование аминокислот. Реакции протекают в растворимой части цитоплазмы.
На этой стадии происходит:
-
активирование аминокислот за счет энергии АТФ,
-
«узнавание» (рекогниция) тРНК своих аминокислот с помощью специальных ферментов,
-
акцептирование этих аминокислот.
Аминокислоты активируются особыми ферментами — аминоацил-тРНК-синтетазами (иногда их называют сокращенно АРСазами - осуществляют присоединение аминокислоты к молекуле транспортной РНК) и присоединяются к определенным тРНК. Ферменты обладают двойной специфичностью: к определенной аминокислоте и к соответствующей ей тРНК. Реакция активирования протекает в каталитическом центре фермента в два этапа.
-
АТФ + аминокислота => связанный с ферментом промежуточный продукт – аминоациладенилат. СООН-группа аминокислоты связывается ангидридной связью с б'-фосфатной группой АМФ с выделением пирофосфата, при этом аминоациладенилат приобретает от АТФ часть энергии, необходимой для образования пептидной связи.
I.
 II.
II.
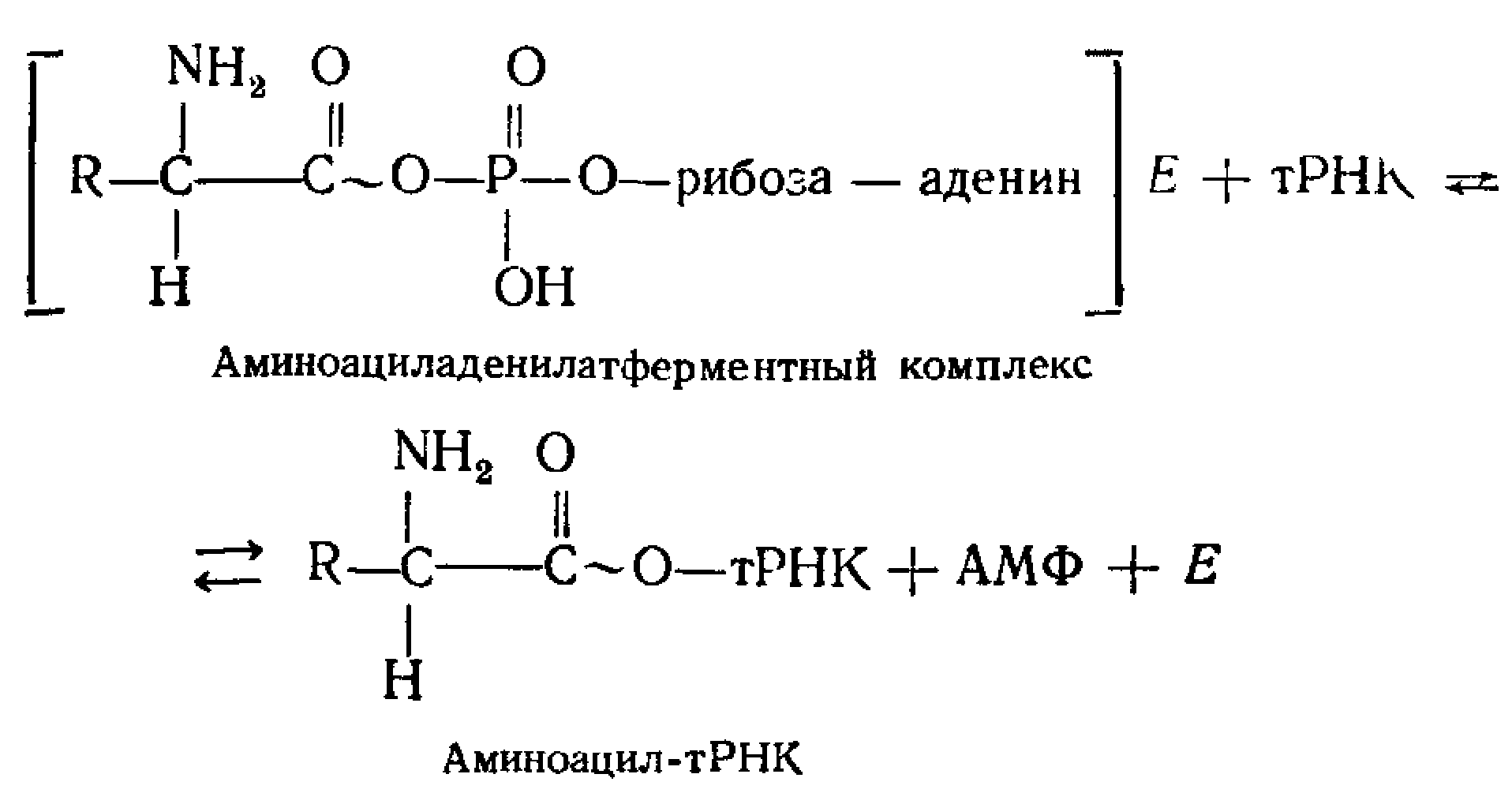
-
Перенос аминоацильного остатка на специфическую тРНК. СООН-группа аминокислоты образует сложноэфирную связь с З'-ОН-группой концевого аденозинового остатка тРНК.
Итог реакции: этерификация каждой аминокислоты соответствующей молекулой тРНК, т. е. образование аминоацил-тРНК. В ходе этого процесса каждая аминокислота активируется и связывается со специфичной для нее «своей» тРНК. Молекулы тРНК нагруженные аминокислотой переносятся к рибосомам, где образуется полипептидная цепь. => тРНК – адаптер, приспособленный для включения аминокислот в растущую цепь в определенном порядке.
Некоторые аминокислоты отличаются друг от друга очень слабо, например, лишь одной метильной группой (изолейцин и валин, аланин и глицин). Для таких случаев во многих аминоацил-тРНК синтетазах эволюционировали механизмы, избирательно расщепляющие ошибочно синтезированные продукты. Процесс их распознавания и гидролиза называют редактированием. Избирательное расщепление аминоацил-аденилата называют претрансферным редактированием, так как оно происходит до переноса аминокислотного остатка на тРНК, а расщепление готовой аминоацил-тРНК — посттрансферным редактированием. Претрансферное редактирование, как правило, происходит в том же активном центре, что и аминоацилирование. Посттрансферное редактирование требует попадания 3'-конца аминоацил-тРНК с прикреплённым к нему остатком аминокислоты во второй активный центр аминоацил-тРНК синтетазы — редактирующий. Этот второй активный центр есть не у всех аминоацил-тРНК синтетаз, а у тех, у которых есть, находится в отдельном домене глобулы фермента. Встречаются также свободно плавающие ферменты, участвующие в посттрансферном редактировании. После гидролиза разъединённые аминокислота и тРНК (или аминокислота и АМФ) высвобождаются в раствор.
Инициация. Инициация — это одна из наиболее сложных стадий трансляции. На этой стадии из отдельных компонентов собирается аппарат для синтеза белка и протекают подготовительные реакции:
-
Сборка рибосом – организующих центров процесса трансляции. Если рибосома не связана с мРНК, она диссоциирует на составляющие ее субъединицы (у прокариот — 30S и 50S, в эукариотических клетках — 40S и 60S).
-
В процессе трансляции полипептидная цепь начинает строиться с N-конца и завершается С-концом, т. е. имеет направление NН2СООН.
-
Началом синтеза белка в мРНК является сочетание трех нуклеотидов; АУГ. Если эти нуклеотиды стоят внутри цепи мРНК, то они кодируют аминокислоту метионин. Предполагают, что в некоторых случаях инициирующим кодоном может быть ГУГ (будучи внутренним, он кодирует аминокислоту валин).
-
В клетках прокариот существуют две метиониновые тРНК.
-
тРНКммет – акцептирует остатки аминокислоты метионина и включает их в полипептидные цепи.
-
тРНКфмет – служит для инициации синтеза белков, т. е. является инициаторной.
Обе эти тРНК акцептируют аминокислоту метионин, образуя метионил-тРНК.
Еслм
метионин присоединяется к тРНКфмет
,
то происходит реакция трансформилирования
с образованием формилметионин-тРНКфмет.
Блокирование аминогруппы метионина
формильным остатком позволяет этой
аминокислоте первой встать в рибосому,
начать рост полипептидной цепи.

-
Факторы инициации трансляции: IF-1, IF-2, IF-3 + ГТФ

Результат: собранная и готовая к синтезу рибосома
-
Функциональные центры – полости в рибосоме, где специфически связываются молекулы, участвующие в синтезе. 30S субъединица отвечает за выбор и связывание аминоацил-тРНК. Аминоацил-тРНК связывается в А-сайте/аминоацил-тРНК-связывающем на 30S субъединице, остальное свешивается в 50S субъединицу. Рядом с А-участком располагается Р-участок/пептидил-тРНК-связывающий, куда помещается пептидил-тРНК. Формилметионин-тРНКфмет занимает Р-сайт, ее антикодон УАЦ связан с кодоном АУГ на мРНК. А-сайт свободен, в него встает след. кодон мРНК и соответствующая ему амиоацил-тРНК.
У эукариот инициаторной (первой) также является метионил-тРНК, однако в отличие от таковой прокариот она не формилируется, а реагирует с факторами инициации eIF-1, elF-2, elF-3, с 40S- субчастицей рибосом и мРНК. Реакции идут по той же схеме, что и у прокариот.
Так на стадии инициации собирается весь аппарат для синтеза полипептидной цепи. Факторы инициации повторно используются для инициации синтеза новых цепей.
