- •Процессы репликации и транскрипции
- •Основные принципы репликации.
- •Особенности днк-полимеразы I.
- •Холофермент, днк-полимераза III, реплисома.
- •Элонгация
- •Терминация репликации
- •Репликация эукариот
- •Вырезание оснваний. Гликозилазы. Вырезание (эксцизия) повреждённых нуклеотидов. Комплекс ферментов, осуществляющих эксцизионную репарацию.
- •Механизм репарации неспаренных нуклеотидов. Выбор репарируемой нити днк.
- •Репарация двухнитевых разрывов: гомологичная пострепликативная рекомбинация и объединение негомологичных концов молекулы днк.
- •Транскриптоны прокариот. Строение промотора прокариот, структурные элементы.
- •Регуляторные элементы эукариот: цис-элементы, транс-действующие факторы. Тата-бокс, саат-бокс, gc-мотивы, энхансеры, сайленсеры.
- •Траскрипция генов класса I. Транскрипция генов класса II. Транскрипция генов класса III.
- •Базальные факторы транскрипции для рнк-полимеразы II. Формирование белкового комплекса на промоторе. Факторы элонгации и терминации.
- •Элонгация.
- •Процессинг рРнк у эукариот. Процессинг тРнк.
- •Процессинг мРнк. Модификация 5’-конца (кэпирование). Модификация 3’-конца (полиаденилирование). Сплайсинг первичных транскриптов мРнк, сплайсосома. Автосплайсинг. Альтернативный сплайсинг.
- •Редактирование рнк (эдитинг).
-
Процессы репликации и транскрипции
Основные принципы репликации.
Репликация ДНК - это процесс удвоения родительских молекул ДНК во время воспроизводства клеток живых организмов. То есть процесс репликации предшествует делению клеток. Репликация, как и транскрипция и трансляция, является матричным процессом. При репликации цепи молекулы ДНК расходятся и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. При этом нуклеотиды новых цепей спариваются комплементарно с нуклеотидами старых цепей (А с Т, Г с Ц). В результате образуются две дочерние двуспиральные молекулы ДНК, не отличимые от родительской молекулы. Каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Такой механизм копирования называется полуконсервативным. Каждая вновь синтезированная цепь антипараллельна родительской. Синтез одной цепи (лидирующей) происходит непрерывно, а др. (отстающей) – импульсно. Такой механизм называется полунепрерывным.
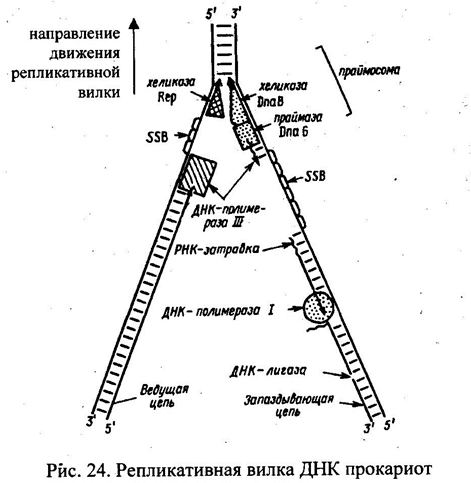
Строение репликативной вилки. Лидирующая нить, отстающая нить, фрагменты Оказаки. см. рисунок.

Ключевые ферменты, участвующие в синтезе ДНК.
Общие структурные черты ДНК-полимераз.
Работают по одному принципу: удлиняют цепь ДНК, добавляя к 3’-концу по 1 нуклеотиду. Выбор диктуется требованиям комплиментарности матричной ДНК. Черты:
Несколько независимых доменов, кот. в совокупности напоминают правую руку человека. ДНК связывается в небольшой выемке, образованной тремя доменами. Основу каталитического центра образуют консервативные аминокислотные мотивы в составе домена «ладонь». «Пальцы» правильным образом располагают матрицу в активном центре. «Большой палец» связывает ДНК на выходе из фермента и обуславливает высокую процессивность. В активном центре самые важные консервативные области всех трех доменов сближены и образуют непрерывную поверхность. Экзонуклеазная активность находится в независимом домене с собственным каталитическим центром. N-концевой домен внедрен в экзонуклеазный.
Особенности днк-полимеразы I.
Участвует в репарации поврежденной ДНК, также играет вспомогательную роль в репликации ДНК – удлиняет 3’-конец цепи, спаренной с матричной цепью и позволяет заполнить пробелы м/д фрагментами отстающих цепей, удлиняет фрагменты Оказаки с 3’-концов, одновременно удаляя рибонуклеозиды РНК-затравки, с кот. начинается каждый фрагмент Оказаки. ДНК-полимераза I способна удлинять 3’-конец одной цепей в месте разрыва в двуцепочечной ДНК и удалять нуклеотиды с 5’-конца того же разрыва (ник-трансляция) – важная роль в системе репарации.
ДНК-полимера» I доминирует нал всеми другими. Это оценочный полипептид массой 103 кДа, который может быть расщеплен на 2 части: С-концевой фрагмент, 68 кДа, фрагмент Кленова, облагает полимеразной и 3’->5' экзонуклеазными активностями; N-коицевой фрагмент, 35 кДа, обладает 5’->3' экзонуклеазной актнвностью.
Холофермент, днк-полимераза III, реплисома.
Холофермент представляет собой комплекс массо1 900кДа, содержащий 10 белков, подразделенных на 4 типа субкомплексов:
-
α, ξ, θ. Содержит 2 копии каталитической сердцевины. α – ДНК-полимеразная активность, ξ – 3’-экзонуклеазная активность, θ – стимулирует экзонуклеазу.
-
Содержит 2 субъединицы τ (тау) – служат для скрепления минимального фермента, обладающего каталитической активностью (α).
-
2 копии зажима (clamp) – отвечают за удержание минимального фермента на ДНК-матрицах. Каждый состоит из гомодимера субъединиц β. Главная роль – свести к минимуму вероятность отделения фермента от матрицы, прежде чем завершится процесс копирования.
-
γ – группа из 5 белков, кот. образуют клэмп-лоудер – приспособление для накладывания зажима на ДНК матрицу. Состоит из 2 δ, 1 γ, 1 ψ и 1 χ – субъединиц.

Реплисома - мультиферментный комплекс в бактериальной репликативной вилке, осуществляющий процесс полуконсервативной репликации; содержит ДНК-полимеразу и ряд др. белков.
ДНК-полимеразы эукариот.
ДНК-полимераза α – инициирует синтез новой цепи и отстающей. Ассоциирована с β-субъединицей и двумя небольшими белками с праймазной активностью, поэтому может синтезировать цепи заново. 2 функции: затравка и удлинение = α-праймаза.
ДНК-полимераза δ – элонгирует ведущую цепь
ДНК-полимераза ξ – участвует в синтезе отстающей цепи
ДНК-лигазы.
Необходимы для соединения цепей ДНК при репликации, репарации, рекомбинаци. ДНК-лигазы E.coli и фага Т4 – одиночные пептиды, способные соединять концы двух разных дуплексных фрагментов или разорванные концы цепей линейной или кольцевой ДНК. Т.о., с помощью ДНК-лигаз могут образовываться и линейные и кольцевые дуплексные молекулы ДНК.
ДНК-хеликазы.
Осуществляет расплетание цепей, используя энергию гидролиза АТФ. Функционирует в составе комплекса, осуществляющего перемещение репликативной вилки и репликацию расплетенных цепей. Для увеличения скорости несколько зеликаз могут действовать совместно.
SSB-белки.
Однонитевые связывающие белки, дестабилизируют спираль, связываются с одноцепочечным участком, тем самым ее стабилизируют, т.е. фиксируют участок одноцепочечной ДНК.
ДНК-топоизомеразы I и II, гираза.
При расплетении ДНК происходит вращение молекулы - изменение вторичной и третичной структур. Эти процессы катализирует группа ферментов, называемых топоизомеразами. Они вносят одно и двуцепочечные разрывы в ДНК, что позволяет молекуле нуклеиновой кислоты вращаться и становиться матрицей. По механизму действия различают топоизомеразы первого (I) и второго (II) типов.
Топоизомеразы типа I (у Е. coli - свивелаза) - вносят одноцепочечный разрыв в молекулу ДНК, топоизомеразы типа II (у Е. coli - гираза) - осуществляют двухцепочечный разрыв ДНК и перенос нитей ДНК через разрыв с последующим их сшиванием. При этом, осуществляя свои функции, топизомеразы остаются связанными с молекулой ДНК. В этих процессах топоизомеразами используется остаток тирозина, который осуществляет нуклеофильную атаку фосфатной группы ДНК с образованием фосфотирозина. В результате ферменты оказываются ковалентно связанными с 5’- или 3’- концами ДНК в месте разрыва. Образование такой ковалентной связи исключает необходимость затраты энергии при восстановлении фосфодиэфирной связи в одноцепочечном разрыве на заключительных стадиях реакции. У ДНК-топоизомераз типа I имеется один каталитический остаток тирозина на молекулу мономерного белка, тогда как димеры ДНК- топоизомераз II содержат по одному каталитическому остатку на каждую субъединицу, что обеспечивает создание ступенчатого двухцепочечного разрыва в молекуле ДНК.
Топоизомеразы выполняют функции шарниров, однако их действия противоположны. Топоизомеразы I, разрывая одну из цепей кольцевой суперспирализованной ДНК, раскручивают цепи и уменьшают число супервитков. Топоизомеразы II превращают расслабленную несверхспирализованную замкнутую кольцевую ДНК в суперспираль.
Стадии репликации: инициация, элонгация, терминация. Инициация образования новых цепей ДНК. Праймаза. Праймосома. Терминация репликации ДНК и расхождение дочерних спиралей у прокариот.
Терминация репликации в линейных геномах. Проблема репликации линейного незамкнутого фрагмента ДНК. Теломеры и теломерные повторы, теломерная петля. Теломераза. Механизм работы теломеразы. Особенности репликации ДНК эукариот. Репликоны эукариот.
Как и в случае биосинтеза других макромолекул клетки, процесс репликации условно разделяют на три основных этапа: инициацию, элонгацию и терминацию.
Репликация прокариот
Инициация
Хромосома прокариот чаще всего представлена единичной суперскрученной кольцевой молекулой с одним или двумя сайтами начала репликации. Для того чтобы каждая из двух цепей ДНК стала матрицей, для синтеза новой цепи, необходимо, чтобы нити ДНК расправились и отошли друг от друга. Установлено, что цепи ДНК раскручиваются не по всей длине, а на коротком участке. Здесь образуется вилка репликации - место удвоения ДНК.
При расплетении ДНК происходит вращение молекулы - изменение вторичной и третичной структур. Эти процессы катализирует группа ферментов, называемых топоизомеразами. Они вносят одно и двуцепочечные разрывы в ДНК, что позволяет молекуле нуклеиновой кислоты вращаться и становиться матрицей. По механизму действия различают топоизомеразы первого (I) и второго (II) типов.
На расплетенный участок родительской молекулы ДНК, с которого начинается репликация и который называется точкой начала репликации (или ориджином, oriС) «садятся» инициаторные белки. Инициация репликации в oriC начинается с формирования комплекса, в который входят шесть белков DnaA, DnaB, DnaC, HU, гираза и SSB.
Сначала с девятинуклеотидной последовательностью связываются белки DnaA, которые формируют большой агрегат. ДНК ориджина опоясывает его, и цепи ДНК разъединяются в области трех 13-членных последовательностей. На следующем этапе присоединяются белки DnaB (хеликаза) и DnaC, формируя агрегат размером 480 кДа, с радиусом 6 нм. Хеликаза/DnaB обеспечивает разрыв водородных связей между азотистыми основаниями в двойной цепи ДНК, приводя к ее денатурации, т.е. расхождению нитей.
В
результате выпрямления и денатурации
двойной спирали ДНК формируется вилка
репликации, имеющая Y-образную форму
(рис). Именно в этой репликационной вилке
ДНК-полимеразы синтезируют дочерние
молекулы ДНК. Такой участок ДНК выглядит
как пузырек или «глазок» в нереплицированной
ДНК. Репликационные «глазки» образуются
в тех местах, где находятся точки начала
репликации. Когда цепи ДНК разъединены,
молекула становится довольно подвижной.
Все возможные нарушения в структуре
одиночных цепей исключаются благодаря
действию белков
SSВ
(single-strand DNA-binding proteins или helix-destabilizing
proteins), которые, связываясь с, одиночными
цепями ДНК, препятствуют их слипанию.