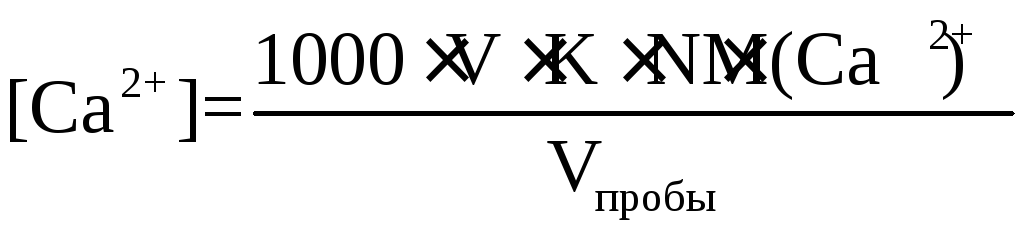- •Лабораторные работы по промышленной экологии
- •Оглавление
- •Предисловие
- •Нейтрализация сточных вод
- •Очистка промышленных стоков гальванопроизводств
- •Роданидный метод определения железа
- •Определение содержания хрома с применением дифенилкарбазида
- •Обессоливание воды ионитами
- •Предотвращение карбонатных отложений
- •Определение общей щелочности
- •Определение содержания ионов кальция
- •Определение сухого и прокаленного остатка
- •Приложение а Температурные поправки апри нагреве охлаждающей воды
- •Приложение б График для определения рН равновесного насыщения воды карбонатом кальция
- •Приложение в Рабочая программа дисциплины «Промышленная экология»
- •Содержание дисциплины
- •Лабораторные работы (68 часов)
- •Самостоятельная работа
- •Вопросы к экзамену
- •Рекомендуемая литература
- •Лабораторные работы по промышленной экологии
- •690950, Г. Владивосток, ул. Октябрьская, 27.
Определение общей щелочности
Принцип метода
Метод основан на взаимодействии гидрокарбонатов и карбонатов с соляной кислотой (ацидиметрический метод). При наличии карбонат-ионов в исследуемой пробе реакция протекает в 2 этапа:
|
CO32- + H+ → HCO3- |
(9) |
|
HCO3- + H+ → H2O + CO2 |
(10) |
При отсутствии карбонат-ионов реакция протекает в один этап согласно уравнению (10). О величине щелочности судят по количеству израсходованной соляной кислоты. Выделяемая при реакции углекислота удаляется продуванием через раствор воздуха, свободного от углекислого газа. В качестве поглотителя углекислого газа используется натронная известь или аскарит (волокнистый асбест, пропитанный раствором NaOH). Для установления точки эквивалентности используются индикаторы метилоранж (при определении гидрокарботов) и фенолфталеин (при определении карбонатов).
Реактивы
Соляная кислота, 0,02 N раствор;
Тетраборат натрия (Na2B4O7), 0,02 N раствор;
Индикатор метилоранж, 0,1 %-ный раствор;
Индикатор фенолфталеин, 1 %-ный раствор.
Определение нормальности соляной кислоты
Для определения поправочного коэффициента к нормальности НС1 пользуются точным 0,02 N раствором тетрабората натрия (бурой).
В коническую колбу на 250 мл отмеряют пипеткой 15 мл 0,02 N раствора буры, добавляют 85 мл дистиллированной воды и 2-3 капли метилоранжа. Титруют раствором соляной кислотой до перехода окраски от желтой до слабо-оранжевой с розовым оттенком. Окраска должна быть устойчива в течение 2-3 мин. Поправочный коэффициент к нормальности HCl рассчитывают по формуле:
|
|
(18) |
|
где V(бура) – объем раствора буры, мл; V(HCl) – объем раствора соляной кислоты, пошедший на титрование 15 мл раствора буры, мл. |
|
Определение общей щелочности в пробе
Пипеткой отмеряют 100 мл испытуемой пробы в коническую колбу, добавляют 5 капель 1%-ного раствора фенолфталеина. Если в пробе присутствует карбонат-ион то проба должна окраситься в розовый цвет. Осторожно, по каплям, пробу титруют раствором HCl до обесцвечивания. Записывают количество НСl, израсходованное на титрование пробы в присутствии фенолфталеина (n1). Если проба не содержит карбонатных ионов, то после добавления фенолфталеина она остается бесцветной. И в первом случае, когда проба уже оттитрована раствором HCl до бесцветной, и во втором случае, когда проба остается бесцветной, в исследуемую пробу добавляют 2-3 капли индикатора метилоранжа и титруют до слабо-оранжевой окраски с розовым оттенком. Следует обратить внимание на то, что в первом случае титрование продолжают, не доливая раствор НСl в бюретку. Записывают суммарный объем НСl, пошедший на титрование (n). Общую щелочность вычисляют по формуле:
|
|
(19) |
|
где Alk– общая щелочность, мэкв/л; 1000 – пересчет миллилитров в литры; n– объемHCI, израсходованный на титрование, мл; N – нормальность раствора НСl(0,02N); K– поправочный коэффициент к нормальности НСl; V– объTм пробы, мл. |
|
Определение содержания ионов кальция
Принцип метода
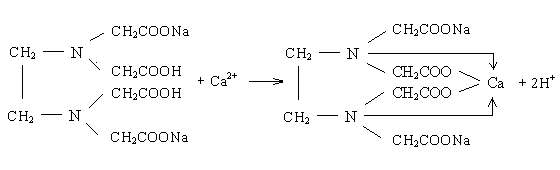
Для определения общей жесткости пользуются объемным трилонометрическим методом. Основным рабочим раствором является трилон Б – двунатриевая соль этилендиаминтетрауксусной кислоты. Определение суммарного содержания ионов кальция и магния основано на способности трилона Б образовывать прочные комплексные соединения в щелочной среде с этими ионами, замещая ионы водорода на двухвалентные катионы кальция и магния:
|
|
(11) |
В качестве индикатора используется хромоген, дающий с магнием соединения винно-красного цвета, при исчезновении ионов магния он приобретает голубую окраску. Реакция идет при рН = 10, что достигается добавлением в пробу аммиачного буферного раствора.
При титровании пробы воды, содержащей ионы кальция и магния, трилоном Б в первую очередь связываются ионы кальция, а затем магния. При исчезновении ионов магния окраска раствора меняется на голубую, что свидетельствует об окончании титрования и достижении точки эквивалентности.
Реактивы
Трилон Б, 0,02 N раствор;
Сульфат магния, 0,02 N раствор;
Аммиачный буферный раствор. 20 г NH4Cl растворяют в 500 мл дистиллированной воды, прибавляют 100 мл 25 % NH3·H2О и доводят до 1 л дистиллированной водой;
Гидроксид натрия, 2 N раствор;
Индикатор хромоген;
Индикатор мурексид.
Установление нормальности трилона Б
Определение нормальности производят по точному 0,02 N раствору сульфата магния. В коническую колбу отмеривают 10 мл 0,02 N раствора MgSO4, 50 мл дистиллированной воды (отмеривают мерным цилиндром), добавляют 5 мл аммиачного буфера, 5 капель хромогена. Титруют раствором трилона Б до перехода винно-красной окраски через фиолетовую к голубой. Поправочный коэффициент к нормальности раствора трилона Б вычисляют по формуле:
|
|
(20) |
|
где V(MgSO4) – объем раствора сульфата магния, мл; V(трилон Б) – объем раствора трилона Б, пошедшего на титрование 10 мл раствора сульфата магния, мл. |
|
Определение концентрации ионов кальция
В коническую колбу отмеривают 100 мл исследуемой воды, добавляют 2 мл 2 N раствора NaOH, 5 мл аммиачного буфера и 5 капель мурексида. Титруют до перехода окраски из винной в лиловую. Рассчитывают концентрацию ионов кальция (мг/л) по формуле:
|
|
(21) |
|
где N– нормальность раствора трилона Б, моль/л; 1000 – пересчет миллилитров в литры; V– объем трилона Б, израсходованный на титрование пробы, мл; K– поправочный коэффициент к нормальности трилона Б; Vпробы– объем пробы воды, мл; М(Ca2+) – молярная масса эквивалента кальция, г/моль. |
|

 ,
,
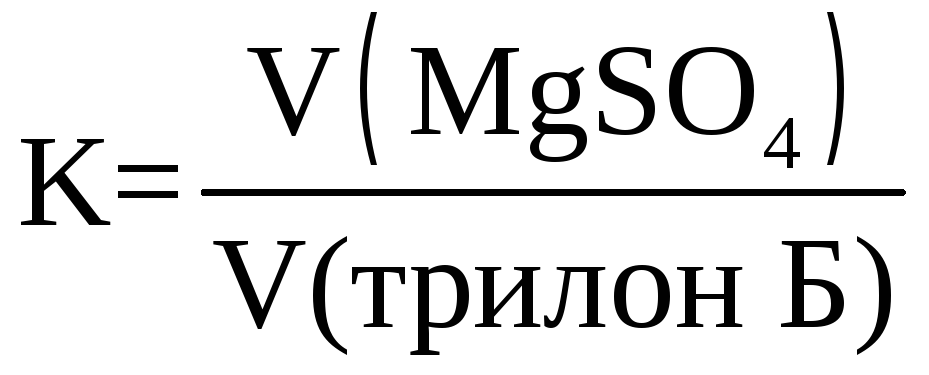 ,
,