
- •Лабораторные работы по промышленной экологии
- •Оглавление
- •Предисловие
- •Нейтрализация сточных вод
- •Очистка промышленных стоков гальванопроизводств
- •Роданидный метод определения железа
- •Определение содержания хрома с применением дифенилкарбазида
- •Обессоливание воды ионитами
- •Предотвращение карбонатных отложений
- •Определение общей щелочности
- •Определение содержания ионов кальция
- •Определение сухого и прокаленного остатка
- •Приложение а Температурные поправки апри нагреве охлаждающей воды
- •Приложение б График для определения рН равновесного насыщения воды карбонатом кальция
- •Приложение в Рабочая программа дисциплины «Промышленная экология»
- •Содержание дисциплины
- •Лабораторные работы (68 часов)
- •Самостоятельная работа
- •Вопросы к экзамену
- •Рекомендуемая литература
- •Лабораторные работы по промышленной экологии
- •690950, Г. Владивосток, ул. Октябрьская, 27.
Обессоливание воды ионитами
Ионообменный метод опреснения или обессоливания воды основан на последовательной фильтрации ее через Н+- катионитовый и ОН-, СО32-или НСО3-- анионитовый фильтр. В Н+- катионитовом фильтре содержащиеся в воде катионы, главным образом Сa2+,Mg2+,Na+,Fe3+и другие, обмениваются на катионы Н+согласно уравнениям (3)-(5):
|
H[Kat] + NaCl → Na[Kat] + HCl |
(3) |
|
2H[Kat] + Na2SO4 → 2Na[Kat] + H2SO4 |
(4) |
|
2H[Kat] + Ca(HCO3)2 → Ca[Kat]2 + 2CO2↑ + H2O |
(5) |
После пропускании воды через Н+- катионовые фильтры, анионы образовавшихся кислот обмениваются на гидроксид-, карбонат- либо гидрокарбонат-ионы на ОН--анионовых (или других) фильтрах по уравнениям (6)-(8):
|
[An]2CO3 + H2SO4 → [An]2SO4 + CO2↑ + H2O |
(6) |
|
[An]OH + HCl → [An]Cl + H2O |
(7) |
|
[An]HCO3 + HCl → [An]Cl + CO2↑ + H2O |
(8) |
Образующийся в процессе разложения гидрокарбонатов углекислый газ удаляется в дегазаторе или разбрызгиванием в градирнях. На ионообменные установки подается вода, содержащая более 3 г/л соли, при этом содержание сульфатов и хлоридов не должно превышать 0,5 г/л, взвешенных веществ должно быть до 8 мг/л, цветность – до 30 ˚, перманганатная окисляемость – до 7 мг О/л. При большей окисляемости и цветности следует предусмотреть предварительное фильтрование через фильтр с активированным углем.
Изучение процесса обессоливания в лабораторных работах проводится на двух ионообменных колонках, заполненных специально подготовленными катионитом и анионитом. В исследуемой воде предварительно определяют солесодержание, мутность и величину перманганатной окисляемости. При превышении величины мутности проводят предварительное осветления коагулированием и снижение окисляемости углеванием. Контроль за эффективностью обессоливания проводят либо по величине общего солесодержания, либо по величине удельной электропроводности.
Цель работы – провести обессоливание морской воды ионообменным методом и оценить эффективность процесса обессоливания по изменению электропроводности раствора морской воды.
Ход работы
Проба воды, подготовленная соответствующим образом (по мутности и окисляемости), в объеме 200-300 мл последовательно фильтруется через катионит в Н+- форме и анионит в ОН-илиHCO3-- форме. Скорость фильтрования устанавливается на уровне одна капля в секунду. Первые порции фильтрата (20-30) мл отбрасываются. После окончания фильтрования через анионит проводят определение солесодержания либо удельной электропроводности. Остаточное солесодержание при ступенчатом (одноступенчатом в данном случае) ионировании должно составить около 20 мг/л, что соответствует удельной электропроводности 35-45 мкОм-1·см-1. После окончания фильтрования проводят регенерацию ионообменников растворами соляной кислоты (5 %-ный раствор), щелочи или соды. Расход воды на промывку ионита принимают 10 м3/м3ионита.
Удельная электропроводность растворов электролитов
Растворы кислот солей и оснований обладают способностью проводить электрический ток. Переносчиками тока в растворах электролитов являются катионы и анионы, которые образуются в результате их электролитической диссоциации. Подобно проводникам первого рода (металлам) растворы электролитов подчиняются закону Ома (уравнение 3):
|
|
(3) |
|
где ρ – удельное сопротивление, Ом·см; l– расстояние между электродами, см; s– площадь электрода, см2; R– сопротивление проводника, Ом. |
|
Удельная электропроводность рассчитывается по уравнению (4):
|
æ
|
(4) |
|
где æ – удельная электропроводность, Ом-1·см-1; ρ – удельное сопротивление, Ом·см. |
|
Удельная электропроводность электролита является величиной обратной сопротивлению столба раствора длиной 1 см с площадью поперечного сечения в 1 см2. Измеряется удельная электропроводность в См/м или ом-1см-1.
Специфическая особенность растворов электролитов состоит в том, что проводящая способность зависит от индивидуальных свойств ионов, от концентрации их общего числа в единице объема раствора, поэтому электропроводность определяется концентрацией растворов.
В связи с тем, что величина удельной электропроводности сильно зависит от концентрации, пользуются величиной удельной электропроводности, отнесенной к молярной концентрации эквивалента, обозначаемой λv. Отношение æ/с называют эквивалентной электропроводностью. Уравнения (5)-(7) связывают удельную и эквивалентную электропроводности:
|
λv= V·æ; |
(5) |
|
|
(6) |
|
λv= |
(7) |
|
где С – молярная концентрация эквивалента, моль/л; V – объем, cм3; λv– эквивалентная электропроводность, см2ом-1 ·моль-1. |
|
Измерению электропроводности раствора предшествует определение константы ячейки (С٭), в которой проводятся измерения. Если бы расстояние между электродами в сосуде точно равнялось 1 см, а площадь каждого электрода равна 1 см2и в проведении тока участвовал только объем раствора, заключенного между электродами, то измеренная в таких условиях электропроводность представляла бы истинную удельную электропроводность раствора.
В действительности электропроводность раствора зависит не только от размеров электродов и расстояния между ними, но и от их формы и взаимного расположения и объема раствора, поэтому удельная электропроводность не равна измеренной, а ей пропорциональна согласно уравнению (8):
|
æист.= С*·æэ, |
(8) |
|
где æист.– истинная удельная электропроводность раствора, Ом-1·см-1; æэ– экспериментальная удельная электропроводность раствора, Ом-1·см-1; С*- константа ячейки. |
|
Порядок определения удельной электропроводности растворов и эффективности процесса обессоливания
Приготовить растворы хлорида калия из раствора хлорида калия с молярной концентрацией эквивалента 0,1 моль/л по таблице 2. Для разбавления растворов используются мерные колбы объемом 50 мл, за исключением концентраций 0,0005 моль/л, 0,001моль/л, – для них используются мерные колбы на 100 мл;
Таблица 2 – Эквивалентная электропроводность водных растворов KClразличных концентраций
|
С, моль/л |
0,0005 |
0,001 |
0,005 |
0,01 |
0,02 |
0,03 |
0,10 |
|
мл раствора KCl, 0,1 моль/л |
0,5 |
1 |
2,5 |
5 |
10 |
15 |
50 |
|
λ, ом-1·моль-1·см2 |
147,8 |
146,4 |
143,5 |
141,3 |
138,3 |
133,4 |
129,0 |
Для каждого приготовленного раствора измерить удельную электропроводность (æэ) на кондуктометре ОК – 102/1;
Вычислить истинную удельную электропроводность (æист.) для каждого раствора таблицы 2 по формуле (7);
Вычислить константу ячейки (C*) для каждой концентрации таблицы 2 по формуле (8);
Вычислить среднее арифметическое полученных значений констант ячейки (
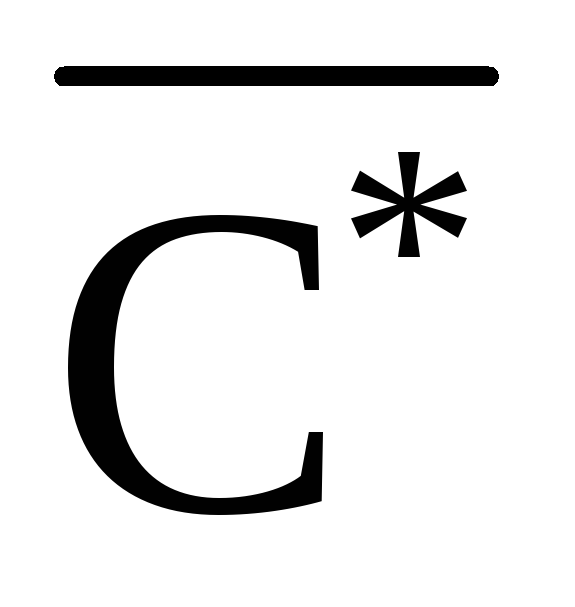 );
);Измерить на кондуктометре удельную электропроводность (æэ) морской воды до и после фильтрования на катионите и анионите;
Вычислить истинную удельную электропроводность (æист.) морской воды до и после фильтрования на катионите и анионите по формуле (9):
æист.= æэ·
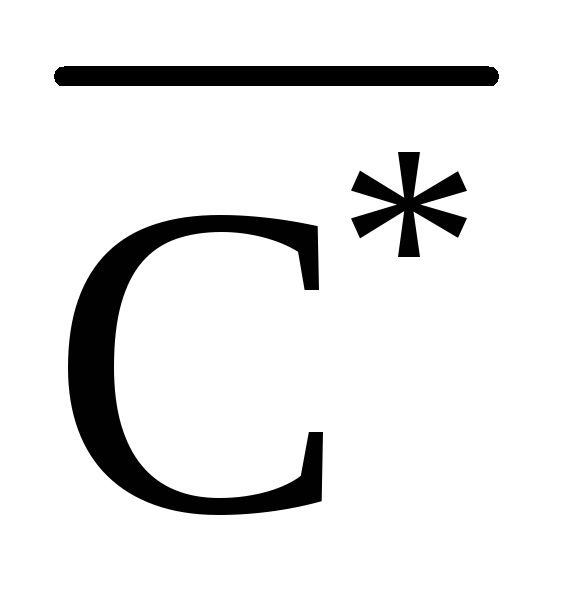 ,
,(9)
где æист.– истинная удельная электропроводность раствора, Ом-1·см-1;
æэ– экспериментальная удельная электропроводность раствора, Ом-1·см-1;
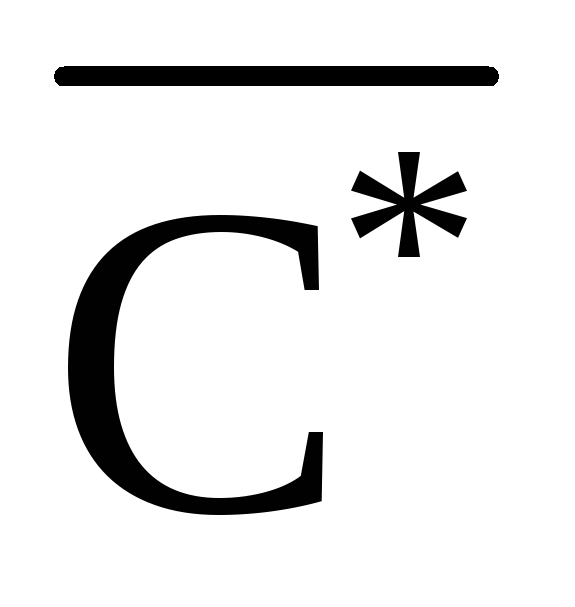 - константа ячейки.
- константа ячейки.Вычислить относительную электропроводность морской воды до и после фильтрования на катионите и анионите по формуле (10):
R20= æист/æ35‰,
(10)
где æ35‰– электропроводность нормальной морской воды (49,895·10-3·ом-1·см-1).
По значению относительной электропроводности R20, используя океанографические таблицы, определить соленость морской воды до и после фильтрования на катионите и анионите (S, ‰);
Рассчитать эффективность ионообменного метода обессоливания морской воды по формуле (11):
|
|
(11) |
|
где S1– соленость морской воды до фильтрования на ионитах, ‰; S2– соленость морской воды после фильтрования на ионитах, ‰. |
|
